富含支链氨基酸汉麻分离蛋白酶解物制备及其品质评价
2020-05-16赵艳霞
吴 蔚,赵艳霞
(武汉职业技术学院 生物工程学院,武汉 430074)
汉麻,俗称大麻,汉麻籽中油脂和蛋白质含量分别为40%~50%和25%~30%[1]。我国是全球汉麻籽最大生产国和出口国,目前汉麻籽的主要利用方式是提取汉麻纤维和制备高端植物油,而剩下大量富含蛋白质的汉麻籽粕。如何充分利用丰富的汉麻籽粕资源开发高品质的汉麻籽蛋白粉及其衍生物,已成为目前汉麻产业发展的重大问题[2]。
汉麻蛋白含有25%~37%的白蛋白和67%~75%的球蛋白,相比大豆分离蛋白,汉麻蛋白必需氨基酸含量更高[1],同时富含含硫氨基酸[3],且不含胰蛋白酶抑制剂,因而具有良好的消化吸收特性。此外,研究表明汉麻蛋白中精氨酸与赖氨酸的比值为5.5[4],表明汉麻蛋白在预防心血管疾病等方面具有更高的潜在应用价值。目前,食品生产加工过程中汉麻蛋白的应用越来越多,如汉麻蛋白食用膜[5]、汉麻蛋白饮料[6]、汉麻面包[7]等。对汉麻蛋白深加工利用也有很多报道,如降血压汉麻肽[8]、抗氧化汉麻肽[9]等。此外,还有研究报道汉麻蛋白具有增强免疫力和抗疲劳等功效[10-11],因此汉麻蛋白在开发功能性产品领域具有广阔的应用前景。据世界卫生组织统计显示,全球约有1/3的人处于疲劳状态,疲劳会降低学习和工作效率,特别是对于竞技体育训练运动而言,如何缓解高强度训练疲劳程度,有效提高运动员的竞技能力,是目前食品科学研究的一个热点问题。目前,已有研究报道各种蛋白水解物具有一定的抗疲劳功能,如高F值玉米肽[12]、富含支链氨基酸多肽[13]等。然而,目前还没有高F值或富含支链氨基酸汉麻肽的研究报道。
本试验以汉麻籽粕为主要原料,采用胃蛋白酶和风味蛋白酶依次对汉麻籽粕进行酶解,然后利用活性炭将芳香族氨基酸除去,得到富含支链氨基酸的汉麻分离蛋白酶解物,并对其溶解特性和抗氧化性进行研究,为提高汉麻籽粕附加值和精深加工提供理论参考。
1 材料与方法
1.1 试验材料
汉麻籽粕:广西巴马,蛋白质含量(53.15±1.33)%、脂肪含量小于1%。胃蛋白酶(50 100 U/g)、风味蛋白酶(102 400 U/g),上海索莱宝生物科技有限公司;2,2-二苯基-1-苦基肼(DPPH),Sigma公司;盐酸、邻苯三酚、铁氰化钾、三氯化铁均为分析纯。
pH-2型酸度计;LAMBDA 365紫外光谱,美国珀金埃尔默股份有限公司;恒温水浴锅;BS224S分析天平,赛多利斯科学有限公司;高速离心机;HX-1800全自动氨基酸分析仪;ALPHA 1-4 LD plus冷冻干燥机,德国Christ。
1.2 试验方法
1.2.1 富含支链氨基酸汉麻分离蛋白酶解物生产工艺
汉麻籽粕(60 目)→碱提酸沉→汉麻分离蛋白(HPI)→胃蛋白酶酶解→风味蛋白酶酶解→活性炭脱芳→冷冻干燥→富含支链氨基的汉麻分离蛋白酶解物(E-HPI)。
碱提酸沉工艺:按料液比1∶10加入0.05 mol/L氢氧化钠溶液在pH 8条件下碱提1 h,离心(4 000 r/min,30 min),上清液用1 mol/L HCl调pH至5,静置30 min,离心(4 000 r/min,30 min),将沉淀用适量蒸馏水溶解,调pH至7,冷冻干燥得到汉麻分离蛋白[4]。
HPI提取率=HPI中蛋白质含量/原料中蛋白质含量×100%
胃蛋白酶酶解工艺:取10 g HPI加入一定量的去离子水摇匀,加入一定量胃蛋白酶,在一定温度下酶解一定时间,得到初步酶解液。
风味蛋白酶酶解工艺:采用风味蛋白酶酶解初步酶解液,以水解度为评价指标,在设定条件下,分别考察酶添加量、酶解时间、酶解温度和酶解pH对酶解效果的影响。
脱芳工艺:取风味蛋白酶酶解液按料液比1∶10 加入活性炭,在pH 3、温度40℃条件下振荡脱芳2 h。
1.2.2 水解度测定
参照GB/T 5009.39—2003,采用甲醛滴定法测定水解度。
1.2.3 芳香族氨基酸含量测定
参照刘金伟[12]的方法测定芳香族氨基酸含量。将脱芳离心后的酶解液稀释100倍后在280 nm波长下测定吸光值,以A280表示酶解液中芳香族氨基酸含量,终产品中的芳香族氨基酸含量采用氨基酸自动分析仪进行测定。
1.2.4 氨基酸组成测定及F值计算
氨基酸组成测定采用HX-1800全自动氨基酸分析仪参照Ursu等[14]的方法进行,样品在6 mol/L HCl、110℃条件下酸解22 h后过滤上样,结果取两次平均值,F值按下式计算[12]。
F值=(Val+Ile+Leu)/(Phe+Tyr)
注:式中氨基酸简写指摩尔数。
1.2.5 抗氧化性分析
1.2.5.1 DPPH自由基清除率测定
根据Nicklisch等[15]的方法测定DPPH自由基清除率。
1.2.5.2 羟基自由基(·OH)清除率的测定
·OH清除率的测定参照Nimse等[16]的方法。
1.2.6 溶解度测定
溶解度测定参考Malomo等[4]的方法。
1.2.7 数据分析
采用Excel 2013、Origin 2017和SPSS 22.0对数据进行处理、绘图和显著性分析(LSD,P<0.05),除有特殊说明外,试验均进行3次平行试验,结果以“平均值±标准偏差”表示。
2 结果与分析
2.1 胃蛋白酶酶解工艺
2.1.1 单因素试验
2.1.1.1 料液比对水解度的影响
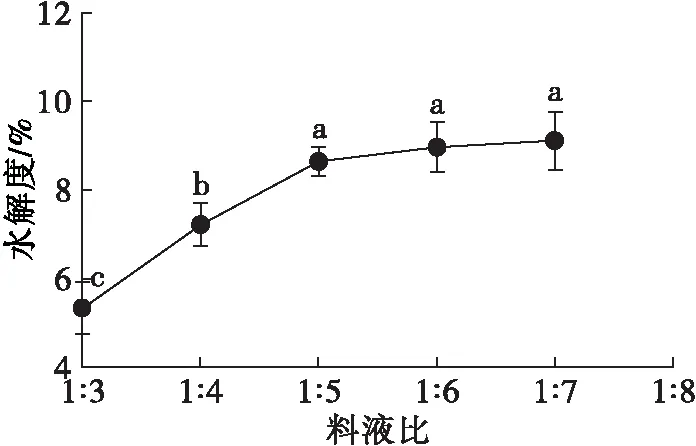
碱提酸沉得到的HPI蛋白质含量为(86.23±2.37)%,提取率为(67.78±1.93)%。在酶添加量0.6%、酶解pH 3、酶解时间3 h、酶解温度37℃条件下,考察不同料液比对HPI水解度的影响,结果如图1所示。
注:不同字母表示存在显著性差异(P<0.05),下同。
图1 料液比对水解度的影响
由图1可知,胃蛋白酶酶解过程中水解度随着料液比增大先增大后趋于平稳。酶添加量一定时,料液比决定了酶与底物浓度大小,当料液比小于 1∶5时,酶与底物结合未饱和,可能是在低料液比条件下,体系黏稠度较大,阻碍了酶与底物的结合,因而在料液比由1∶3增大至1∶5过程中,水解度以较大速率增大;在料液比为1∶5时,底物与酶结合达到饱和状态,此时水解度为8.63%,且随着料液比继续增大,酶与底物浓度均被稀释,导致结合速率减慢,因而水解度增长缓慢[17]。因此,选取料液比 1∶5为宜。
2.1.1.2 酶添加量对水解度的影响
在料液比1∶5、酶解pH 3、酶解时间3 h、酶解温度37℃条件下,考察不同酶添加量对HPI水解度的影响,结果如图2所示。
由图2可知,随着酶添加量的增大,水解度逐渐增大并趋于平稳。当酶添加量小于0.9%时,底物浓度相对于酶浓度过剩,因而随着酶添加量的增大,酶与底物结合量增多,水解度增大;在酶添加量为0.9%时,酶与底物结合基本达到饱和,水解度为9.56%;而当酶添加量继续增大,酶过量,酶之间存在竞争结合位点,因而导致水解度增长缓慢。因此,选取酶添加量0.9%为宜。
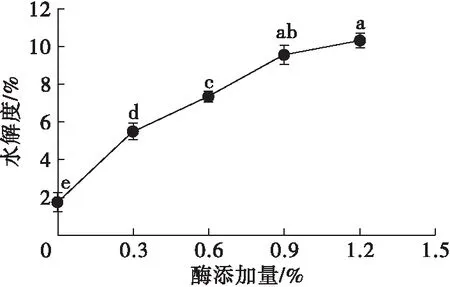
图2 酶添加量对水解度的影响
2.1.1.3 酶解pH对水解度的影响
在料液比1∶5、酶添加量0.9%、酶解时间3 h、酶解温度37℃条件下,考察不同酶解pH对HPI水解度的影响,结果如图3所示。
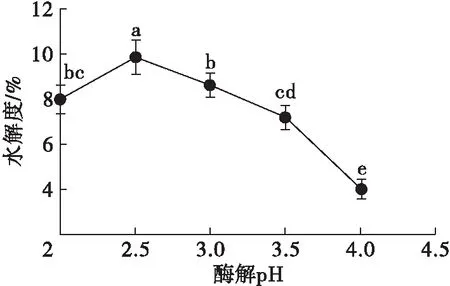
图3 酶解pH对水解度的影响
由图3可知,在pH 2~4范围内,水解度先增大后急剧减小,在pH 2.5时水解度最大,为9.88%。这是因为胃蛋白酶最适pH 在2.5左右,当pH偏离2.5后,胃蛋白酶部分失活,导致水解度下降。因此,选取酶解pH 2.5为宜。
2.1.1.4 酶解时间对水解度的影响
在料液比1∶5、酶添加量0.9%、酶解pH 2.5、酶解温度37℃条件下,考察不同酶解时间对HPI水解度的影响,结果如图4所示。
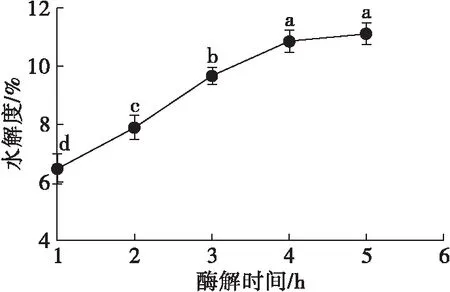
图4 酶解时间对水解度的影响
由图4可知,水解度随着酶解时间的延长先增大后趋于平稳,酶解4 h水解度达到最大值,为10.87%。在酶解时间短于4 h时,酶与底物充足且结合未达到饱和,因而随着酶解时间的延长,水解度增加;而当酶解时间超过4 h后,底物减少,且部分酶失活,导致水解度增长缓慢,甚至不增长。因而,选取酶解时间4 h为宜。
2.1.2 正交试验
在单因素试验基础上,固定酶解温度为37℃,以料液比、酶添加量、酶解pH、酶解时间为因素,以水解度为响应指标,通过四因素三水平L9(34)正交试验对胃蛋白酶酶解工艺进行优化,正交试验因素水平见表1,正交试验设计及结果见表2。
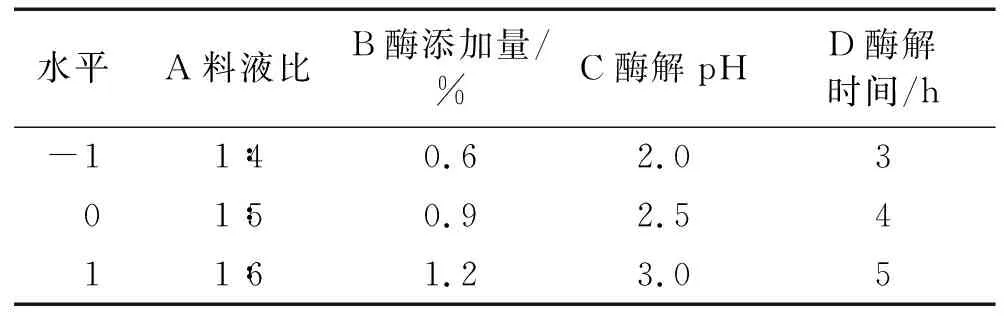
表1 正交试验因素水平
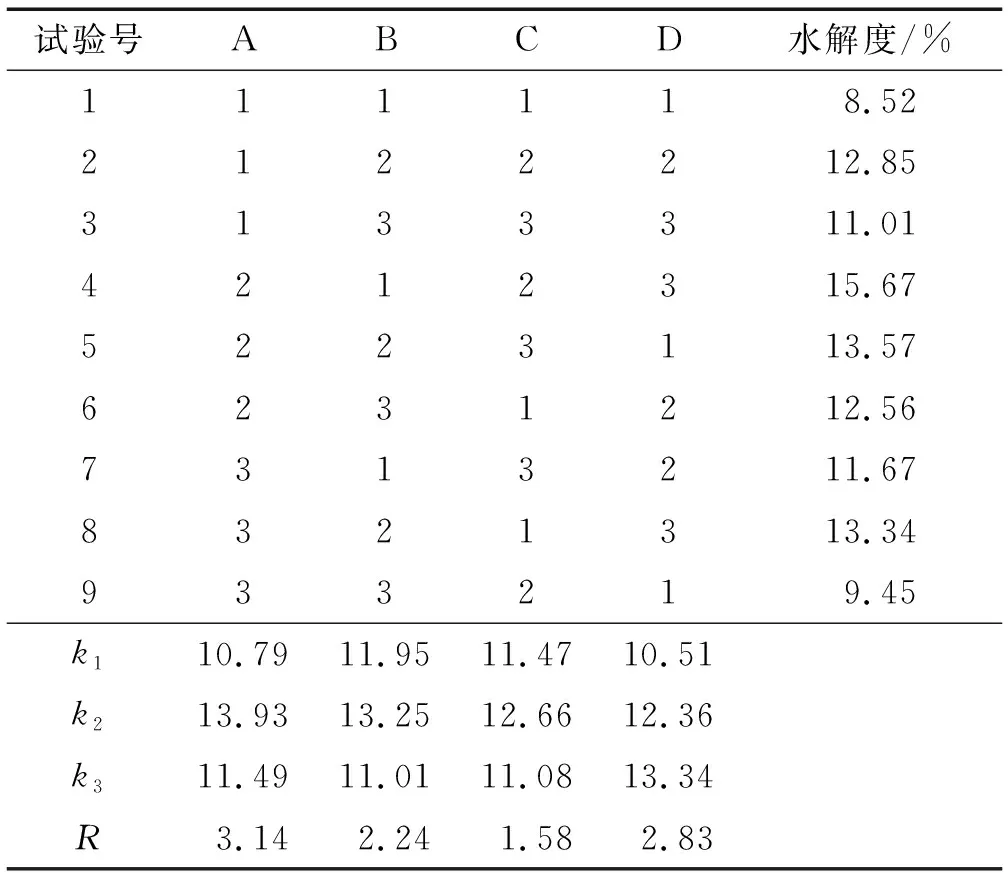
表2 正交试验设计及结果
由表2可知:4个因素对水解度的影响程度大小依次为A>D>B>C,即料液比>酶解时间>酶添加量>酶解pH;经正交试验优化得到的胃蛋白酶酶解HPI最佳工艺条件为A2B2C2D3,即料液比1∶5、酶添加量0.9%、酶解pH 2.5和酶解时间5 h,在该条件下进行3次验证试验,得到的水解度为(14.52±0.23)%。
2.2 风味蛋白酶酶解工艺优化
2.2.1 单因素试验
采用2.1.2优化的胃蛋白酶酶解条件对HPI进行酶解后,测定其A280为0.102±0.003,进行下一步风味蛋白酶酶解试验。
2.2.1.1 酶解温度对水解度和A280的影响
设定酶添加量为0.6%、酶解pH为7、酶解时间为3 h,考察不同酶解温度对HPI水解度和A280的影响,结果如图5所示。
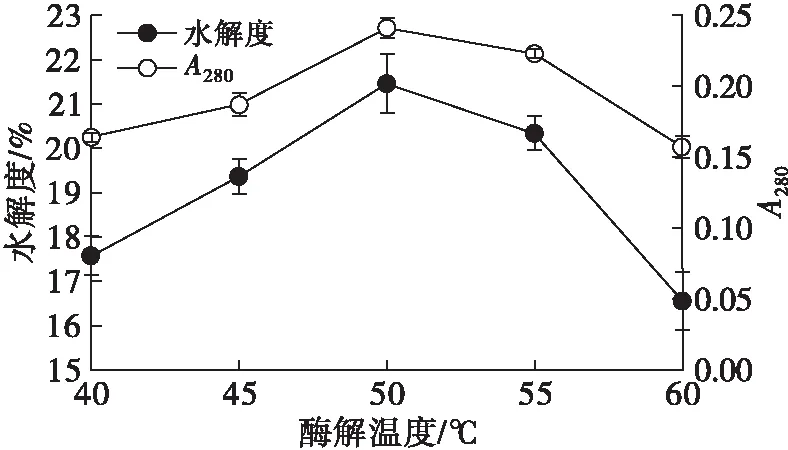
图5 酶解温度对水解度和A280的影响
由图5可知,A280和水解度随着酶解温度的增大呈先增大后减小的趋势,当酶解温度为50℃时,水解度达到最大,为21.45%。A280与水解度变化趋势基本一致,推测可能是因为HPI经胃蛋白酶广泛特异性切开疏水性氨基,使得肽链两端的芳香族氨基酸含量增加,而风味蛋白酶具有专一性切除N端芳香族氨基酸的能力,且A280与芳香族氨基酸含量存在线性关系,因而A280与水解度变化趋势基本一致[18]。风味蛋白酶最适温度为50℃左右,因此选取酶解温度为50℃。
2.2.1.2 酶添加量对水解度和A280的影响
设定酶解温度为50℃、酶解pH为7、酶解时间为3 h,考察不同酶添加量对HPI水解度和A280的影响,结果如图6所示。

图6 酶添加量对水解度和A280的影响
由图6可知,随着酶添加量的增大,A280和水解度逐渐增大并趋于平稳。当酶添加量小于0.8%时,底物浓度大于酶浓度,因而随着酶添加量的增大,酶与底物结合量增多,水解度增大;在酶添加量为0.8%时,酶与底物结合基本达到饱和,水解度为24.78%;而当酶添加量继续增大,酶过量,酶之间存在竞争结合位点,因而导致水解度增长缓慢。因此,选取酶添加量为0.8%。
2.2.1.3 酶解pH对水解度和A280的影响
设定酶解温度为50℃、酶添加量为0.8%、酶解时间为3 h,考察不同酶解pH对HPI水解度和A280的影响,结果如图7所示。
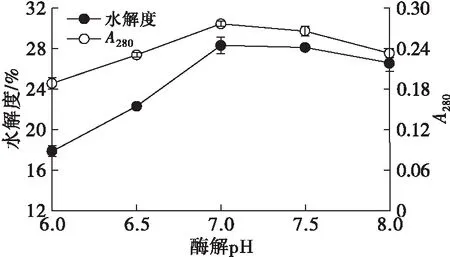
图7 酶解pH对水解度和A280的影响
由图7可知,在pH 6~8范围内,A280和水解度先增大后减小,在pH 7时水解度最大,为28.33%。这是因为风味蛋白酶最适pH 在7左右,当pH偏离7后,风味蛋白酶部分失活,导致水解度下降。因此,选择酶解pH 7较适宜。
2.2.1.4 酶解时间对水解度和A280的影响
设定酶解温度为50℃、酶添加量为0.8%、酶解pH为7,考察不同酶解时间对HPI水解度和A280的影响,结果如图8所示。
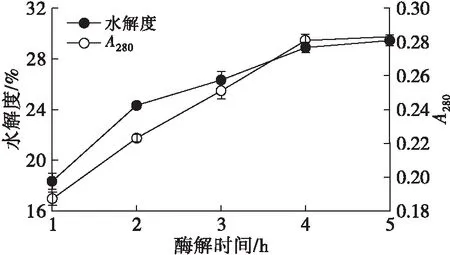
图8 酶解时间对水解度和A280的影响
由图8可知,A280和水解度随着酶解时间的延长先增大后趋于平稳,基本在酶解4 h后水解度达到最大值,为28.89%。在酶解时间短于4 h时,酶与底物充足且结合未达到饱和,因而随着酶解时间的延长,水解度增加;当酶解时间超过4 h后,底物减少,且部分酶失活[12],导致水解度增长缓慢。因此,选择酶解时间4 h为宜。
2.2.2 正交试验
在单因素试验基础上,以水解度和A280为响应指标,通过四因素三水平L9(34)正交试验对风味蛋白酶酶解工艺进行优化,正交试验因素水平见表3,正交试验设计及结果见表4。

表3 正交试验因素水平

表4 正交试验设计及结果
由表4可知:4个因素对水解度的影响程度大小依次为A>C>D>B,即酶解温度>酶解pH>酶解时间>酶添加量;对A280的影响程度大小依次为A>D>C>B,即酶解温度>酶解时间>酶解pH>酶添加量。经正交试验得到水解度最大的最佳工艺条件为A2B2C2D2,而A280最大的最佳工艺条件为A2B3C2D3,经综合分析最终确定风味蛋白酶最佳工艺条件为酶解温度50℃、酶添加量0.8%、酶解pH 7和酶解时间4 h,在该条件下进行3次验证试验,水解度为(33.01±0.43)%,A280为0.321±0.002。
2.3 氨基酸组成
HPI及E-HPI的氨基酸组成分析结果见图9。

注:1.天冬氨酸; 2.苏氨酸; 3.丝氨酸; 4.谷氨酸; 5.甘氨酸; 6.丙氨酸; 7.半胱氨酸; 8.缬氨酸; 9.甲硫氨酸; 10.异亮氨酸; 11.亮氨酸; 12.酪氨酸; 13.苯丙氨酸; 14.组氨酸; 15.赖氨酸; 16.精氨酸; 17.脯氨酸。
图9 HPI与E-HPI的氨基酸组成
由图9可知,HPI酶解后氨基酸组成发生很大变化,其中芳香族氨基酸变化最大,E-HPI中其含量最少,这是因为胃蛋白酶将两头具有芳香族氨基酸的肽键切开后,进一步经过风味蛋白酶将暴露的疏水性氨基酸切掉[18],最后通过活性炭将游离的芳香族氨基酸吸附除去。因此,E-HPI中苯丙氨酸和酪氨酸含量最少。
酶解前,HPI中支链氨基酸含量为18.42%,E-HPI 中的含量为23.37%,经过胃蛋白酶和风味蛋白酶酶解后支链氨基酸含量显著提高,F值由原来的2.07提升至22.35。表明该工艺制备的E-HPI 富含支链氨基酸,具有作为增肌运动蛋白粉的潜在应用价值。
2.4 E-HPI品质评价
2.4.1 溶解性
不同pH对HPI及E-HPI溶解度的影响见图10。

图10 不同pH对HPI和E-HPI溶解度的影响
从图10可以看出,与HPI相比,E-HPI的溶解度极显著提高(P<0.01),改善了HPI溶解性差的缺陷,pH 5条件下E-HPI也具有相当高的溶解度,表明经过两步酶解后,彻底改变了大部分HPI原有分子结构,使得E-HPI溶解度得到大大提升,pH 7时其溶解度为(83.67±2.45)%,这为汉麻分离蛋白在饮料等领域的应用提供了可能。
2.4.2 抗氧化性(见表5)
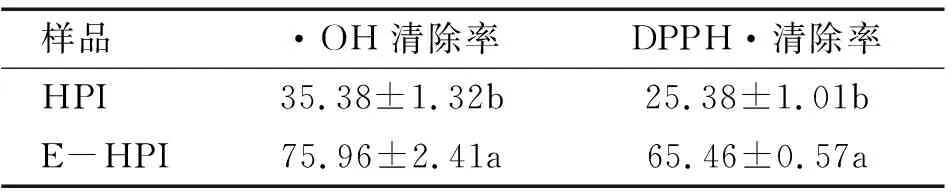
表5 HPI与E-HPI的抗氧化性 %
注:同列不同字母表示存在显著性差异(P<0.05)。HPI与E-HPI的质量浓度均为1 mg/mL。
由表5可知,E-HPI的·OH清除率和DPPH·清除率分别为75.96%和65.46%,相比HPI,分别提高了1.15倍和1.58倍,这与Teh等[8]研究汉麻蛋白经过蛋白酶水解后DPPH·清除率提高结果相符。E-HPI抗氧化性的提高可能与酶解过程中产生的小肽有关。
3 结 论
本试验采用胃蛋白酶和风味蛋白酶分步酶解、辅助活性炭脱芳制备富含支链氨基酸的汉麻分离蛋白酶解物,经正交试验得到最佳工艺条件:第一步胃蛋白酶酶解条件为料液比1∶5、酶添加量0.9%、酶解pH 2.5、酶解时间5 h、酶解温度37℃;第二步风味蛋白酶酶解条件为酶解温度50℃、酶添加量0.8%、酶解pH 7、酶解时间4 h。经两步酶解后得到的E-HPI水解度为(33.01±0.43)%、A280为0.321±0.002。与HPI相比,E-HPI溶解度得到极大的改善,pH 7时E-HPI溶解度为(83.67±2.45)%。
氨基酸分析结果显示,E-HPI支链氨基酸含量为23.37%,显著高于汉麻分离蛋白中支链氨基酸的含量,表明该工艺条件制备的E-HPI富含支链氨基酸,具有作为增肌运动蛋白粉的潜在应用价值。同时抗氧化研究结果显示,E-HPI的·OH清除率和DPPH·清除率相比HPI分别提高了1.15倍和1.58倍,即E-HPI具有一定的清除自由基能力,表明富含支链氨基酸的E-HPI用于增肌的同时,还能清除剧烈运动产生的大量自由基,减少体内脂质过氧化带来的损伤。
