两色金鸡菊黄酮成分对高糖高脂诱导的细胞模型能量代谢紊乱的影响
2020-05-16阿米拉阿不拉提范雪梅毛新民姚蓝
阿米拉•阿不拉提,范雪梅,毛新民,姚蓝
两色金鸡菊黄酮成分对高糖高脂诱导的细胞模型能量代谢紊乱的影响
阿米拉•阿不拉提1,范雪梅2,毛新民1,姚蓝1
1.新疆医科大学中医学院,新疆 乌鲁木齐 830011;2.新疆医科大学药学院,新疆 乌鲁木齐 830011
观察两色金鸡菊黄酮成分对高糖高脂诱导大鼠肾小球系膜细胞HBZY-1能量代谢紊乱的影响,探讨其保护作用机制。采用高糖高脂诱导HBZY-1细胞建立体外糖尿病肾病代谢紊乱细胞模型,将HBZY-1细胞分为正常组、模型组和两色金鸡菊黄酮成分不同剂量组。采用MTS实验检测模型细胞增殖水平,倒置显微镜观察模型细胞形态变化,细胞划痕实验观察模型细胞细胞外基质分泌,Western blot检测细胞能量代谢调控因子5'腺苷-磷酸活化蛋白激酶α(p-AMPKα)、乙酰辅酶a羧化酶1(ACC1)、甾醇调节元件结合蛋白1(SREBP1)及氧化应激因子一氧化氮合酶(eNOS)、尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4)的蛋白表达。两色金鸡菊黄酮成分能抑制高糖高脂诱导的HBZY-1细胞增殖,细胞间隙增大、密度显著降低;两色金鸡菊黄酮成分促进模型细胞p-AMPKα、p-ACC1、eNOS的蛋白表达,抑制模型细胞SREBP1、NOX4、ACC1的蛋白表达;划痕实验结果显示,两色金鸡菊黄酮成分对模型细胞细胞外基质分泌有显著抑制作用,同时α-平滑肌肌动蛋白的蛋白表达显著降低。两色金鸡菊黄酮成分可能通过调控AMPK/SREBP1/ACC1能量代谢通路,抑制模型细胞增殖、氧化应激,进而改善肾脏纤维化病变。
两色金鸡菊;黄酮成分;氧化应激损伤;糖脂代谢;细胞模型
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最严重的微血管并发症,是慢性肾功能衰竭发病的主要原因。据统计,临床约70%糖尿病患者同时并发慢性肾脏疾病[1]。糖尿病发病过程中伴随的能量代谢紊乱可能与DN密切相关[2]。能量代谢紊乱通过激活细胞中多种信号通路诱发肾脏氧化应激反应,使肾脏功能性细胞大量纤维化因子致细胞外基质(ECM)聚集、基底膜增厚,诱发肾脏功能异常与纤维化病变[2-3]。然而能量代谢紊乱与DN确切的作用机制迄今尚不清楚。两色金鸡菊Nutt.为新疆地产药用植物资源,具有活血化瘀、清热解毒功效。化学成分研究发现,两色金鸡菊含有丰富的黄酮类化合物,具有多种生物学活性[4]。课题组前期研究发现,两色金鸡菊黄酮成分和两色金鸡菊提取物具有较好的降糖、降脂和抗氧化应激作用,同时能活化肾脏能量代谢因子5'腺苷-磷酸活化蛋白激酶(p-AMPK)[5-7]。两色金鸡菊黄酮成分是否通过调控能量代谢紊乱发挥保护肾脏作用尚不清楚。本研究拟采用高糖高脂诱导大鼠肾小球系膜细胞HBZY-1建立体外DN能量代谢紊乱模型,观察两色金鸡菊黄酮成分通过调控能量代谢通路改善DN可能的作用机制。
1 实验材料
1.1 药物及细胞株
两色金鸡菊黄酮提取物,新疆医科大学协同创新实验室提供。HBZY-1细胞,购自上海中乔新舟生物科技有限公司,货号ZQ0540;根据说明书要求,将HBZY-1细胞传代于含10%胎牛血清、1%双抗DMEM培养液,置于含5%CO2、37 ℃恒温培养箱中培养。
1.2 主要试剂与仪器
DMEM培养基(HyClone company,批号SH30022.01),p-AMPK α(Affinity Biosciences,AF3423)、一氧化氮合酶(eNOS,Cell Signaling,货号32027)、尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4,Proteintech,货号14247-1-AP)、乙酰辅酶a羧化酶1(ACC1,Proteintech,货号21923-1-AP),磷酸化乙酰辅酶A羧化酶(p-ACC1,Affinity,货号AF3421)、甾醇调节元件结合蛋白1(SREBPl,货号sc-13551)、α-平滑肌肌动蛋白(α-SMA)抗体(Cell Signaling,货号19245S),彩色蛋白Marker(Thermo Scientific Pierce,货号26116、26625),蛋白上样缓冲液(北京太阳生物科技有限公司,货号P1016),Novex AP chromogenic substrate(Invitrogen,货号WP20001),MTS细胞增殖试剂盒(Promega公司,货号G3580)。Steri-Cult型CO2培养箱(美国Thermo公司),GelDocXR+凝胶+分析系统、156-8001型垂直电泳槽(美国Bio-Rad公司),ZESSAxioObserverZ1倒置显微镜(德国ZEISS公司),5427R型高速冷冻离心机(德国Eppendorf公司),Multiskan GO酶标仪(美国Thermo Fisher公司)。
2 实验方法
2.1 两色金鸡菊黄酮成分溶液制备
精密称取两色金鸡菊黄酮提取物冻干粉20 mg,置于1.5 mL EP管,加入二甲基亚砜(DMSO)0.4 mL,反复震荡使粉末充分溶解,得浓度为50 mg/mL两色金鸡菊黄酮提取物溶液,根据预实验结果设置给药浓度,加入不同体积DMSO稀释成相应的细胞给药浓度。
2.2 高糖高脂溶液配制
分别称取D-葡萄糖(HG)和棕榈酸(PA)适量,将HG充分溶解于DMEM培养基中,定容于10 mL容量瓶,PA用DMSO震荡充分溶解,制成HG、PA浓度分别为1 moL/L和0.25 mol/L贮备液,经0.22 μm微孔滤膜过滤备用。本实验采用HG 100 mmol/L、PA 250 μmol/L干预细胞建立DN模型。
2.3 细胞分组及干预
MTS实验分组:用DMEM完全培养基培养HBZY-1细胞,将培养瓶中覆盖率达80%~90%细胞离心收集,对细胞混悬液进行计数。接种于96孔板,每个浓度设4个复孔,4×103个/孔。5 h后待细胞贴壁生长,弃上清液并用含或不含药物的无血清DMEM培养基干预。将细胞分为10组:正常组(NC组,有细胞但不干预),高糖高脂组(HG+PA组),两色金鸡菊黄酮不同剂量(1、5、10、20、40、80、160、320 µg/mL)组(HG+PA+FC组)。
Western blot和细胞划痕实验分组:取3×105个/孔细胞混悬液,按每孔2 mL接种于6孔板中培养,5 h待细胞贴壁生长后,PBS清洗细胞2次,将细胞设置为NC组、HG+PA组、HG+PA+FC 25 µg/mL组、HG+PA+FC 50 µg/mL组、HG+PA+FC 100 µg/mL组、HG+PA+FC 150 µg/mL组,每个浓度设3复孔,干预给药24 h后,弃上清液,用于各项指标检测。
2.4 MTS实验
按照“2.3”项下实验分组处理细胞,给药干预细胞,继续培养24、48、72 h后,弃上清液,加入MTS溶液20 μL/孔,37 ℃恒温培养箱避光孵育2 h,于酶标仪波长490 nm处测定吸光度(OD值),实验重复3次,计算细胞增殖率。细胞增殖率(%)=实验组OD值÷对照组OD值×100%。倒置显微镜观察细胞形态。
2.5 细胞划痕实验
在6孔板背后用灭菌直尺均匀画出平行3条横线。每孔加入约5×105个细胞,待细胞铺满6孔板后,用10 μL枪头垂直于背后的横线划痕,用PBS清洗2次,将脱落细胞碎片洗净,按照“2.3”项下实验分组干预。分别在干预0、12、24 h时间点同一位置拍照比较各组划痕宽度,从而反映细胞平面迁移能力。
2.6 Western blot实验
按照“2.3”项下实验分组对干预后的细胞提取总蛋白,加细胞裂解液(RIPA∶PMSF=1∶1),置于冰上裂解,离心分离上清液,采用BCA法对蛋白浓度定量,蛋白变性后分装于EP管中,保存备用;蛋白上样每孔30 μg总蛋白,电泳(80 V分离胶,100 V浓缩胶)至溴酚蓝完全跑出,采用湿转法恒压100 V冰浴转膜,将蛋白移至PVDF膜上;5%脱脂奶粉封闭膜2 h;4 ℃摇床孵育一抗过夜,避光常温孵育二抗(1∶2000)2 h,显色剂显色后,凝胶成像仪拍照,测灰度值,实验独立重复3次。Image Lab软件进行条带灰度值分析。以GAPDH、β-actin为内参,计算蛋白相对表达量。
3 统计学方法
4 结果
4.1 两色金鸡菊黄酮成分对高糖高脂诱导的HBZY-1细胞增殖的影响
高糖高脂干预细胞模型4、48、72 h,细胞增殖率分别为130.21%、129.6%、120.94%,且明显高于NC组,差异有统计学意义(<0.01)。随两色金鸡菊黄酮成分浓度增加及作用时间延长,抑制细胞增殖24 h时达高峰。其中在24、48 h两色金鸡菊黄酮成分(20、40、80 μg/mL)细胞增殖率明显降低,差异有统计学意义(<0.01)。当两色金鸡菊黄酮成分浓度达160 μg/mL时,细胞增殖抑制作用均减弱,其原因可能是随两色金鸡菊黄酮成分浓度增加及作用时间延长,其药物本身颜色加深,OD值也随之升高。结果见图1。
4.2 两色金鸡菊黄酮成分对高糖高脂诱导的HBZY-1细胞形态的影响
不同浓度两色金鸡菊黄酮成分干预HBZY-1细胞24 h后,与NC组比较,高糖高脂环境可促进HBZY-1细胞增殖,并可见部分HBZY-1细胞形态明显改变,细胞出现肥大、聚集和呈现长梭形的现象,而随两色金鸡菊黄酮成分浓度升高,细胞增殖受到抑制,相邻细胞间隙增大。结果见图2。
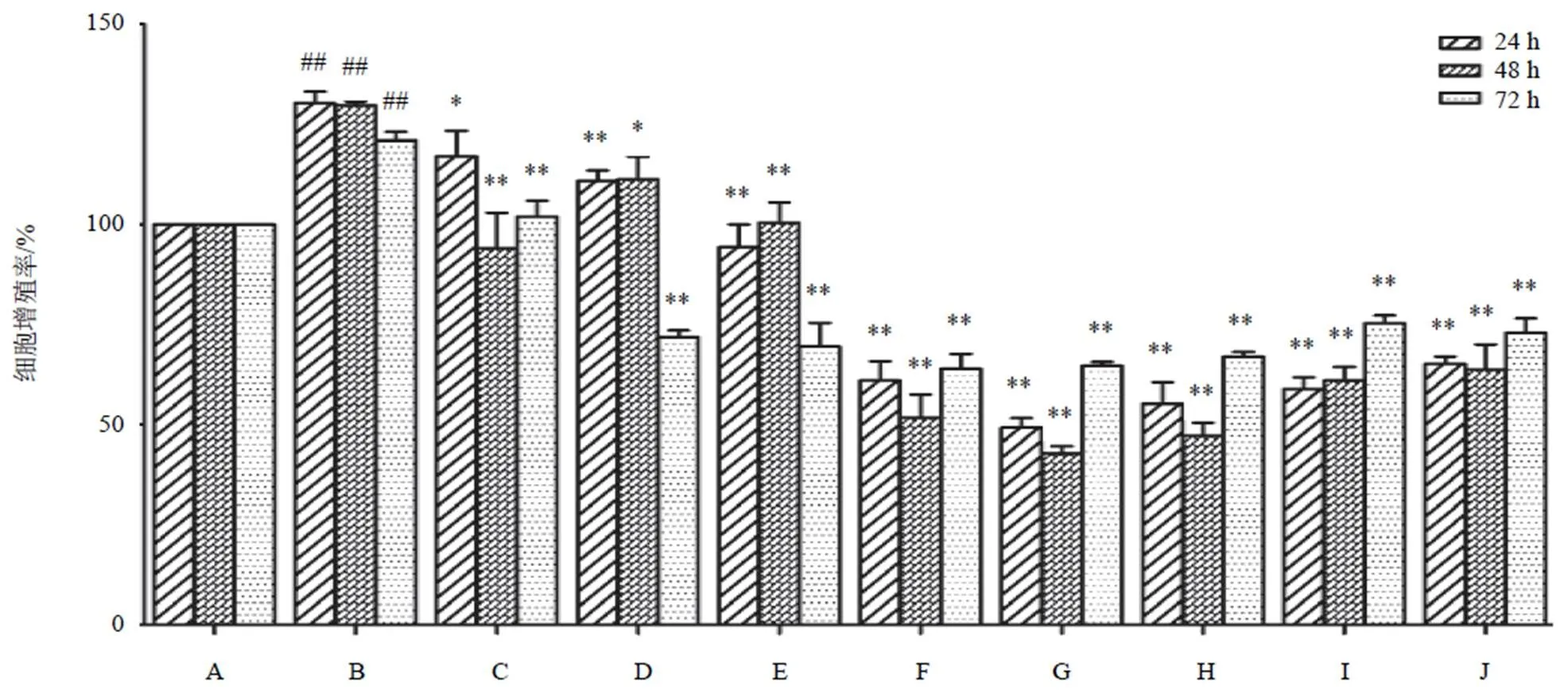
注:A. NC组;B. HG+PA组;C~J. HG+PA+FC(1、5、10、20、40、80、160、320 µg/mL)组;与A比较,##P<0.01;与B比较,*P<0.05,**P<0.01
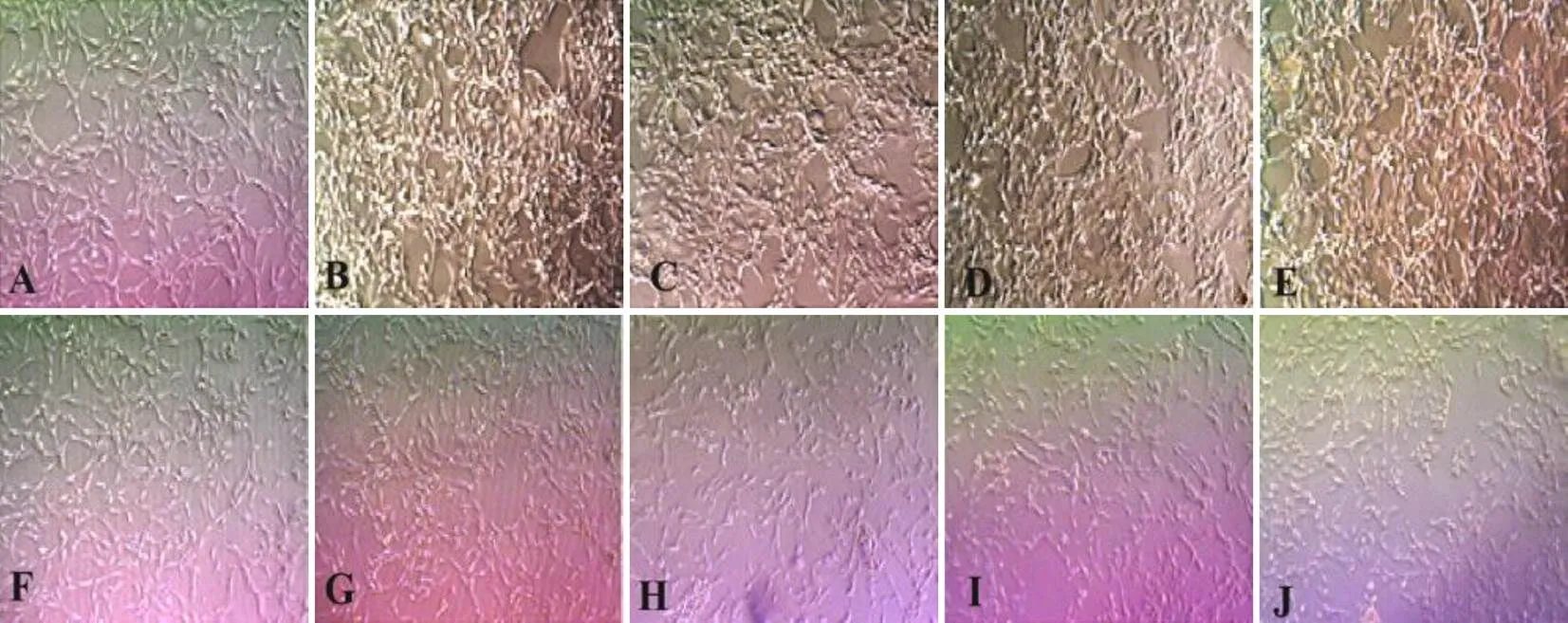
注:A. NC组;B. HG+PA组;C~J. HG+PA+FC(1、5、10、20、40、80、160、320 µg/mL)组
4.3 两色金鸡菊黄酮成分对高糖高脂诱导的HBZY-1细胞能量代谢因子调控的影响
4.3.1 5'腺苷-磷酸活化蛋白激酶α蛋白表达
p-AMPKα在高糖高脂干预细胞后,与NC组比较显著降低其表达,差异有统计学意义(<0.01),两色金鸡菊黄酮成分干预后各剂量组均不同程度上调p-AMPKα的表达,但两色金鸡菊黄酮成分25、50、100 µg/mL组与HG+PA组比较差异无统计学意义,仅两色金鸡菊黄酮成分150 µg/mL干预细胞后,显著上调p-AMPKα表达,差异有统计学意义(<0.05)。结果见图3。
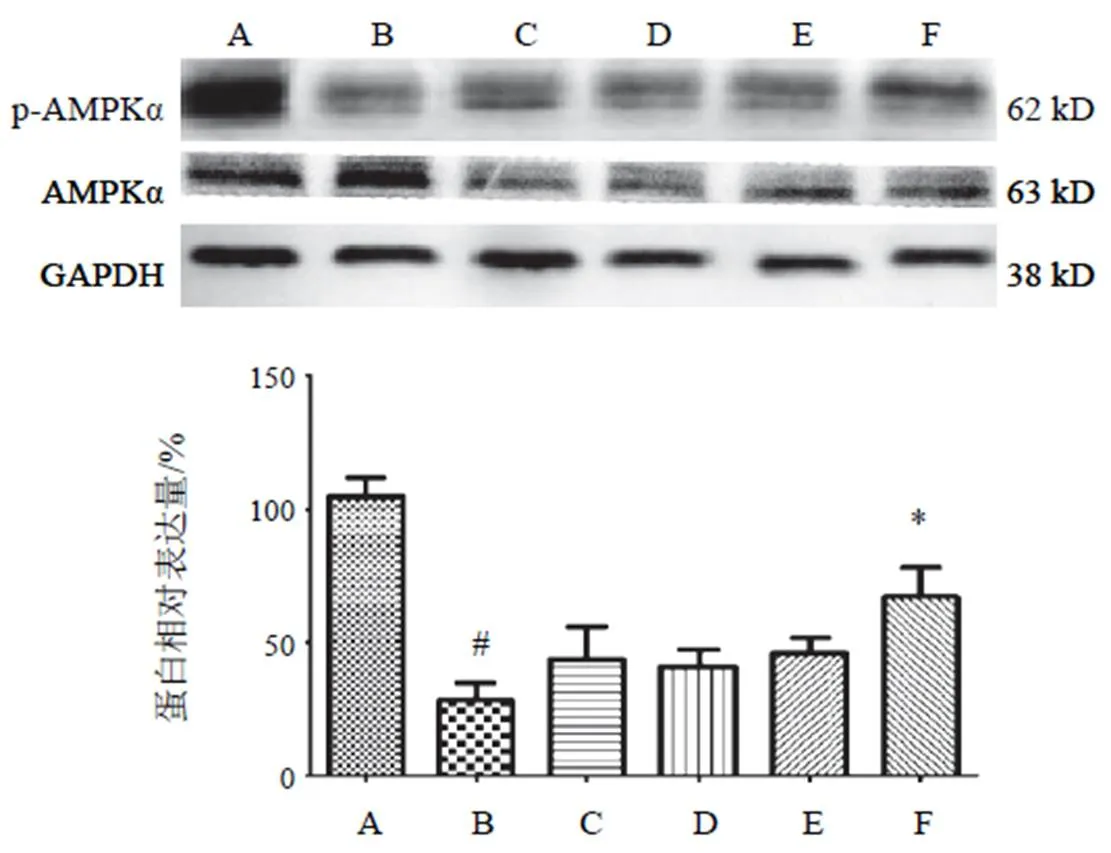
注:A. NC组;B. HG+PA组;C~F. HG+PA+FC(25、50 100、150 µg/mL)组;与A比较,#P<0.05;与B比较,*P<0.05
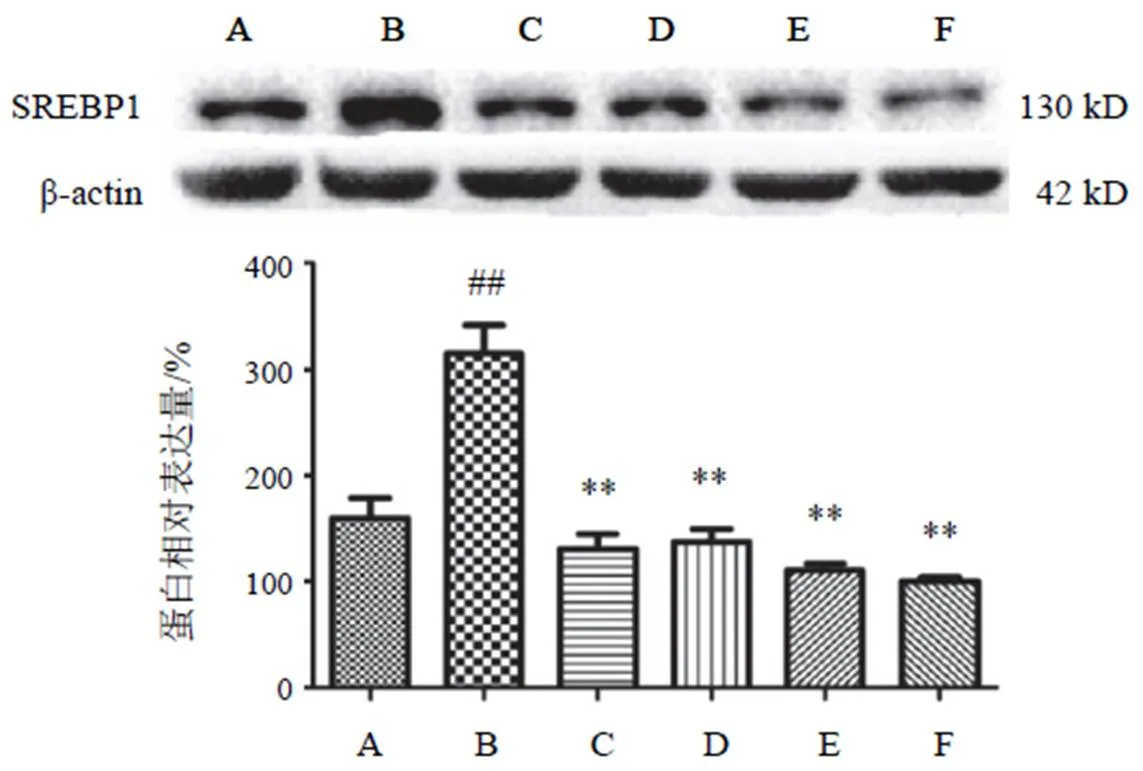
4.3.2 甾醇调节元件结合蛋白1蛋白表达
高糖高脂诱导细胞后,与NC组比较,SREBP1表达上调,差异有统计学意义(<0.01);两色金鸡菊黄酮成分干预后各剂量组均能明显抑制细胞SREBP1表达,差异有统计学意义(<0.01)。结果见图4。
4.3.3 磷酸化乙酰辅酶a羧化酶1蛋白表达
高糖高脂诱导细胞后,与NC组比较,p-ACC1表达降低,但差异无统计学意义。两色金鸡菊黄酮成分干预后各剂量组均不同程度上调p-ACC1的表达,与HG+PA组比较,差异有统计学意义(<0.05),在两色金鸡菊黄酮成分 50 µg/mL时显著上调p-ACC1的表达,差异有统计学意义(<0.01)。结果见图5。
注:A. NC组;B. HG+PA组;C~F. HG+PA+FC(25、50 100、150 µg/mL)组;与A比较,##P<0.01;与B比较,**P<0.01
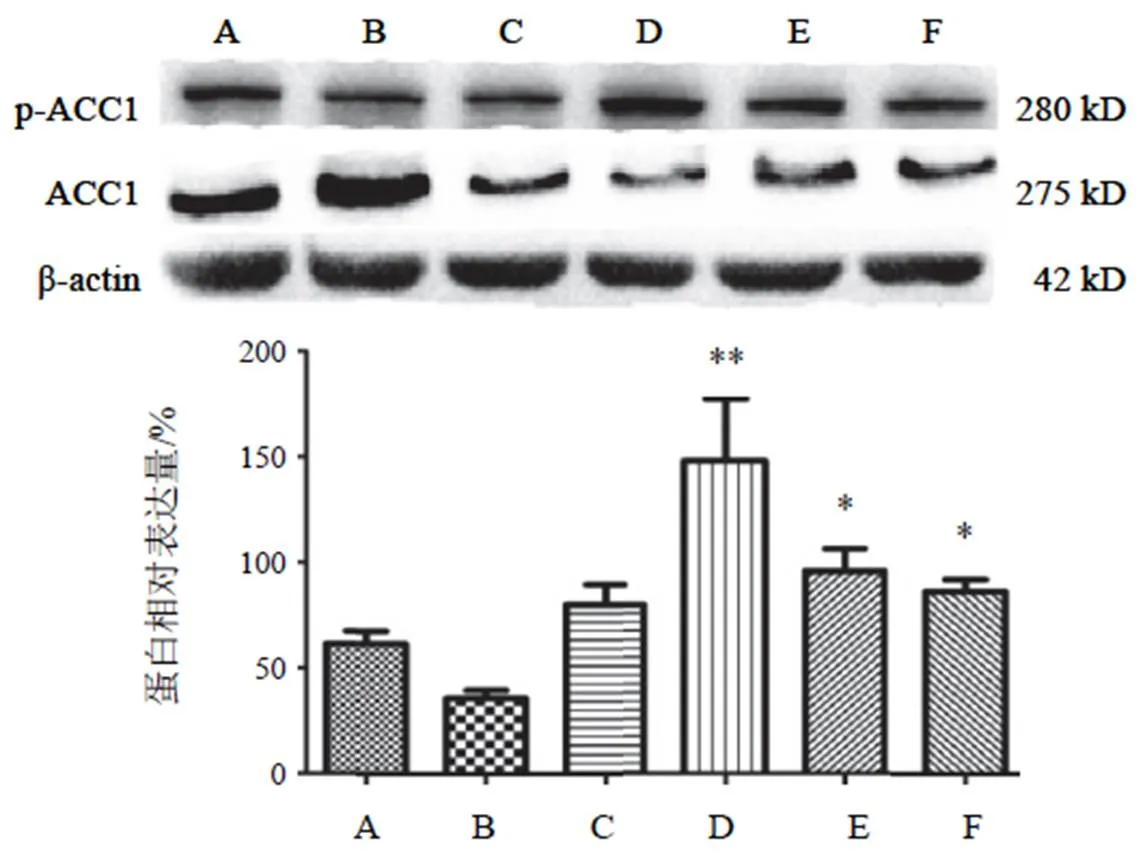
注:A. NC组;B. HG+PA组;C~F. HG+PA+FC(25、50 100、150 µg/mL)组;与B比较,*P<0.05,**P<0.01
4.4 两色金鸡菊黄酮成分对高糖高脂诱导的HBZY-1细胞氧化应激因子表达的影响
4.4.1 一氧化氮合酶蛋白表达
高糖高脂诱导下,细胞中氧化应激保护因子eNOS表达与NC组比较显著降低(<0.05);两色金鸡菊黄酮成分干预细胞后,eNOS表达明显降低,与HG+PA组比较,两色金鸡菊黄酮成分25、50、100 µg/mL时均能显著上调细胞eNOS的表达(<0.01),而两色金鸡菊黄酮成分 150 µg/mL对eNOS的上调作用差异无统计学意义。见图6。

注:A. NC组;B. HG+PA组;C~F. HG+PA+FC(25、50 100、150 µg/mL)组;与B比较,**P<0.01
4.4.2 尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4蛋白表达
高糖高脂诱导细胞后,NOX4表达升高,差异无统计学意义。两色金鸡菊黄酮成分干预细胞后,两色金鸡菊黄酮成分各剂量组均能抑制细胞NOX4表达,与HG+PA组比较,两色金鸡菊黄酮成分25 µg/mL时无明显差异;两色金鸡菊黄酮成分100、150 µg/mL时明显抑制细胞NOX4的表达(<0.01)。结果见图7。
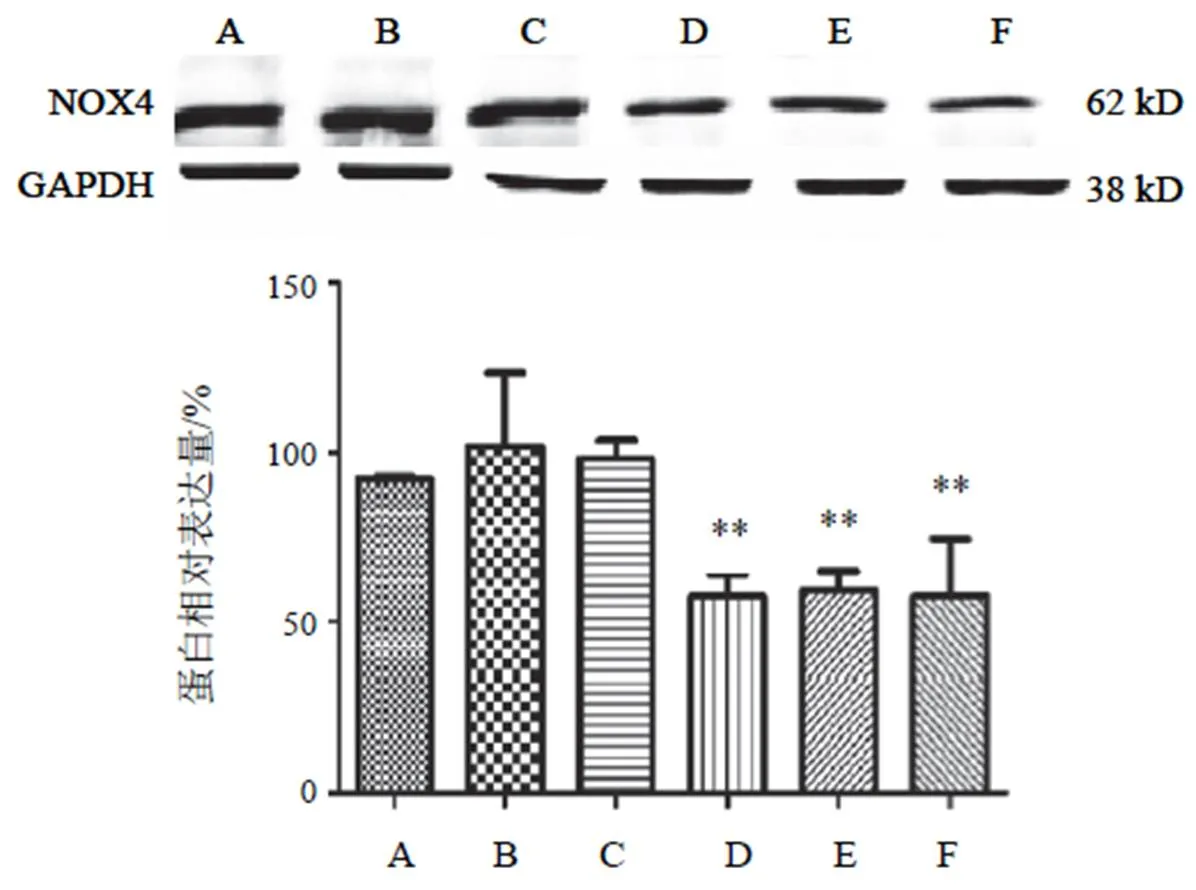
注:A. NC组;B. HG+PA组;C~F. HG+PA+FC(25、50 100、150 µg/mL)组;与B比较,**P<0.01
4.5 两色金鸡菊黄酮成分对高糖高脂诱导HBZY-1细胞纤维化的影响
4.5.1 细胞黏附能力
不同浓度两色金鸡菊黄酮成分处理后,动态观察0、12、24 h两色金鸡菊黄酮成分各剂量组细胞间隙大小及划痕间距变化;随着时间推移,NC组细胞间隙与划痕间距变化不明显,HG+PA组细胞间隙与划痕间距随培养时间的增加而显著变小,细胞密度明显增加,不同浓度两色金鸡菊黄酮成分干预细胞后,随培养时间的延长,细胞间隙与划痕间距逐渐变大,细胞密度明显降低。见图8。

注:A. NC组;B. HG+PA组;C~F. HG+PA+FC(25、50 100、150 µg/mL)组
4.5.2 α-平滑肌肌动蛋白表达
NC组细胞α-SMA表达与HG+PA组比较无明显差异,两色金鸡菊黄酮成分干预细胞后,α-SMA表达均不同程度上有所降低,其中两色金鸡菊黄酮成分25、50 µg/mL时较HG+PA组α-SMA表达降低,但差异无统计学意义;两色金鸡菊黄酮成分100、150 µg/mL时能显著抑制高糖高脂诱导HBZY-1细胞α-SMA的表达,差异有统计学意义(<0.01),其中两色金鸡菊黄酮成分150 µg/mL作用最显著。见图9。
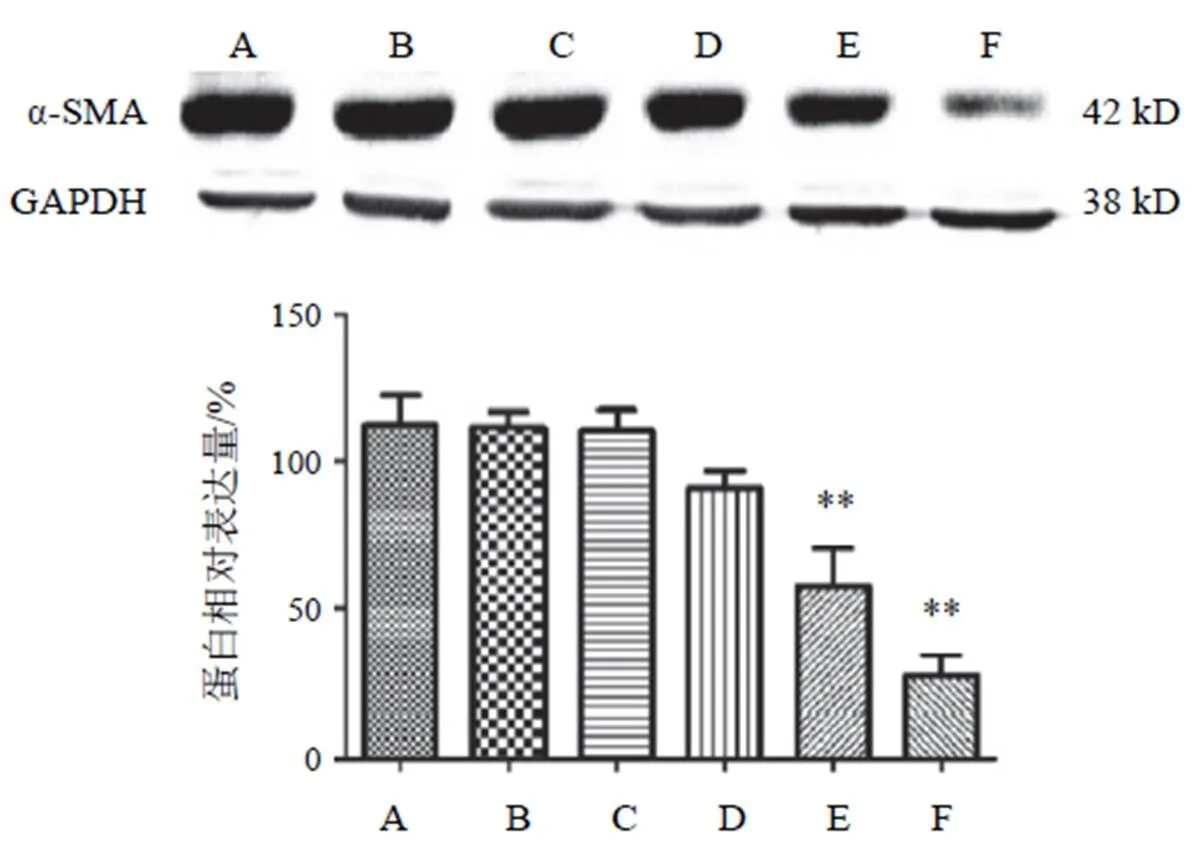
注:A. NC组;B. HG+PA组;C~F. HG+PA+FC(25、50 100、150 µg/mL)组;与B比较,**P<0.01
5 讨论
DN并非由单一因素引发,而是由多因素、多途径导致的疾病。临床发现,降血糖剂、肾素醛固酮系统拮抗剂的应用并未能很好地防治DN发生。除遗传因素外,机体长期代谢紊乱是造成DN的累积诱发因素,而糖代谢与脂代谢异常则起决定性作用。本实验采用葡萄糖与棕榈酸干预HBZY-1细胞建立DN糖脂代谢异常的细胞模型,探讨两色金鸡菊黄酮成分通过对模型细胞能量代谢的调控改善DN作用机制。
AMPK在肾脏中高表达,在细胞缺乏能量状态下被活化,是糖尿病患者糖脂质代谢调控的关键因子[8]。SREBP1、ACC1均为调节脂肪酸表达、参与脂肪酸合成的关键调控因子[9]。AMPK不仅通过调节AMP/ATP 比值调控机体血糖稳态,同时磷酸化的AMPK通过抑制下游SREBP1、ACC1的表达,下调三酰甘油、脂肪酸等脂质的生成和积累[10]。可见AMPK与DN肾脏糖脂代谢调控密切相关,本研究发现,两色金鸡菊黄酮成分能显著活化模型细胞中AMPK,抑制SREBP1、p-ACC1的表达,对DN肾脏能量代谢紊乱有改善作用。
NOXs是细胞中一类具有氧化活性的蛋白。在机体代谢紊乱情况下,eNOS解偶联,可使NOX表达增多,产生大量活性氧(ROS),诱导细胞或组织氧化应激损伤。肾脏是氧化应激反应最为敏感的器官之一[11]。NOX4广泛分布在肾脏血管、系膜细胞、肾小管、足细胞中。临床研究发现,NOX4在DN患者体内被持续激活,诱导产生大量ROS产物,与肾脏生理功能异常和病理结构的改变密切相关[12]。两色金鸡菊黄酮成分干预模型细胞后,可显著下调细胞NOX4的表达,说明两色金鸡菊黄酮成分具有抑制HBZY-1细胞氧化应激反应的作用。但也发现,HG+PA组细胞与NC组比较NOX4表达有所升高,差异无统计学意义,推测可能由于不同种属细胞对高糖高脂刺激反应有所差异,大鼠肾小球系膜细胞NOX4表达对高糖高脂刺激反应敏感性较低。与此同时,模型细胞eNOS表达显著下调,说明细胞已受到毒性损伤,两色金鸡菊黄酮成分干预能显著升高eNOS水平。结合上述结果,我们推测两色金鸡菊黄酮成分可能通过调控能量代谢稳态,逆转细胞中氧化应激导致的细胞毒性和功能损伤。然而HBZY-1细胞氧化应激损伤与ECM聚集、纤维化因子释放密切相关。肾脏不同功能细胞在氧化应激状态下,分泌肾组织纤维化因子α-SMA,转化为肌组织成纤维细胞,导致肾脏细胞ECM聚集、基底膜增厚、不同程度的纤维化。我们通过划痕实验进一步发现两色金鸡菊黄酮成分能显著抑制细胞中ECM分泌,同时下调α-SMA的表达。因此,两色金鸡菊黄酮成分可能通过调控能量代谢AMPK/SREBP1/ACC1通路,抑制细胞中氧化应激所导致的ECM分泌与α-SMA表达异常,对肾脏纤维化病变发挥保护作用。但能量代谢紊乱发生机制较复杂,两色金鸡菊黄酮成分调控能量代谢对肾脏的作用机制也较复杂,仍有待进一步研究。
[1] HU C, SUN L, XIAO L, et al. Insights into the mechanisms involved in the expression and regulation of extracellular matrix proteins in diabetic nephropathy[J]. Current Medicinal Chemistry,2015, 22(24):1-21.
[2] SU W, CAO R, HE Y C, et al. Crosstalk of hyperglycemia and dyslipidemia in diabetic kidney disease[J]. Kidney Dis (Basel), 2017,3(4):171-180.
[3] BREYER M D, NOVEL K M. Avenues for drug discovery in diabetic kidney disease[J]. Expert Opin Drug Discov,2018,13(1):65-74.
[4] 毛新民,卢伟,李琳琳,等.两色金鸡菊化学成分和药理作用研究进展[J].药物应用与监测,2014,11(4):235-240.
[5] 姚蓝,蒋洁,王靖宣,等.两色金鸡菊对糖尿病大鼠肾脏纤维化RhoA/ ROCK/NOX4信号通路的影响[J].中国中医药信息杂志,2019,26(1):57-62.
[6] YAO L, MAO X M, LI L L, et al. The anti-inflammatory and antifibrotic effects ofNutt. on high-glucose-fat diet and streptozotocin-induced diabetic renal damage in rats[J]. BMC Complementary and Alternative Medicine, 2015,15:314-326.
[7] 颜仁梁.两色金鸡菊黄酮类化学成分研究[J].中草药,2018,49(21):5046-5050.
[8] RAJANI R, PASTOR-SOLER N M, HALLOWS K R. Role of AMP-activated protein kinase in kidney tubular transport, metabolism, and disease[J]. Current Opinion in Nephrology and Hypertension, 2017,26(5):1-9.
[9] VAN KRIEKEN R, MARWAY M, PARTHASARATHY P, et al. Inhibition of SREBP with fatostatin does not attenuate early diabetic nephropathy in male mice[J]. Endocrinology,2018,159(3):1479-1495.
[10] LI Y, XU S Q, MIHAYLOVA M M, et al. AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice[J]. Cell Metabolism,2011,13(4):376-388.
[11] SEDEEK M, MONTEZANO A C, HEBERT R L, et al. Oxidative stress, NOX isoforms and complications of diabetes-potential targets for novel therapies[J]. J Cardiovasc Transl Res,2012,5(4):509-518.
[12] BABELOVA A, AVANIADI D, JUNG O, et al. Role of NOX4 is murine models of kidney disease[J]. Free Radic Biol Med,2012,53(4):842-853.
Effects of Flavonoids ofNutt. on Energy Metabolism Disorder of High Glucose and High Fat-induced Cell Model
AMILA Abulati1, FAN Xuemei2, MAO Xinmin1, YAO Lan1
To observe the effects of flavonoids ofNutt. on energy metabolism disorder of high glucose and high fat-induced cell model; To explore its protective mechanism.Rat diabetic nephropathy metabolic disorder cell model was established by high glucose and high fat-induced HBZY-1 cell. HBZY-1 cells were divided into normal group, model group and flavonoids ofNutt. different dosage groups. MTS assay was used to detect the cell proliferation level of the model cells, and the morphology of the cells was observed under an inverted microscope. Cell scratch assay was used to observe the secretion of extracellular matrix in model cells. Western blot was used to detect the protein expressions of cellular energy metabolism regulator factor p-AMPKα, ACC1, SREBP1 and oxidative stress factor eNOS, and NOX4.Flavonoids ofNutt. could inhibit cell proliferation of high glucose and high fat-induced HBZY-1 cells. Bigger cell space and lower cell density were detected after Flavonoids of Coreopsis Tinctoria Nutt treatment; FC could increase the expressions of p-AMPKα, p-ACC1, and eNOS and inhibit the expressions of SREBP1, NOX4, ACC1, and α-SMA; Cell scratch assay results showed that flavonoids ofNutt. significantly inhibited ECM excretion, and α-SMA protein expression decreased.Flavonoids ofNutt. can inhibit cell proliferation and oxidative stress via regulating AMPK/SREBP1/ACC1 signaling pathway then improve the renal fibrosis.
flavonoids ofNutt.; flavonoids; oxidative stress damage; glycolipid; cell model

R285.5
A
1005-5304(2020)05-0035-07
10.3969/j.issn.1005-5304.201908139
国家自然科学基金(81560671)
姚蓝,E-mail:56174475@qq.com
(2019-08-09)
(2019-09-15;编辑:华强)
