黄芪和天花粉对小鼠恶性黑色素瘤B16细胞增殖和迁移及E-cadherin、N-cadherin蛋白表达的影响
2020-05-16张秋艳黄松丽张琳婧梁羽茜赵丕文魏胜利胡秀华
张秋艳,黄松丽,张琳婧,梁羽茜,赵丕文,魏胜利,胡秀华
论著·实验研究
黄芪和天花粉对小鼠恶性黑色素瘤B16细胞增殖和迁移及E-cadherin、N-cadherin蛋白表达的影响
张秋艳,黄松丽,张琳婧,梁羽茜,赵丕文,魏胜利,胡秀华
北京中医药大学,北京 100029
观察黄芪、天花粉及其配伍对小鼠恶性黑色素瘤B16细胞增殖和迁移的影响,探讨其作用机制。MTT法检测B16细胞增殖,根据结果计算细胞生长抑制率为0%时对应的各药物浓度(IC0)、为25%时对应的各药物浓度(IC25)、为50%时对应的各药物浓度(IC50)。设空白组、配伍组(黄芪注射液IC0+天花粉水煎剂IC0、黄芪注射液IC0+天花粉水煎剂IC25、黄芪注射液IC0+天花粉水煎剂IC50、黄芪注射液IC25+天花粉水煎剂IC0、黄芪注射液IC25+天花粉水煎剂IC25)。细胞划痕实验检测B16细胞迁移,Western blot检测B16细胞迁移相关蛋白E-cadherin、N-cadherin表达。MTT检测结果表明,不同剂量黄芪和天花粉均可抑制B16细胞增殖,具有浓度依赖性;细胞划痕实验结果显示,黄芪和天花粉均影响B16细胞划痕愈合,抑制细胞迁移,具有浓度依赖性;两药不同比例配伍的细胞增殖抑制率明显高于单味中药,差异有统计学意义(<0.05);Western blot检测结果显示,黄芪和天花粉均增加E-cadherin蛋白的表达,降低N-cadherin蛋白的表达。黄芪、天花粉及其配伍均可抑制小鼠恶性黑色素瘤B16细胞增殖及迁移,且两药配伍效果优于单味中药,黄芪和天花粉抑制细胞迁移的机制与E-cadherin和N-cadherin蛋白的表达相关。
黄芪;天花粉;B16细胞;细胞增殖;细胞迁移;配伍
恶性黑色素瘤起源于黑色素细胞的异常增生,是一种发病率高、恶性程度高、发展速度快、死亡率高的恶性肿瘤,浸润和迁移能力强,早期即可向其他部位发生转移,手术后极易复发。因此,如何有效防治黑色素瘤侵袭和转移,促进其细胞凋亡,是目前临床治疗恶性黑色素瘤关注的重点。黄芪和天花粉首载于《神农本草经》,黄芪有补气升阳、托毒生肌等功效,其主要成分黄芪多糖能减轻中波紫外线照射对皮肤角质形成细胞的损伤[1]。天花粉有清热泻火、生津止渴、消肿排脓功效,应用于多种外科疾病的治疗。临床及实验研究显示,黄芪和天花粉均有抗炎、抗病毒、抗肿瘤活性,用于多种癌症的治疗[2-8]。此外,中医古籍也有黄芪和天花粉联合应用的案例记载,其中对皮肤痈和癌症的应用为中医治疗恶性黑色素瘤提供良好的治疗经验[9]。张锡纯《医学衷中参西录》的消渴名方玉液汤以黄芪为君药益气固肾,天花粉为臣药滋阴生津;陈实功《外科正宗》载内托千金散治疗脑疽发背诸毒恶疮已成不消者,方中黄芪扶正、天花粉解毒。本研究采用MTT法、细胞划痕实验检测黄芪、天花粉及其配伍对小鼠恶性黑色素瘤B16细胞增殖和迁移的影响,采用Western blot检测黄芪和天花粉及其配伍对细胞迁移相关蛋白E-cadherin、N-cadherin表达的影响,探讨其作用机制,为临床治疗恶性黑色素瘤提供依据。
1 实验材料
1.1 细胞株
小鼠恶性黑色素瘤B16细胞,购自中国协和医科大学细胞中心。
1.2 药物及制备
天花粉购自北京同仁堂药业有限公司,批号20180208;黄芪注射液购自黑龙江珍宝岛药业股份,批号20180604。称取天花粉100 g,常规中药煎煮法煎煮,待药液煎至约100 mL时将煎液倒入150 mL烧杯,去离子水浸泡,浓缩至50 mL;移至超净工作台,将浓缩药液移至离心管,1000 r/min离心20 min,取上清液,4 ℃密闭保存。取1 mL上清液与2 mL培养基混合注入培养瓶中,置于37 ℃、5%CO2培养箱内静置培养,进行检菌。24 h后观察培养基,确定药液无菌后,将药液4 ℃密闭保存,浓度为2 g/mL。黄芪注射液浓度为2 g/mL,用0.22 µm除菌过滤器过滤,4 ℃密闭保存。
1.3 主要试剂与仪器
胎牛血清,浙江天杭生物科技有限公司,货号11011-8611;DMEM高糖培养基,德国Hyclone公司,货号SH300243.01b;0.25%胰蛋白酶,德国Hyclone公司,货号sh30042.01b;PBS,Gibco,货号20012027;MTT,美国Sigma公司,货号M8180;DMSO,Sigma公司,货号d2650;96孔细胞培养板,美国Corning公司,货号3599;6孔细胞培养板,美国Corning公司,货号3516;细胞培养瓶,美国Corning公司,货号430639;RIPA裂解液,北京普利莱基因技术有限公司,货号c1053;30%丙烯酰胺,北京普利莱基因技术有限公司,货号b1000-500;5×Loading Buffer,北京索莱宝生物科技有限公司,货号P1040;吐温-20,北京索莱宝生物科技有限公司,货号T8220;BCA蛋白定量试剂盒,北京康为世纪生物科技有限公司,货号CW10045;TEMED,美国Sigma公司,货号110-18-9;Tris,美国BioRuler公司,货号77-86-1;SDS,美国BioRuler公司,货号151-21-3;甘氨酸,美国BioRuler公司,货号56-40-6;无水甲醇,国药集团;脱脂奶粉,美国BioRuler公司,货号151-21-3;蛋白彩色预染marker,Thermo Scientific公司,货号26616;0.45 μm PVDF膜,美国密理博/默克;N-cadherin,PROTEINTECH GROUP,货号66219-I-Ig;E-cadherin,PROTEINTECH GROUP,货号20874-I-AP;抗鼠IgG,PROTEINTECH GROUP,货号SA00001-1;抗兔IgG,PROTEINTECH GROUP,货号SA00001-2;ECL超敏发光液,北京普利莱基因技术有限公司,货号P1020-100。倒置显微镜,日本Olympus公司,micropublisher 5.0 RTV;CO2培养箱,日本松下公司;酶标仪,奥地利/Molecular Devices,SpectraMax i3x;凝胶成像仪,美国BIO-RAD公司,ChemiDoc MP。
2 实验方法
2.1 MTT法检测B16细胞增殖
取对数生长期B16细胞,以3×104个/mL浓度接种于96孔细胞培养板中,置于37 ℃、5%CO2培养箱内培养24 h后换液。实验设置空白组(只加含胎牛血清培养基)、黄芪注射液组(终浓度分别为50、100、200、300、400 mg/mL)、天花粉水煎剂组(浓度分别为160、320、640、1280、2560 µg/mL),每组设5个平行孔。继续培养48 h后,吸出每孔中药液,PBS清洗1次,随后避光条件下,每孔加入浓度为5 mg/ mL的MTT溶液10 µL和90 µL无血清培养基并混合均匀,锡纸包裹静置,培养箱中继续培养4 h后弃上清,然后每孔加入150 µL DMSO,摇床震荡10 min,于酶标仪波长490 nm处测定吸光度(OD值),计算细胞抑制率。细胞抑制率(%)=(1-实验组OD值÷空白组OD值)×100%。
实验重复3次,分别对黄芪注射液、天花粉水煎剂浓度与B16细胞的抑制率进行线性拟合,进行统计学分析,根据结果计算出细胞生长抑制率为0%时对应的各药物浓度(IC0)、细胞生长抑制率为25%时对应的各药物浓度(IC25)及细胞生长抑制率为50%时对应的各药物浓度(IC50)。
2.2 MTT法检测不同比例黄芪和天花粉配伍干预B16细胞增殖
取对数生长期B16细胞,以3×104个/mL浓度接种于96孔细胞培养板中,置于37 ℃、5%CO2培养箱内培养24 h后换液。实验设置空白组(只加含胎牛血清培养基)、黄芪天花粉配伍组(黄芪注射液IC0+天花粉水煎剂IC0、黄芪注射液IC0+天花粉水煎剂IC25、黄芪注射液IC0+天花粉水煎剂IC50、黄芪注射液IC25+天花粉水煎剂IC0、黄芪注射液IC25+天花粉水煎剂IC25),每组设5个平行孔。细胞培养、吸光度测定和细胞抑制率计算同“2.1”项下方法。
2.3 细胞划痕实验检测黄芪和天花粉干预B16细胞迁移
将对数生长期B16细胞接种于96孔板,细胞浓度为3×104个/mL,培养24 h后,用无菌10 µL枪头在每个孔底部划出“一”字划痕,PBS清洗2遍,拍照记录。实验设置空白组(只加含胎牛血清培养基)、黄芪注射液组(终浓度为50、100、300 mg/mL)、天花粉水煎剂组(终浓度为160、640、2560 µg/mL),每组设5个平行孔。继续培养48、72 h后镜下观察划痕愈合度,拍照记录,并分析细胞迁移情况。
2.4 细胞划痕实验检测不同比例黄芪和天花粉配伍干预B16细胞迁移
将对数生长期B16细胞接种于96孔板,细胞浓度为3×104个/mL,培养24 h后,用无菌10 µL枪头在每个孔底部划出“一”字划痕,PBS清洗2次,拍照记录。实验设置空白组(只加含胎牛血清培养基)、黄芪注射液组(黄芪注射液IC0、IC25)、天花粉水煎剂组(天花粉水煎剂IC0、IC25、IC50)、黄芪天花粉配伍组(黄芪注射液IC0+天花粉水煎剂IC0、黄芪注射液IC0+天花粉水煎剂IC25、黄芪注射液IC0+天花粉水煎剂IC50、黄芪注射液IC25+天花粉水煎剂IC0、黄芪注射液IC25+天花粉水煎剂IC25),每组设5个平行孔。继续培养72 h后镜下观察划痕愈合度,拍照记录,并分析细胞迁移情况。
2.5 Western blot检测黄芪和天花粉干预B16细胞迁移相关蛋白表达
将对数期生长细胞以5×103个/mL密度接种于6孔板,培养24 h,实验设空白组(加含胎牛血清培养基)、黄芪注射液组(黄芪注射液19、158、295 mg/mL)、天花粉水煎剂组(天花粉水煎剂81、762、1595 µg/mL)。48 h后提取蛋白,用BCA试剂盒测定蛋白浓度。SDS-PAGE凝胶电泳分离蛋白组分后,将蛋白转印于PVDF膜上,经5%脱脂奶粉封闭1 h后,分别加入不同一抗4 ℃孵育过夜,再加入HRP标记的二抗室温孵育1 h,最后用凝胶成像系统扫描成片。用Image J软件分析目的条带,每组重复3次。
2.6 Western blot检测黄芪和天花粉配伍干预B16细胞迁移相关蛋白表达
将对数期生长细胞以5×103个/mL密度接种于6孔板中,培养24 h后,实验设空白组(只加含胎牛血清培养基)、黄芪天花粉配伍组(黄芪注射液IC0+天花粉水煎剂IC0、黄芪注射液IC0+天花粉水煎剂IC25、黄芪注射液IC0+天花粉水煎剂IC50、黄芪注射液IC25+天花粉水煎剂IC0、黄芪注射液IC25+天花粉水煎剂IC25、黄芪注射液IC25+天花粉水煎剂IC50)。48 h后提取蛋白,用BCA试剂盒测定蛋白浓度。SDS-PAGE凝胶电泳分离蛋白组分后,将蛋白转印于PVDF膜上,经5%脱脂奶粉封闭1 h后,分别加入不同一抗,4 ℃孵育过夜,再加入HRP标记的二抗室温孵育1 h,最后用凝胶成像系统扫描成片。用Image J软件分析目的条带,每组重复3次。
3 统计学方法
4 结果
4.1 不同浓度黄芪和天花粉对小鼠恶性黑色素瘤B16细胞增殖的影响
药物处理48 h后,MTT检测结果显示,不同浓度黄芪注射液、天花粉水煎剂对B16细胞的抑制率不同。黄芪注射液抑制率分别为6.43%、17.36%、26.55%、39.99%、79.90%,与空白组比较,各给药组差异均有统计学意义(<0.05);天花粉水煎剂抑制率分别为9.17%、20.86%、30.83%、40.67%、81.10%,与空白组比较,各给药组差异均有统计学意义(<0.05)。结果见表1。
表1 黄芪和天花粉作用48 h对B16细胞增殖的影响(n=3)
组别浓度OD值(±s)抑制率/% 空白组 1.705±0.017 黄芪注射液组 50 mg/mL1.604±0.013* 6.43 100 mg/mL1.409±0.024*17.36 200 mg/mL1.252±0.037*26.55 300 mg/mL1.023±0.108*39.99 400 mg/mL0.343±0.056*79.90 天花粉水煎剂组 160 µg/mL1.549±0.003* 9.17 320 µg/mL1.349±0.003*20.86 640 µg/mL1.179±0.009*30.83 1280 µg/mL1.012±0.096*40.67 2560 µg/mL0.322±0.043*81.10
注:与空白组比较,*<0.05
根据结果计算,黄芪注射液对B16细胞IC0、IC25、IC50剂量浓度分别为19、158、295 mg/mL;天花粉水煎剂对B16细胞IC0、IC25、IC50剂量浓度分别为81、762、1595 μg/mL。上述结果表明,黄芪和天花粉均能明显抑制B16细胞的增殖,且这种抑制作用随浓度增加而升高,且有浓度依赖性。
4.2 不同比例黄芪和天花粉配伍对小鼠恶性黑色素瘤B16细胞增殖的影响
药物处理48 h后,MTT检测结果显示,黄芪天花粉配伍组(黄芪注射液IC0+天花粉水煎剂IC0、黄芪注射液IC0+天花粉水煎剂IC25、黄芪注射液IC0+天花粉水煎剂IC50、黄芪注射液IC25+天花粉水煎剂IC0、黄芪注射液IC25+天花粉水煎剂IC25)抑制率分别为18.65%、30.39%、51.84%、27.96%、43.27%,与空白组比较差异有统计学意义(<0.05)。结果见表2。
表2 不同比例黄芪和天花粉配伍作用48 h对B16细胞增殖的影响(n=3)
组别 OD值(±s)抑制率/% 空白组1.705±0.017 黄芪注射液IC0+天花粉水煎剂IC0组1.387±0.077*18.65 黄芪注射液IC0+天花粉水煎剂IC25组1.187±0.012*30.39 黄芪注射液IC0+天花粉水煎剂IC50组0.821±0.008*51.84 黄芪注射液IC25+天花粉水煎剂IC0组1.228±0.141*27.96 黄芪注射液IC25+天花粉水煎剂IC25组0.967±0.046*43.27
注:与空白组比较,*<0.05
4.3 不同浓度黄芪和天花粉对小鼠恶性黑色素瘤B16细胞迁移的影响
培养48 h后,空白组B16细胞划痕距离减少,有细胞迁移运动;培养72 h后,空白组B16细胞划痕基本愈合。与空白组比较,除黄芪注射液50 mg/mL组外,其他各组划痕愈合程度均较空白组差异有统计学意义(<0.05);且随着天花粉水煎剂和黄芪注射液浓度的增加,划痕愈合程度越差,细胞迁移能力越弱,具有剂量依赖性。同时我们发现不同浓度天花粉水煎剂和黄芪注射液48 h后划痕愈合程度和72 h后划痕愈合程度未见明显差异,无时间依赖性。结果见图1。

图1 黄芪和天花粉对小鼠恶性黑色素瘤B16细胞迁移的影响
4.4 不同比例黄芪和天花粉配伍对B16细胞迁移的影响
培养72 h后,空白组B16细胞划痕愈合明显。除天花粉水煎剂IC0、黄芪注射液IC0+天花粉水煎剂IC0组外,其余各组较空白组差异均有统计学意义(<0.05)。黄芪注射液IC0+天花粉水煎剂IC0组与黄芪注射液IC0组、天花粉水煎剂IC0组比较无明显差异,细胞形态正常。黄芪注射液IC0+天花粉水煎剂IC25组、黄芪注射液IC25+天花粉水煎剂IC0组、黄芪注射液IC25+天花粉水煎剂IC25组与黄芪注射液IC25、天花粉水煎剂IC25组比较,划痕愈合程度差,细胞迁移能力弱,可见部分细胞死亡,有细胞碎片形成。天花粉IC50组与黄芪注射液IC0+天花粉水煎剂IC50组比较,对细胞迁移抑制程度无明显差异,但天花粉IC50组细胞大量死亡,配伍后死亡细胞量减少。由此可知,黄芪、天花粉及其配伍均能抑制B16细胞迁移,黄芪和天花粉不同配伍比例对划痕愈合能力的影响均优于相应剂量单味中药,差异均有统计学意义(<0.05)。结果见图2。
4.5 黄芪和天花粉对B16细胞迁移相关蛋白表达的影响
与空白组比较,762、1595 µg/mL天花粉水煎剂组及黄芪注射液各剂量组E-cadherin蛋白表达高于空白组,差异有统计学意义(<0.05);762、1595 µg/mL天花粉水煎剂组及158、295 mg/mL黄芪注射液组N-cadherin蛋白表达低于空白组,差异有统计学意义(<0.05)。结果见图3~图6。
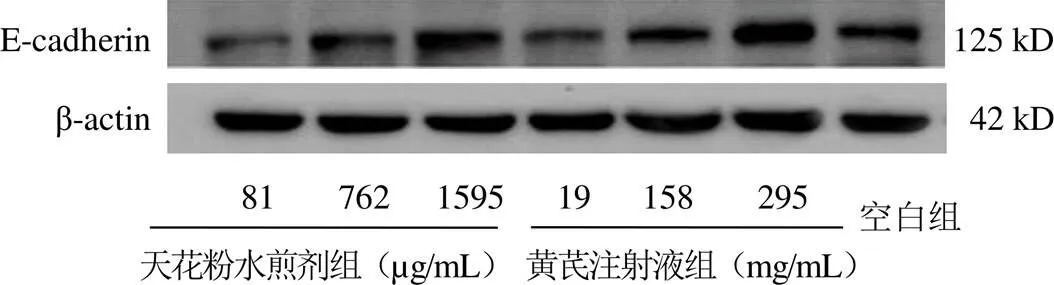
图3 黄芪和天花粉干预各组B16细胞E-cadherin蛋白免疫印迹图
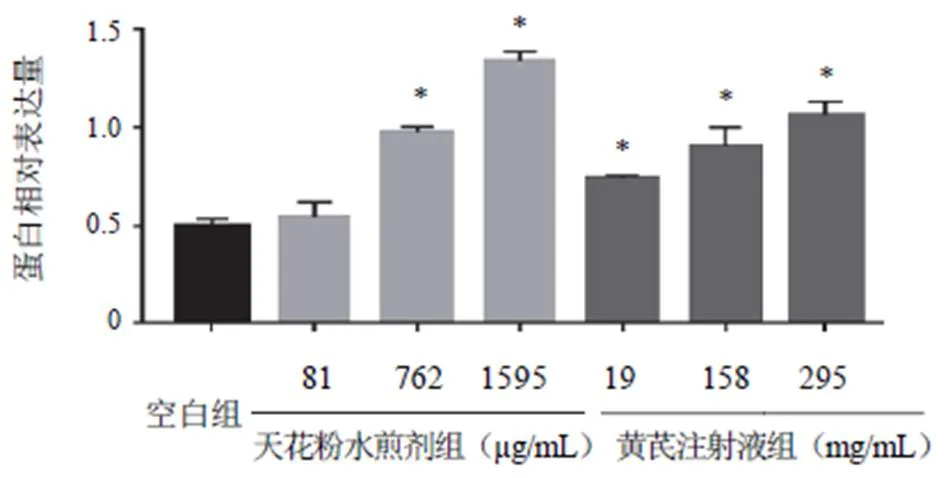
注:与空白组比较,*P<0.05

图5 黄芪和天花粉干预各组B16细胞N-cadherin蛋白免疫印迹图

注:与空白组比较,*P<0.05
4.6 黄芪和天花粉配伍对B16细胞迁移相关蛋白表达的影响
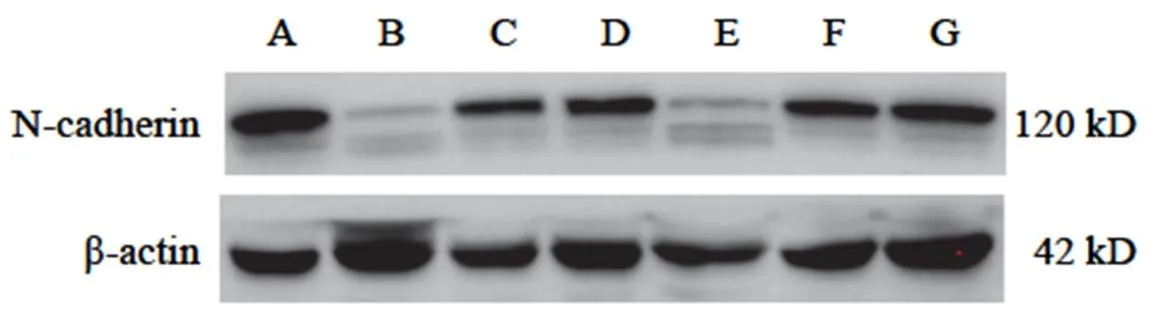
与空白组比较,黄芪注射液IC0+天花粉水煎液IC25组、黄芪注射液IC0+天花粉水煎液IC50组、黄芪注射液IC25+天花粉水煎液IC0组、黄芪注射液IC25+天花粉水煎液IC25组、黄芪注射液IC25+天花粉水煎液IC50组均能降低N-cadherin蛋白表达(<0.05);黄芪注射液IC0+天花粉水煎液IC50组、黄芪注射液IC25+天花粉水煎液IC25组、黄芪注射液IC25+天花粉水煎液IC50组均能升高E-cadherin蛋白表达(<0.05)。其中黄芪注射液IC0+天花粉水煎液IC50组效果最好,对细胞伤害较小,又能明显降低N-cadherin、升高E-cadherin蛋白表达,抑制细胞迁移,与前期划痕实验结果相符。结果见图7~图10。
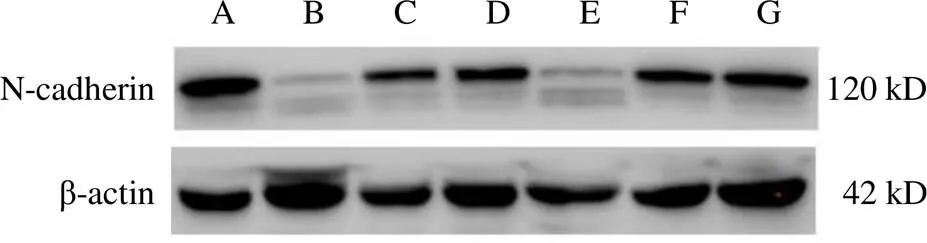
注:A.空白组;B.黄芪注射液IC25+天花粉水煎液IC50组;C.黄芪注射液IC25+天花粉水煎液IC25组;D.黄芪注射液IC25+天花粉水煎液IC0组;E.黄芪注射液IC0+天花粉水煎液IC50组;F.黄芪注射液IC0+天花粉水煎液IC25组;G.黄芪注射液IC0+天花粉水煎液IC0组(下同)
注:与空白组比较,*P<0.05
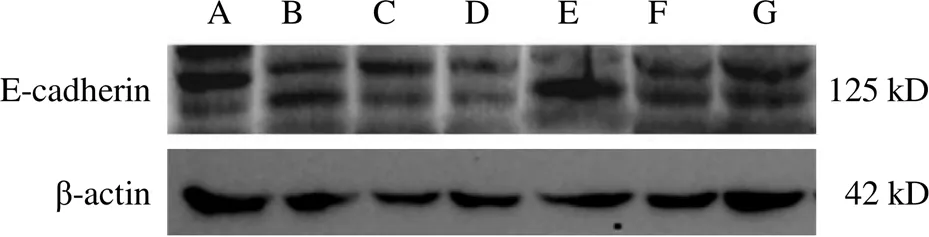
图9 黄芪和天花粉配伍各组B16细胞E-cadherin蛋白免疫印迹图
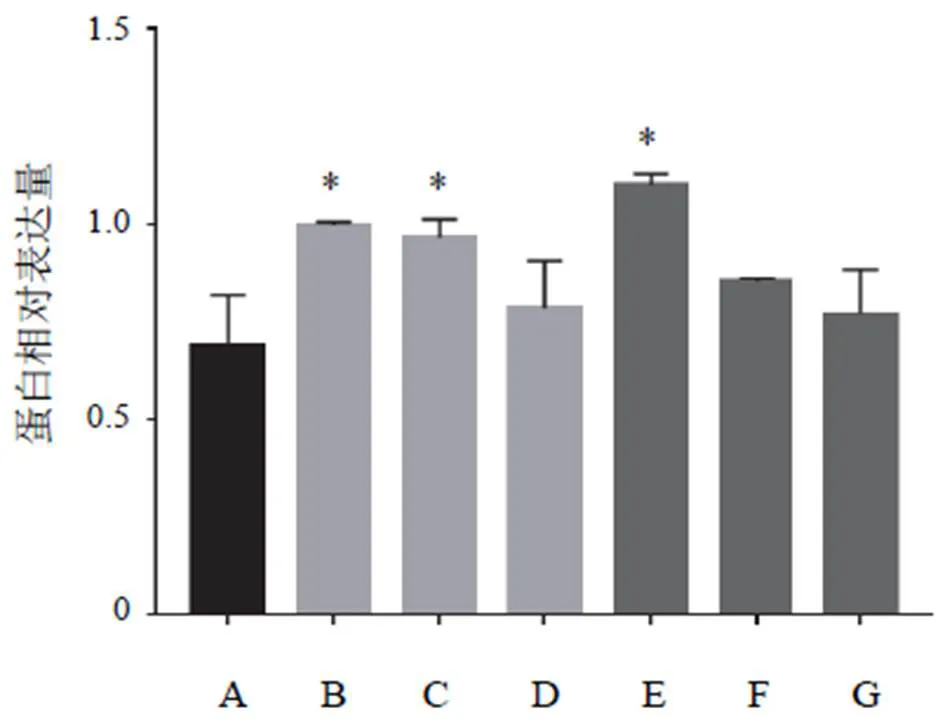
注:与空白组比较,*P<0.05
5 讨论
目前恶性黑色素瘤主要治疗方法是通过手术完全切除病灶,部分拒绝手术或晚期不能手术治疗患者多采用放疗、化疗方法,但疗效甚微,对机体损伤大,患者耐受度低,预后较差。寻求新的治疗方法改善患者预后是目前临床治疗恶性黑色素瘤迫切需要解决的问题。中医认为,恶性黑色素瘤病因病机包括气虚外感、气滞血瘀等诸多因素,形成机理以虚损为前提,阳气束结或外邪搏于血气而致气滞血瘀成乌黑肿块,瘀久化热,溃烂流脓[10],治疗应扶正祛邪。相比于手术、放化疗等对机体损伤较大的治疗方法,中药在治疗恶性黑色素瘤方面历史悠久,从中寻找治疗恶性黑色素瘤的药物具有广阔的应用前景。黄芪、天花粉均有抗肿瘤功效,中医临床常将其单独或组成各种方剂用于各类中、晚期癌症患者的治疗。单味药应用易产生耐药性,且高剂量药物虽对细胞抑制作用强,但可能在杀死肿瘤细胞的同时损伤正常细胞。配伍是中药治疗的主要应用方法,多种药物间配伍不仅能提高疗效、减少不良反应,也不易产生耐药性,具有不可忽视的优势。本实验发现黄芪和天花粉配伍不仅能抑制细胞的增殖和迁移运动,还能降低高剂量药物对细胞的损伤,配伍后对细胞增殖的抑制作用与相应剂量的单药相比效果更好。
进展迅速是恶性黑色素瘤的主要特性之一,肿瘤细胞不断增殖及迁移运动,促进肿瘤生长,推进病程发展。细胞增殖需4个阶段完成一次增殖周期,每个阶段都存在细胞周期调控点,通过减缓或暂时中止细胞周期进程而提供细胞足够时间纠正细胞周期中的错误,只有通过调控点,细胞才能进入下一阶段完成增殖。若细胞周期调控点失去调控作用,可造成细胞生长、分裂失去控制,导致癌症发生,中药抗肿瘤机制主要为阻滞细胞周期和诱导细胞凋亡,黄芪和天花粉能通过阻滞细胞周期,从而抑制肿瘤细胞增殖,达到抗肿瘤作用[11-13]。本研究中MTT结果表明,黄芪和天花粉单药及配伍均能抑制恶性黑色素瘤B16细胞增殖,且两药配伍后抑制B16细胞增殖效果较好。
转移性强是恶性黑色素瘤另一特性,抑制肿瘤细胞迁移能抑制其进一步扩散,减缓肿瘤进程。相关研究表明,黑色素瘤细胞生长过程中,E-cadherin通常被N-cadherin替换,而N-cadherin可促成肿瘤细胞转移。转录因子snail可活化N-cadherin的表达,抑制E-cadherin的表达,从而促进转移的发生[14]。本研究中细胞划痕实验及Western blot结果显示,黄芪和天花粉单药及配伍均能抑制恶性黑色素瘤B16细胞迁移,且随药物浓度的升高抑制作用增强,具有浓度依赖性。黄芪和天花粉单药均可增强E-cadherin蛋白表达,降低N-cadherin蛋白表达,两药配伍后效果更好,与划痕实验结果相符,说明两药起到协同作用,间接解释了划痕实验中两药配伍后B16细胞愈合能力较单味药差,两药配伍对细胞迁移的抑制更有效,这与文献报道中肿瘤迁移的机制一致[14]。
综上,黄芪和天花粉能通过抑制小鼠恶性黑色素瘤B16细胞的增殖及迁移运动,抑制肿瘤的生长及转移,从而发挥抗肿瘤作用,其抑制细胞迁移机制与E-cadherin、N-cadherin蛋白表达相关。此外,不同配伍比例对细胞增殖和迁移作用不同,部分配伍能在增加对细胞增殖抑制作用的同时减少对细胞的损伤,这种抑制增殖的作用是否通过阻滞细胞周期进行仍需进一步研究证实,后期将继续研究两药配伍后对细胞增殖和迁移的影响,进一步探讨其作用机制,为临床治疗恶性黑色素瘤提供依据。
[1] 李杨,安方玉,明海霞,等.黄芪多糖对中波紫外线辐射皮肤角质形成细胞损伤的影响[J].中国中医药信息杂志,2016,23(5):44-46.
[2] 富琦,张青.郁仁存应用黄芪配伍治疗恶性肿瘤临床经验总结[J].中国中医药信息杂志,2015,22(12):104-105.
[3] 陆婷婷,柯玲玲.黄芪多糖靶向肿瘤微环境的抗肿瘤作用机制[J].江西中医药大学学报,2019,31(1):107-111.
[4] 张乔,张琦,李静.黄芪甲苷抗肿瘤作用研究进展[J].中医药信息, 2019,36(1):129-132.
[5] 宋京美,吴嘉瑞,姜迪.基于数据挖掘的国家级名老中医治疗肿瘤用药规律研究[J].中国中医药信息杂志,2015,22(6):50-53.
[6] 刘翔.天花粉对人乳腺癌MCF-7细胞凋亡及相关基因表达的影响[J].中国临床药理学杂志,2018,34(7):841-844.
[7] 邓心燕,杨玉,胡仁豪,等.天花粉蛋白抑制胃癌细胞生长及其分子机制研究[J].中国中西医结合杂志,2018,38(8):958-962.
[8] 周海祥,卜平,董小耘,等.天花粉蛋白抗肿瘤作用及机制的研究进展[J].医学综述,2017,23(16):3197-3201.
[9] 张琳婧,梁羽茜,王媛媛,等.黄芪和天花粉配伍治疗黑色素瘤的文献挖掘[J].中医药学报,2019,47(1):43-47.
[10] 茅婧怡,周洁,张明,等.恶性黑色素瘤的中医药治疗及研究进展[J].世界临床药物,2017,38(6):428-434.
[11] 刘小敏,卢琳琳,黄艳芳,等.黄芪水提物抑制PI3K/Akt通路预防肺癌发生的作用及机制研究[J].中草药,2019,50(7):1621-1628.
[12] 胡俊媛,刘巧,杨颖,等.黄芪注射液影响人恶性黑色素瘤细胞增殖和迁移的实验研究[J].辽宁中医杂志,2015,42(4):819-823.
[13] 杨颖,刘巧,胡俊媛,等.中药天花粉对人恶性黑色素瘤细胞形态、增殖、周期和迁移的影响[J].中医药学报,2015,43(2):30-34.
[14] ALADOWICZ E, FERRO L, VITALI G C, et al. Molecular networks in melanoma invasion and metastasis[J]. Future Oncol,2013,9(5):713-726.
Effects of Astragali Radix and Trichosanthis Radix on Cell Proliferation and Migration of Mouse Malignant Melanoma B16 Cells and Expressions of E-cadherin and N-cadherin
ZHANG Qiuyan, HUANG Songli, ZHANG Linjing, LIANG Yuxi, ZHAO Piwen, WEI Shengli, HU Xiuhua
To investigate the effects and mechanisms of Astragali Radix, Trichosanthis Radix and their compatibility on the proliferation and migration of mouse malignant melanoma B16 cells; To discuss its possible mechanism.MTT method was used to detect the proliferation of B16 cells. Based on the results, the drug concentration corresponding to the cell growth inhibition rate of 0% (IC0), the drug concentration corresponding to 25% (IC25), and the drug concentration corresponding to 50% (IC50) were calculated. Blank group and the compatible group (Astragalus IC0+ Trichosanthin IC0, Astragalus IC0+ Trichosanthin IC25, Astragalus IC0+ Trichosanthin IC50, Astragalus IC25+ Trichosanthin IC0, Astragalus IC25+ Trichosanthin IC25) were set. Cell scratch test was used to detect B16 cell migration; Western blot was used to detect the expressions of B16 cell migration related proteins E-cadherin and N-cadherin.MTT results showed that Astragali Radix and Trichosanthis Radixwith different concentrations could inhibit the proliferation of B16 cells in a dose-dependent manner. Results of cell scratch test showed that both Astragali Radix and Trichosanthis Radix would affect the scratch healing of B16 cells, inhibit cell migration, and were concentration-dependent. After the compatibility of Astragali Radix and Trichosanthis Radix, the inhibition rate of cell proliferation was significantly higher than that of the single Chinese materia medica, with statistical significance (<0.05). Western blot results showed that both Astragali Radix and Trichosanthis Radix increased the expression of E-cadherin protein and decreased the expression of N-cadherin protein.Both Astragali Radix and Trichosanthis Radix can inhibit cell proliferation and migration of malignant melanoma B16. The compatibility of Astragali Radix and Trichosanthis Radix have better efficacy than single Chinese materia medica. Its mechanism of inhibiting cell migration may be related to the protein expressions of E-cadherin and N-cadherin.
Astragali Radix; Trichosanthis Radix; B16 cells; cell proliferation; cell migration; compatibility

R285.5
A
1005-5304(2020)05-0028-07
10.3969/j.issn.1005-5304.201910097
国家自然科学基金(81673764);北京中医药大学校级自主课题(2017-JYB-XS-032);子洲黄芪规范化种植新技术开发研究(2020071720274)
胡秀华,E-mail:xiuhuahu@126.com
(2019-10-09)
(2019-11-01;编辑:华强)
