基于IL-6、JAK2/STAT3信号通路探讨复方当归注射液在缺血性卒中炎性反应中的作用
2020-05-15李月汤轶波李韵歆于雪张巧慧陈亚飞白雪马茹王淑艳刘振权
李月 汤轶波 李韵歆 于雪 张巧慧 陈亚飞 白雪 马茹 王淑艳 刘振权

〔摘要〕 目的 基于IL-6和JAK2/STAT3信号通路,探讨复方当归注射液在缺血性卒中炎性反应中的作用。方法 将大鼠随机分为空白对照组、假手术组和造模组。采用线栓法建立大脑中动脉栓塞致局灶性缺血损伤模型,造模成功后,再将造模大鼠随机分为模型组、复方当归注射液组和依达拉奉组,各組给予相应药物干预7 d,于末次给药24 h后处死取脑组织,采用TTC染色法观察各组大鼠的脑梗死情况;采用HE染色法观察各组大鼠脑组织病理学情况;采用ELISA法检测各组大鼠血浆中IL-6的含量;采用Western Blot法检测各组大鼠脑组织中p-JAK2、JAK2、p-STAT3、STAT3的表达情况。结果 复方当归注射液组可缩小缺血性卒中大鼠的脑梗死区域,减轻脑组织神经元的异常形态变化;复方当归注射液组IL-6的含量及p-JAK2/JAK2和p-STAT3/STAT3水平均低于模型组(P<0.01)。结论 复方当归注射液可通过降低缺血性卒中大鼠IL-6及p-JAK2/JAK2、p-STAT3/STAT3的表达,抑制炎性反应,发挥神经保护作用。
〔关键词〕 缺血性卒中;复方当归注射液;炎性反应;IL-6;JAK2/STAT3
〔中图分类号〕R285.5;R743.3 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.04.006
Discussion on the Effects of Compound Danggui Injection in the Inflammatory Reaction of
Cerebral Ischemia Stroke Based on IL-6 and JAK2/STAT3 Signaling Pathway
LI Yue1, TANG Yibo2, LI Yunxin2, YU Xue2, ZHANG Qiaohui2, CHEN Yafei2, BAI Xue1, MA Ru1,
WANG Shuyan2, LIU Zhenquan1*
(1. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China;
2. School of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China)
〔Abstract〕 Objective To explore the effects of Compound DangguiInjection in the inflammatory reaction of cerebral ischemia stroke based on IL-6 and JAK2/STAT3 signaling pathway. Methods Rats were randomly divided into a blank controlgroup, a sham operation group and a modeling group. Models of rat with cerebral ischemia stroke were reproduced by middle cerebral artery occlusion (MCAO). After successful modeling, the rats were randomly divided into a model group, a Compound Danggui Injection group and an edaravone group. The rats in each group were given corresponding drugs for 7 days of intervention. Brain tissues were sacrificed 24 hours after the last administration, and TTC staining was used to observe the cerebral infarction of each group of rats; HE staining was used to observe the brain histopathology of various groups of rats; The content of IL-6 in the plasma of rats in each group was detected by ELISA. Western Blot was used to detect the expression of p-JAK2, JAK2, p-STAT3 and STAT3 in the brain tissues of rats in each group. Results The Compound Danggui Injection group can reduce the cerebral infarction area of rats with ischemic stroke and reduce the abnormal morphological changes of neurons in the brain tissue; the content of IL-6 and p-JAK2/JAK2 and p-STAT3/STAT3 level in the Compound Danggui Injection group was lower than in the model group (P<0.01). Conclusion Compound Danggui Injection can reduce the expression of IL-6, p-JAK2/JAK2, p-STAT3/STAT3 in rats with ischemic stroke, inhibit the inflammatory response, and play a neuroprotective role.
〔Keywords〕 cerebral ischemic stroke; Compound Danggui Injection; inflammatory reaction; IL-6; JAK2/STAT3 signaling pathway
缺血性卒中现已成为世界第三大死亡原因[1],病死率约为5%~15%,致残率高达50%[2]。它不仅严重威胁患者的生命,而且降低了患者的生活质量,其中主要类型是脑梗死。我国目前的发展趋势,中医药在缺血性卒中的治疗中发挥了强大的优势,不仅可以提高患者的生存率,还可以提高患者术后恢复期和后遗症期的生活质量。复方当归注射液(compound angelica injection,CAI)由当归、川芎与红花三味中药组成,临床用于治疗痛经、闭经、风湿痹痛及中风后遗症等,前期的实验研究发现CAI对缺血性脑损伤大鼠模型具有发挥神经保护作用[3]。缺血性卒中是指由于血管栓塞或血压突然下降而引起脑组织某个特定区域缺血,最终导致部分脑组织坏死,神经功能损伤的疾病。越来越多的证据表明,炎性反应在缺血性卒中发生发展中扮演重要角色[4-6]。本实验研究的IL-6是具有代表性的炎性细胞因子,JAK2/STAT3 是一条重要的炎性反应信号通路,且IL-6以及JAK2/STAT3信号通路相关蛋白(p-JAK2、JAK2、p-STAT3、STAT3)在血清和脑组织中可表达。本实验通过IL-6、JAK2/STAT3信号通路在缺血性卒中大鼠模型中的作用,探讨复方当归注射液在缺血性卒中炎性反应中的作用,进一步补充其神经保护机制,为缺血性卒中的临床用药提供进一步的科学依据。
1 材料与方法
1.1 动物
健康雄性SD大鼠90只,购自维通利华实验动物技术有限公司,许可证号:SCXK(北京) 2012-0001,等级为SPF级,鼠龄6~8周,体质量(200±20)g,饲养于北京中医药大学良乡校区实验中心,控制室温在18~20 ℃,控制湿度在55%~60%,大鼠自由进食饮水,定期更换垫料。
1.2 主要药物、试剂与仪器
复方当归注射液(福建古田药业有限公司,批号:1710102);依达拉奉注射液(南京先声东元制药有限公司,批号:80-181203);2,3,5-苯氯化四氮唑(TTC)溶液(美国 Sigma 公司,货号:T8877-5G);IL-6 ELISA kit(武汉六合生物技术有限公司,货号:LH-E10103RA);BCA蛋白浓度测定试剂盒(北京普利莱基因技术有限公司,货号:P1151-1);5×蛋白上样缓冲液(北京普利莱基因技术有限公司,货号:D8418);4×SDS-PAGE分离胶缓冲液、4×SDS-PAGE浓缩胶缓冲液、10×TBST缓冲液(北京索莱宝科技有限公司,货号:S1051、S1052、T1081);APS、TEMED(美国Amersco公司,货号:0486、0761);一抗稀释液(碧云天生物科技公司,货号:P0023A);高灵敏度化学发光检测试剂盒(ECL)发光液(美国Millipore公司,货号:WBKLS0100);兔抗大鼠单克隆p-JAK2抗体、兔抗大鼠单克隆JAK2抗体、兔抗大鼠单克隆p-STAT3抗体、兔抗大鼠单克隆STAT3抗体(均为Cell Signaling Technology产品);β-Actin小鼠抗大鼠抗体(货号:TA-09)、辣根酶标记山羊抗小鼠IgG(货号:ZB-2305)、辣根酶标记山羊抗兔IgG(货号:ZB-2301)均为北京中杉金桥生物技术有限公司产品。台式冷冻离心机(德国Eppendrof公司,型号:5424 R);病理切片机(上海徕卡仪器有限公司,型号:HistoCore Arcadia C);iMark酶标仪、PowerPac通用型电泳仪电源均为美国Bio-Rad公司产品;水平电泳槽(北京君意东方电泳设备有限公司,型号:JY-SPAT);超灵敏多功能成像仪(美国Azure Biosystems公司,型号:C600);MCAO栓线(北京西浓科技有限公司,货号:2636-A3)。
1.3 造模
制备大鼠局灶性脑缺血模型:用10%水合氯醛按照0.04 mL/kg体质量进行麻醉,将大鼠仰卧固定于鼠板上,从颈部正中切开,逐层分离组织,暴露右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),首先用缝合线结扎CCA近心端和ECA根部、暂时结扎CCA的远心端,同时用动脉夹暂时夹闭ICA。然后用注射器在CCA结扎处远心端切入小斜口,接着将直径为0.25 mm的线栓(光滑球面的一端)经此斜口插入,经CCA分叉处进入ICA,从而闭塞大脑中动脉(MCA)的起始部,线栓平均插入深度为(18.0±0.5)mm,最终造成MCA供血相关区的梗死。假手术组,过程同模型组,分离出右侧CCA及ECA、ICA,但仅结扎ECA。
1.4 分组与干预
实验动物进行7 d适应性喂养后,按照随机数字表分为空白对照组、假手术组和造模组,造模成功后,造模组再随机分为模型组、复方当归注射液组、依达拉奉组,每组16只。造模1 d后,进行腹腔注射进行给药,复方当归注射液组给予0.05 mL/kgCAI,依达拉奉组给予0.03 mL/kg依达拉奉,空白对照组、假手术组和模型組给予0.03 mL/kg生理盐水。每日1次,连续7 d。
1.5 TTC染色法观察脑梗死情况
各组大鼠于末次给药24 h后,每组随机抽取3只,用10%水合氯醛按照0.04 mL/kg体质量进行麻醉处死,在冰盒上迅速取出全脑,放入-20 ℃冷冻15 min,用刀片将大鼠全脑沿冠状面切成厚度均匀5片,每片大约2 mm,将脑切片逐一放入在孔板中,每片脑切片滴入等量的1%TTC溶液,在室温避光环境下染色30 min(15 min时将脑切片翻转一下)。染色后置于4%多聚甲醛溶液中固定,24 h后对每片脑切片进行拍照记录。
1.6 HE染色法观察脑组织病理形态
各组大鼠于末次给药24 h后,每组随机抽取3只,用10%水合氯醛按照0.04 mL/kg体质量进行麻醉处死,在冰盒上迅速取出全脑,立即放入10%的甲醛溶液中固定,48 h后,进行石蜡包埋,制备厚度约为5 μm石蜡切片,进行常规HE染色。将切片在400倍光学显微镜下进行观察脑组织结构、神经元数量、细胞核形态和胞质染色情况,拍照记录。
1.7 ELISA法检测血浆中IL-6的含量
各组大鼠于末次给药物24 h后,每组随机抽取4只,用10%水合氯醛按照0.04 mL/kg体质量进行麻醉,腹主动脉取血,置于采血管中,静止20 min中,3 000 r/min、4 ℃离心10 min,取上清,放入-80 ℃冰箱中备用。严格按照IL-6 ELISA kit说明书操作,用酶标仪测定吸光度(OD值),通过标准曲线计算血浆中IL-6的含量。
1.8 Western Blot法检测脑组织中p-JAK2、JAK2、p-STAT3、STAT3蛋白表达水平
上述每组4只动物腹主动脉取血后处死,在冰盒上迅速取出全脑,分离出左侧(病灶区)半球皮质区,放入-80 ℃冰箱中备用。取40~60 mg脑组织,提取总蛋白,BCA法定量蛋白浓度,然后进行电泳、电转,用1×TBST配制的5%脱脂奶粉进行封闭1 h,加入一抗(p-STAT3 1∶4 000,STAT3 1∶2 000,p-JAK2 1∶2 000,JAK2 1∶2 000,β-Actin 1∶10 000),4 ℃孵育过夜,加入用1×TBST配制的5%脱脂奶粉配置的二抗(山羊抗兔IgG-HRP 1∶2 000,山羊抗小鼠IgG-HRP 1∶2 000),室温摇床孵育1 h,加入ECL 发光液曝光成像,观察p-JAK2、JAK2、p-STAT3、STAT3蛋白表达的灰度值,以β-Actin作为内参,用Image J软件分析灰度值,计算灰度系数比。
1.9 统计学处理
计量资料用“x±s”表示,各组数据若满足正态分布和方差齐时,组间比较采用方差分析,方差不齐则用秩和检验,同组比较采用成组t检验。运用用SAS 9.2和GraphPad Prism8软件处理。以P<0.05作为差异有统计学意义。
2 结果
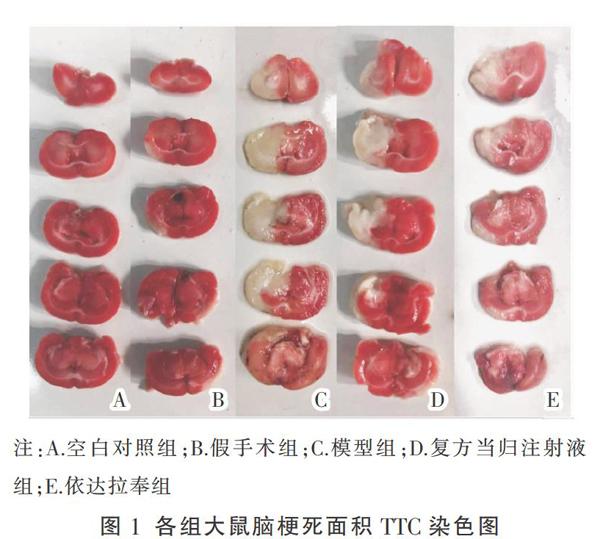
2.1 复方当归注射液对缺血性卒中大鼠脑梗死面积的影响
TTC染色白色部分为梗死区,粉红色部分为正常脑组织区。结果表明,空白对照组和假手术组的大鼠未见缺血梗死灶,模型组、复方当归注射液组、依达拉奉组的大鼠造模后均出现了不同程度的白色梗死灶。与模型组相比,复方当归注射液组和依达拉奉组的脑梗死面积呈减小趋势,见图1。
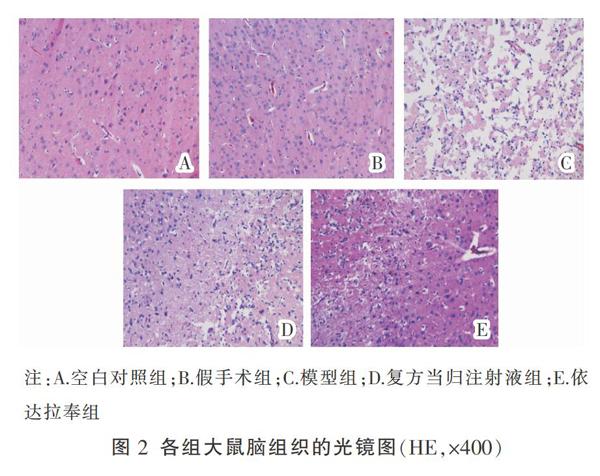
2.2 复方当归注射液对缺血性卒中大鼠脑组织病理状态的影响
HE染色结果显示,空白对照组和假手术组脑组织的神经细胞排列密集并整齐,结构形态完整,细胞质丰富,细胞核呈圆形,同时染色清晰;模型组的脑组织神经细胞排列稀疏且紊乱,细胞数量明显减少,结构松散模糊,并周围出现不同程度的水肿,细胞质出现大量空泡,细胞核结构出现严重皱缩,呈三角形,表明部分细胞已经变形和坏死;与模型组相比,复方当归注射液组和依达拉奉组的神经细胞结构改变减轻,并且坏死和凋亡的细胞数量减少,见图2。
2.3 复方当归注射液组对缺血性卒中大鼠血浆中IL-6含量的影响
结果显示,与空白对照组和假手术组比较,模型组中IL-6含量明显增多(P<0.01);与模型组相比,复方当归注射液组和依达拉奉组IL-6含量均明显减少(P<0.01),见表1。
2.4 复方当归注射液对缺血性卒中大鼠脑组织JAK2/STAT3通路相关蛋白表达水平的影响
结果所示,各组JAK2、STAT3蛋白表达均无明显变化,而模型组p-JAK2和p-STAT3蛋白表达水平较假手术组明显升高(P<0.01);复方当归注射液组p-JAK2和p-STAT3蛋白表达水平较模型组明显降低(P<0.01),依达拉奉组p-JAK2和p-STAT3蛋白表达水平较模型组也明显降低(P<0.01)。见图3和表2。为了更加说明复方当归注射液对缺血性卒中大鼠脑组织JAK2/STAT3信号的影响,本文对各组p-JAK2/JAK2和p-STAT3/STAT3水平数据进行分析(n=4),与假手术组比较,模型组p-JAK2/JAK2和p-STAT3/STAT3水平显著升高(P<0.01);与模型组比较,复方当归注射液组和依达拉奉组p-JAK2/JAK2和p-STAT3/STAT3水平均显著降低(P<0.01),结果表明,复方当归注射液可以抑制缺血性卒中大鼠模型JAK2/STAT3信号通路的异常激活。见图4。
3 讨论
缺血性卒中是一个复杂的病理生理过程,其损伤机制主要通过级联反应发挥,主要包括氧化应激损伤、兴奋性氨基酸、钙超载、酸中毒、炎症反应和细胞凋亡等。目前,越来越多的证据表明炎症反应是影响缺血性脑卒中发生发展的重要因素。主要反应包括外周白细胞渗入脑实质和内源性小胶质细胞的激活[7-8],其主要以炎性级联反应为主攻击因素[9-10],活化促炎细胞因子[11]、趋化因子[12]和黏附分子[13]進而发挥炎性损伤。因此,本文通过线栓法建立缺血性脑卒中大鼠模型,探讨复方当归注射液在缺血性卒中炎性反应中作用,结果显示,缺血性卒中大鼠模型脑组织出现明显的梗死灶区域以及神经元损伤、凋亡等病理状态,同时血浆中IL-6含量显著增多,脑组织中p-JAK2/JAK2和p-STAT3/STAT3水平明显增加;复方当归注射液干预治疗7 d后,大鼠脑组织梗死灶面积减小、细胞凋亡数目明显减少,同时血浆中IL-6含量显著减少,脑组织中p-JAK2/JAK2和p-STAT3/STAT3水平明显降低。结果表明,复方当归注射液可以减轻缺血性卒中大鼠模型的炎性反应,发挥神经保护作用。
IL-6是炎性級联反应中的关键因子,属于多效性的细胞因子,其主要通过浸润内皮细胞,诱导细胞黏附分子、P-selectin及E-selectin的表达,致使白细胞大量聚集、黏附,从而参与炎性级联反应,加剧脑损伤[14]。曲颖等[15]研究发现,脑毒清颗粒可以通过降低大鼠脑缺血再灌注损伤后血浆中IL-6的含量,减少脑梗死体积,发挥神经保护作用。因此,目前的研究普遍认为IL-6在缺血性卒中的发生和发展中起着重要作用。抑制其表达可减少炎症反应,发挥神经功能。
在JAK/STAT信号通路中,JAK2/STAT3信号通路是最重要的一条信号通路。JAK/STAT信号通路主要由三部分组成,即酪氨酸激酶(JAK)家族、酪氨酸激酶相关受体、信号转导子和转录激活子(STAT)家族组成。在JAK/STAT信号通路的传导过程中,受体首先在细胞膜上与多种细胞因子进行特异性结合,形成二聚体;然后在细胞膜内与JAKs构成结合位点,发生磷酸化,活化的JAKs进一步结合胞浆内STATs,发生磷酸化;接着磷酸化的STATs进入细胞核内,与DNA上的特定基因序列结合,调节转录,进而参与细胞生殖、凋亡、应激、炎性反应、免疫调节等多种生理及病理过程[16]。研究表明,JAK2/STAT3信号通路是参与缺血性卒中发生发展的一条重要的炎性反应相关通路[17],其是参与小胶质细胞活化调节的关键,抑制其异常激活,可以减轻小胶质细胞的活化,抑制炎性因子的释放,减轻炎性损伤,发挥神经保护作用[18]。正常状态下,p-JAK2 和 p-STAT3 在大鼠脑组织中少量表达,而发生缺血性卒中时其表达量则显著增加[19]。陈媛等[20]研究发现,葛根素可以通过降低脑缺血再灌注大鼠模型脑组织中p-JAK2和p-STAT3的蛋白表达水平,减小脑梗死面积,发挥神经保护作用。因此,通过抑制JAK2/STAT3信号通路的异常激活,可以减轻缺血性卒中大鼠的炎性反应,发挥神经保护作用。
综上所述,复方当归注射液可以减轻缺血性卒中大鼠模型的炎性反应,减小脑梗死面积,提高神经元的存活数量,发挥神经保护作用,其发挥保护作用的机制可能与抑制炎性因子IL-6表达以及JAK2/STAT3信号通路的异常激活相关,在后续的实验中需要对其机制进行更深入的研究。
参考文献
[1] MERCHAN-BAEZA J A, GONZALEZ-SANCHEZ M, CUESTA-VAEGAS A. Clinical Effect Size of an Educational Intervention in the Home and Compliance With Mobile Phone-Based Reminders for People Who Suffer From Stroke: Protocol of a Randomized Controlled Trial[J]. JMIR Research Protocols, 2015,4(1):e33(1-11).
[2] 刘红艳.益气活血祛瘀法对缺血性卒中患者神经功能的影响[J].光明中医,2018,33(2):165-167.
[3] 汤轶波,朱春燕,袁伟畅,等.复方当归注射液对大鼠缺血性脑损伤模型的影响[J].中国中医药信息杂志,2015,22(2):68-70.
[4] DZIEDZIC T. Systemic inflammation as a therapeutic target in acute ischemic stroke[J]. Expert Review of Neurotherapeutics, 2015,15(5):523-531.
[5] GU Y, CHEN J, SHEN J. Herbal medicines for ischemic stroke: combating inflammation as therapeutic targets[J]. Journal of Neuroimmune Pharmacol, 2014,9(3):313-339.
[6] JIN R, LIU L, ZHANG S, et al. Role of inflammation and its mediators in acute ischemic stroke[J]. Journal of Cardiovascular Translational Research, 2013,6(5):834-851.
[7] SAMSON Y, LAPERGUE B, HOSSEINI H. Inflammation and ischaemic stroke: current status and future perspectives[J]. Nature Reviews Neurology (Paris), 2005,161(12 pt 1):1177-1182.
[8] CHAMORRO A, HALLENBECK J. The harms and benefits of inflammatory and immune responses in vascular disease[J]. Stroke,2006,37(2):291-293.
[9] DANTON G H, DIETRICH W D. Inflammatory mechanisms after ischemia and stroke[J]. Journal of Neuropathology and Experimental Neurology, 2003,62(2):127-136.
[10] BESCHORNER R, SCHLUESENER H J, GOZALAN F, et al. Infiltrating CD14+ monocytes and expression of CD14 by activated parenchymal microglia/macrophages contribute to the pool of CD14+ cells in ischemic brain lesions[J]. Journal of Neuroimmunol, 2002,126(1-2): 107-115.
[11] HAN H S, YENARI M A. Cellular targets of brain inflammation in stroke[J]. Curr Opin Investig Drugs, 2003,4(5):522-529.
[12] GARAU A, BERTINI R, COLOTTA F, et al. Neuroprotection with the CXCL8 inhibitor repertaxin in transient brain ischemia[J]. Cytokine, 2005,30(3):125-131.
[13] SUDHRUE M E, MEHRA A, CONNOLLY E S, et al. Anti-adhesion molecule strategies as potential neuroprotective agents in cerebral ischemia: a critical review of the literature[J]. Inflammation Research, 2004,53(10):497-508.
[14] WYTRYKOWSK A, PROSBA-MACKIEWICZ M, NYKAWM. IL-1β, TNF-α, and IL-6 levels in gingival fluid and serum of patients with ischemic stroke[J]. Journal of Oral Science, 2016;58(4):509-513.
[15] 曲 穎,王 巍,贾维刚,等.脑毒清颗粒对大鼠脑缺血再灌注损伤后IL-6和TNF-α含量的影响[J].中国中医急症,2014,23(10):1823-1825.
[16] RAIBLE D J, FREY L C, BROOKS-KAYAL A R. Effects of JAK2-STAT3 signaling after cerebral insults[J]. JAK-STAT,2014,3(2):e29510.
[17] WANG X L, QIAO C M, LIU J O, et al. Inhibition of the SOCS1-JAK2-STAT3 Signaling Pathway Confers Neuroprotection in Rats with Ischemic Stroke[J]. Cellular Physiology and Biochemistry, 2017, 44(1):85-98.
[18] 张 贺.二氢杨梅素通过抑制小胶质细胞中NF-κB和JAK2/STAT3信号通路来减轻脂多糖诱导的炎症反应[D].南京:南京大学,2017.
[19] ZHANG Y, LIU J, YANG B, et al. Ginkgo biloba Extract Inhibits Astrocytic Lipocalin-2 Expression and Alleviates Neuroinflammatory Injury via the JAK2/STAT3 Pathway After Ischemic Brain Stroke[J]. Frontiers in Pharmacology, 2018,4(16):518-524.
[20] 陈 媛,黄晓松,吴海金,等.葛根素对大鼠脑缺血再灌注损伤后JAK2/STAT3信号通路的影响[J].湖南中医杂志,2017,33(4):144-147,165.
〔收稿日期〕2019-11-06
〔基金项目〕国家自然科学基金项目(81603453)。
〔作者简介〕李 月,女,在读硕士研究生,研究方向:中药药理脑病防治。
〔通讯作者〕*刘振权,男,教授,博士研究生导师,E-mail:lzqbzy@sina.com。
