铜基水汽变换催化剂NH3中毒热力学研究
2020-05-15都园园
杨 弘,都园园
(烟台市环保工程咨询设计院有限公司,山东烟台 264000)
水汽变换反应[CO(g)+H2O(g)→CO2(g)+H2(g)]常用作工业化氢气及合成气的生产。从热力学角度,该反应只需要在一定的操作条件下自发向右进行即可,但化工工业化规模生产的重点是产品的收率及生产效率,因此,从动力学角度,研制用于加速化学反应速率的催化剂是应用的关键。随着能源环境领域的技术发展,利用含CO 工业混合废气(如焦炉煤气、炭黑尾气、黄磷尾气等)作为变换原料气已成为可能。但由于该类型废气中含有多种成分的气态杂质(如H2S、SO2、PH3、HF、AsH3、NH3、HCN 等),若直接利用将造成催化剂永久性中毒。
Cu/ZnO/Al2O3是一种应用最为广泛的水汽变换催化剂。其中,Cu 微晶是该催化剂的活性组分。目前,对于单一杂质如硫(H2S、CS2)、磷(PH3)、氟(HF)、砷(AsH3)等导致Cu/ZnO/Al2O3催化剂中毒已有相关报道。本文从化学热力学角度出发,采用HSC Chemistry 6.0计算程序模拟分析了NH3作为杂质气体存在时,变换原料气中的主要组分(CO、H2O)与Cu/ZnO/Al2O3催化剂中活性成分(Cu 微晶)发生反应的可能性,并探讨可能生成的中毒产物。
1 热力学计算方法
本文的模拟计算原理和方法可参阅文献。计算程序中输入的温度为150~300℃,升温步长为10℃,压力为101.325kPa。
2 结果与讨论
2.1 Cu-NH3体系
无其他气体存在时,NH3与催化剂中的活性Cu 可能发生的反应见式(1)~(4)。图1为计算得到的反应式(1)~(4)吉布斯自由能(ΔG)随温度变化的关系。由图1 可知,在150~300℃时,以下4个反应的ΔG>0,表明该系列反应都不能自发向右进行。因此,单一NH3气氛下不能引起催化剂中毒。
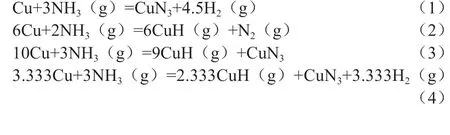
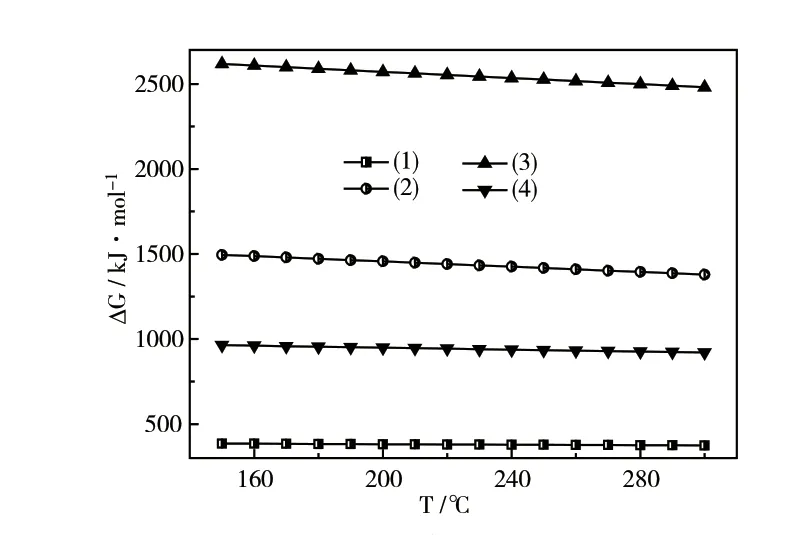
图1 方程式(1)~(4)的吉布斯自由能与温度的关系
2.2 Cu-NH3-CO体系
气流中NH3和CO 共存时,与催化剂中的活性Cu 可能发生的反应见式(5)~(14)。由图2可知,150~240℃的时,反应式(7)的ΔG<0,固态中毒产物为CuO 和C;当温度高于250℃时,该反应ΔG>0,且ΔG随温度的升高而增大,表明升高温度有利于抑制催化剂中毒。此外,在整个催化反应温度范围内,反应式(8)、(13)、(14)的ΔG均小于0,表明该系列反应都能自发向右进行,生成的固态中毒产物有CuO、Cu2O 和C。比较这三个反应的ΔG绝对值可知,反应(14)的ΔG绝对值最大,表明该反应的热力学竞争力最强,最易生成的固体中毒产物为Cu2O。
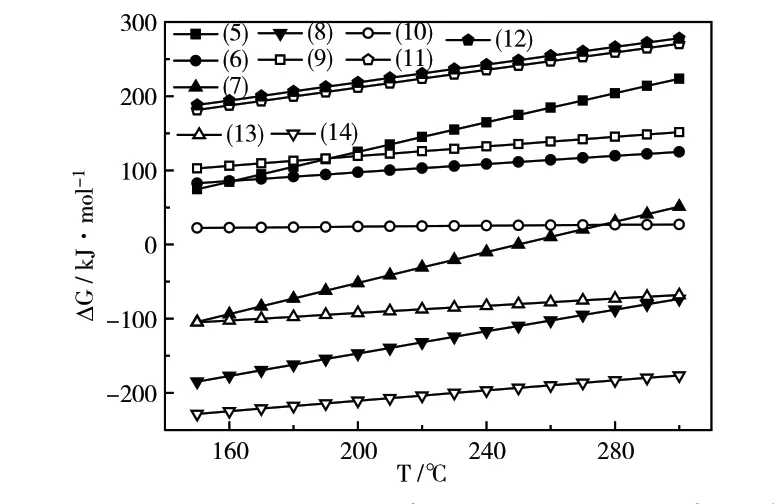
图2 方程式(5)~(14)的吉布斯自由能与温度的关系

2.3 Cu-NH3-H2O体系
Cu、NH3、H2O 共存时可能发生的反应为(15)~(21)。由图3可知,在150~300℃时,下述反应的ΔG均大于0,表明水汽变换原料气中的H2O 与NH3共存时不会引起Cu/ZnO/Al2O3催化剂中毒。

图3 方程式(15)~(21)的吉布斯自由能与温度的关系

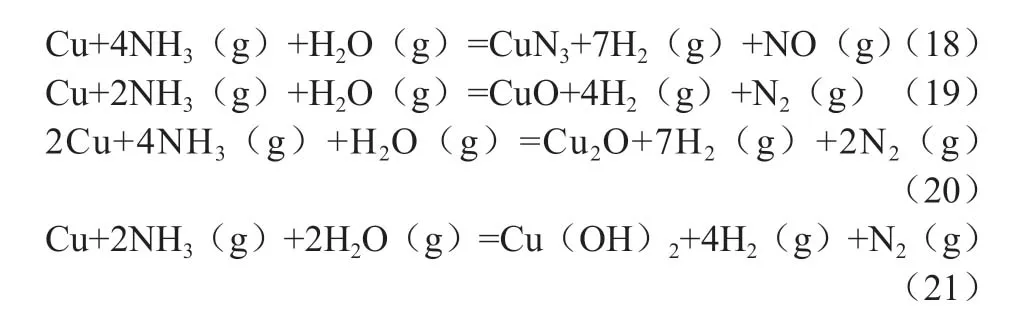
3 结束语
从化学反应热力学角度考虑,水汽变换原料气中存在的NH3能导致变换催化剂中毒。其中,NH3和CO 共存时与催化剂发生的系列自发反应是能引起催化剂中毒的关键,固体中毒产物为CuO、Cu2O 和C。因此,采用工业尾气作为变换原料气时,有必要对杂质气体NH3进行净化脱除。
