锂电池:你手里的诺贝尔奖
2020-05-13张抗抗
张抗抗

2019年10月9日,瑞典皇家科学院宣布,将2019年诺贝尔化学奖授予约翰·巴尼斯特·古迪纳夫(John B. Goodenough)、斯坦利·惠廷厄姆(Stanley Whittingham)和日本的吉野彰(Akira Yoshino),以表彰他们在锂电池发展上做出了杰出贡献。如果没有这些科学家英雄史诗一般的贡献,也许我们现在还生活在一个没有锂电池的世界里。快来听听他们的故事吧!
锂电池诞生的前夜
虽说现在我们把电动汽车归类为新能源汽车的一种,但同学们可能不知道的是,电动汽车的发明其实比内燃机汽车更早,直到1912年还在市场份额上占有优势,但后来由于电池技术进步缓慢,电动汽车逐渐被历史淘汰。
1912年的电动汽车广告
正常来说,一项技术被淘汰后,往往会被其他技术彻底代替,例如液晶电视和显像管电视。电动汽车之所以能够在百年之后重返历史舞台,正是因为锂电池发展史上英雄人物辈出,他们的奇思妙想带来了许多划时代的技术突破。
1859年,法国人普兰特发明了经典的铅酸蓄电池,这是一款非常成功的发明,直到今天还被普遍使用。但是,如果把它用到电动汽车上,就会暴露出巨大的问题:能量密度太低。谁也不想牺牲座舱与后备厢空间来装电池,也不想面临1吨的车加上2吨的电池才能跑500公里的窘境,这不仅不经济,从环保的角度来说也是不可接受的。与铅酸蓄电池相似,镍镉蓄电池、镍氢蓄电池的能量密度也没改善多少。若没有新的高能量密度电池,电动汽车将永无出头之日。
铅酸蓄电池的能量密度为什么低呢?我们知道,电池充放电可以理解为氧化还原反应。化学知识告诉我们:化学性质主要由最外层的电子决定,内层电子都是“光吃饭不干活”;电子很轻倒也没什么,但为了电荷平衡,不干活的内层电子也需要配上很重的质子。
打开元素周期表,容易找到铅(Pb)在第6排,有5层不干活的电子;镍(Ni)在第4排,有3层不干活的电子。这就从原子的角度决定了铅酸蓄电池、镍镉蓄电池、镍氢蓄电池的能量密度潜力都是有限的!为了减少“懒汉”的数量,提高整体效率,我们还是从元素周期表的前2行来找找潜力股:氢氦锂铍硼、碳氮氧氟氖。氧与氟都是氧化剂,排除;氦、氖、氮都是惰性或准惰性气体,排除;碳和氢其实就是石油的主要组成元素,也暂时没有办法做成充电电池,排除。
那么就只剩下锂、铍、硼了,为什么首选锂呢?第一,锂电极电势是全元素周期表中最低的,做成电池后电压最高;若转移同等数量电子(电流相同),对应的功率也最高。第二,锂元素的储量比较高,地壳中锂元素的丰度比铍和硼要高一个数量级。
“告别化学反应”的锂离子电池
充电或放电过程伴随着化学反应,例如铅酸蓄电池在充电时:2PbSO4+2H2O=PbSO2+2H2SO4+Pb,在这个化学反应中,硫酸铅变成了铅单质、硫酸与硫代硫酸铅,意味着化学键的断裂与重组,物质结构发生巨大变化。关于物质结构,大家熟悉的另外一个例子就是不同结构的碳:金刚石、石墨、C60、碳纳米管。(考考你:石墨变成金刚石,是物理反应还是化学反应?)
早期的锂电池负极通常为锂金属,在工作时伴随着化学键的断裂与重组(也就是所谓的“锂转化”),很容易发生“锂枝晶”,这就是导致手机自燃的元凶——锂离子在负极表面富集后堆积形成的类似树枝状的锂枝晶,往往会刺穿整个电池的隔膜(分离正负极的绝缘层),从而引发自燃、爆炸。
在现代的锂离子电池中,锂枝晶现象仅在超快充、过充等极少数异常情形下才发生,而早期的锂电池还不具备相应的保护技术,可以说是相当的危险。因此,锂电池被打入冷宫,行业上下普遍持悲观态度。在这个时间点上,几乎没人会相信,几十年后它又能重返舞台。如果“锂转化”的技术路线困难重重,那我们避开不就可以了吗?说得容易,要知道那时候所有的充电电池,包括铅酸蓄电池、镍镉蓄电池、镍氢蓄电池,可都是基于相同反应原理的。
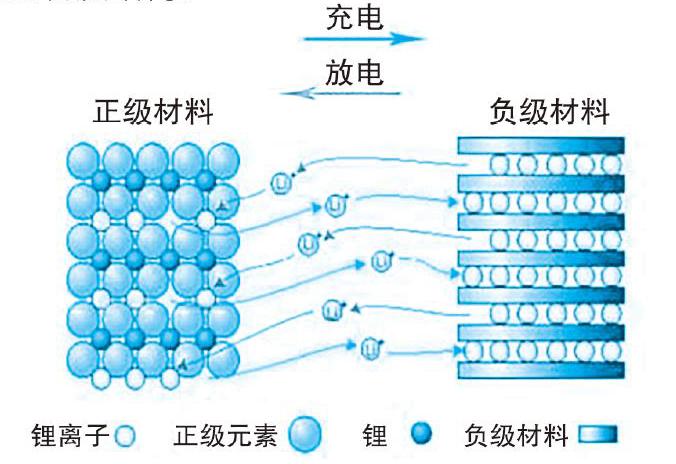
时代在等待一位英雄,于是斯坦利·惠廷厄姆出现了,他指明了除“锂转化”之外的另外一个技术路径:锂嵌入。通俗易懂地讲,就是以特殊的层状材料作为宿主,锂离子(Li+)作为“客人”可以较为随意地嵌入或脱出,基本不影响宿主的物质结构。
正、负极材料均为“好客”的宿主,锂离子可以来去自如
在锂嵌入系统中,锂离子不必再经历痛苦的转化。“告别化学反应”之后,锂离子变得“潇洒飘逸”很多。当然,虽然锂嵌入中锂离子看起来仅发生了物理运动,但本质上依然是化学反应。锂嵌入带来了很多好处,大大提高了充放电反应的可逆性,同时避免了使用锂金属作为负极,提高了安全性。从锂转化到锂嵌入,是锂电池的技术革命。因为这个贡献,惠廷厄姆被称为“锂电之父”,而将负极材料替换为锂嵌入机理的石墨碳的关键人物,正是获得本次诺贝尔奖的吉野彰。
·牛刀小试·
某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-=xLi++C6
C.充电时,若转移1 mol e-,石墨(C6)电极将增重7x g
D.充电时,阳极的电极反应式为LiCoC2-xe-=Li1-x
CoO2+xLi+
解析:电池放电时,负极反应式:LixC6-xe-=xLi++C6,结合电池总反应式可知,正极反应式为:Li1-xCoO2+xLi++xe-=LiCoO2。充电时,石墨电极反应式为xLi++C6+xe-=LixC6,转移1 mol e-,石墨电极将增重7g。由以上分析可知A、B、D项说法正确,C项说法不正确。
另外要提一下的是,锂嵌入在电极电势上占优势,但在能量密度上占劣势。若以锂金属作为负极储存锂离子,那材料利用率肯定很高。正因为如此,基于锂转化的锂金属电池技术路线虽然困难重重,但为了获得更高能量密度的锂电池,现在科学家们还是硬着头皮前仆后继地投入研究。
老骥伏枥,志在千里
惠廷厄姆指明了锂嵌入的技术方向,但距离做出锂离子电池还有很长的距离。锂電池历史上第三位英雄人物出场了,他的名字很特别:约翰·巴尼斯特·古迪纳夫(John B. Goodenough),昵称为“足够好先生”。最让人敬佩的是,“足够好先生”是年过半百才投入锂电池研究的,却以一己之力发现了大部分关键正极材料:层状结构的钴酸锂(LiCoO2)、尖晶石结构的锰酸锂(LiMn2O4)、橄榄石结构的磷酸铁锂(LiFePO4)。
获得诺贝尔奖时,虽然古迪纳夫先生已经年近百岁,但依然奋战在科研一线,希望为下一代锂固态电池做出突破。惠廷厄姆、古迪纳夫和吉野彰的科研贡献,奠定了锂电池大发展的理论与技术基础。需要说明的是,为叙事方便、控制篇幅,本文未严格按时间先后顺序讲述,同时也省略了大量细节与一些做出重大贡献的科学家,这并不代表故意漠视他们的贡献。
结语
今天,我们已经习惯了锂电池带来的便利,我们的智能手机必须有锂电池才能用,诺贝尔奖的成果就藏在我们每个人的手中。锂电池的发展史,是人类不断追求可充电电池理论极限的科技史。电子设备的智能化,导致了其耗电量也在不断增加,现有的锂电池技术已逐渐不能满足我们的需求。随着石墨烯、纳米材料、超级电容等新技术的不断发展,相信在不久的将来,科学家们会找到下一个突破口,让我们的生活再一次彻底改变。
