川崎病患儿合并肠道菌群失调的危险因素分析及防治策略探讨
2020-05-13于露雯吴克义犹登霞刘灵月
于露雯,吴克义,犹登霞,刘灵月,李 泽,王 凯
(杭州市儿童医院 1.新生儿科;2.儿内科;3.消化科,浙江 杭州 310006)
川崎病(Kawasaki disease,KD)是一种好发于6岁以下儿童期(婴幼儿、学龄前儿童)的常见急性自限性血管炎[1-2],也被称为小儿皮肤黏膜淋巴结综合征(mucocutaneous lymphnode syndrome,MCLS)。目前KD发病病因仍未完全定论,临床症状多表现为发热、非化脓性眼结合膜充血、皮疹、淋巴结肿大及四肢手足硬性水肿、脱皮,发病率约为4~265/10万[3]。部分KD患儿并发程度不一的肠道菌群失调现象[4],而肠道菌群与人体健康息息相关,正常的菌群环境具有维持体重和促消化功能,同时能够对抗机体感染和发挥自体免疫作用,在癌症治疗中也具有改善药物反应的功能[5]。本文就儿童患KD合并肠道菌群失调为对象分析其危险因素及探讨有关防治策略,为丰富临床对KD的研究提供参考建议。
1资料与方法
1.1一般资料
回顾性分析杭州市儿童医院2016年3月至2019年7月确诊为KD的患儿。纳入标准:①符合KD临床诊断标准[6-7];②发病正处于急性期阶段;③年龄小于12周岁;④家长经医护人员解答告知后,均签署知情同意书。排除标准:①既往有胃肠道病史,有家族性遗传疾病、自身免疫性疾病及菌血症病;②合并其他如败血症等发热出疹性疾病,由肠道病毒、麻疹病毒、支原体、EB病毒等引起的感染等,由猩红热、过敏性疾病引起的发热感染等;③肝肾类脏器功能异常;④近期(三个月内)服用过益生菌类调整肠道药物;⑤精神状态异常。本研究已经医院伦理委员会审核并通过。最终纳入67例KD患儿,其中男39例(58.21%),女性28例(41.79%);发病年龄3个月~6岁,平均年龄(2.6±1.1)岁,其中<1岁16例(23.88%),1~3岁31例(46.27%),≥3岁20例(29.85%)。
1.2方法
1.2.1资料收集
获取所有67例KD患儿的电子病历并记录临床表现,包括川崎病的临床症状、有无其他并发症及系统感染等。
1.2.2治疗方法
67例患儿确诊为KD后服用阿司匹林(国药准字H10970098)0.5g·kg-1·d-1,退热后逐渐减药剂量为0.3g·kg-1·d-1,按6~8周疗程服用。
1.2.3肠道菌群失调判断
留取KD患儿腹泻后新鲜粪便于无菌器皿内,提取样本中段行粪便涂片检测[6],判断KD患儿是否合并肠道菌群失调[8],具体标准为:①粪便正常活菌数范围在每视野(field of vision,FV)500~5 000集落形成单位(colony formation unit,CFU);②正常粪便杆球比例为3∶1或7∶3;③肠菌检测数值占比中,若革兰阳性杆菌<40%或>50%,革兰阴性杆菌<50%或>60%,革兰阳性球菌<5%或>15%,革兰阴性球菌<3%或>10%,即可诊断为肠道菌群失调;④经细菌培养获得双歧杆菌/大肠杆菌(bifidobacterium/escherichia coli,B/E)值,该结果正常值应>1,反之B/E值越小代表患儿肠道菌群失调程度越严重。
1.3观察指标
记录患儿的一般临床表现,按是否合并肠道菌群失调分为两组,对诱发川崎病患儿合并肠道菌群失调的危险因素进行分析。
1.4统计学方法
采用统计学软件SPSS 17.0对所得数据进行分析,计数资料用例数(n)和百分比(%)表示,组间比较用χ2检验。采用Logistic行回归分析,P<0.05代表差异具有统计学意义。
2结果
2.1合并肠道菌群失调的危险因素分析
本研究结果显示,67例KD患儿中有24例(35.82%)并发肠道菌群失调,所有患儿均出现发热症状,部分患儿发生非化脓性眼结合膜充血、皮疹、颈部淋巴结肿大、四肢手足硬性水肿。其中<3岁的KD患儿合并肠道菌群失调发生率(44.68%)高于≥3岁的患儿(15.00%),差异具有统计学意义(χ2=5.376,P<0.05);诊治前发热时间>14d的合并肠道菌群失调发病率(62.50%)显著高于≤14d的患儿(27.45%),差异具有统计学意义(χ2=6.508,P<0.05),见表1。
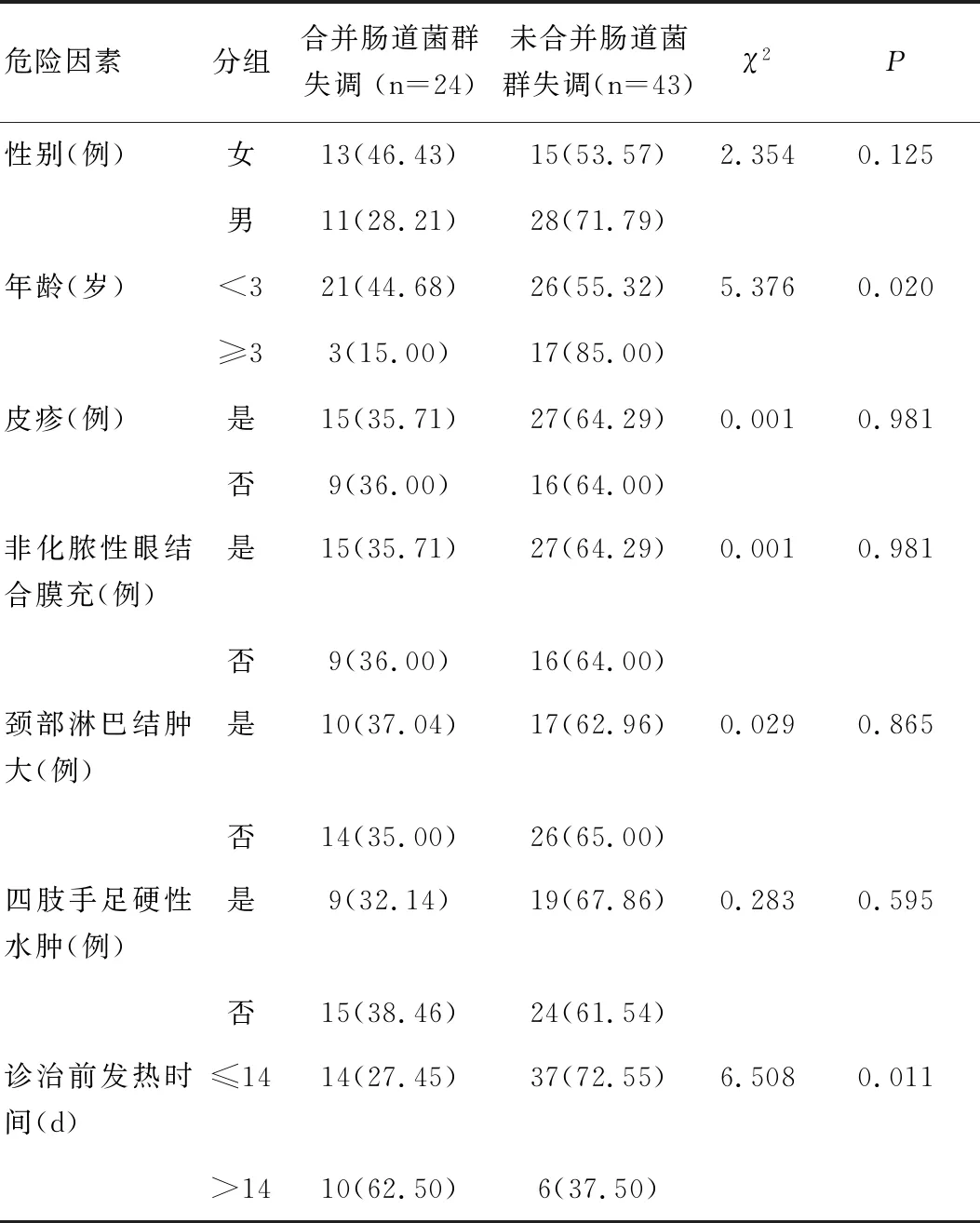
表1 诱发肠道菌群失调的危险因素[n(%)]Table 1 Risk factors of intestinal flora disorder[n(%)]
2.2影响KD患儿合并肠道菌落失调的Logistic回归分析
将年龄(<3岁=1,≥3岁=2)、诊治前发热时间(>14=1,≤14=2)作为自变量,是否合并肠道菌群失调作为因变量(是=1,否=0),进行多因素Logistic回归分析。结果显示,年龄<3岁及诊治前发热>14d是KD患儿并发肠道菌群失调的危险因素,其OR值及95%CI分别为2.979(1.154~4.733)、2.277(1.546~5.569),见表2。
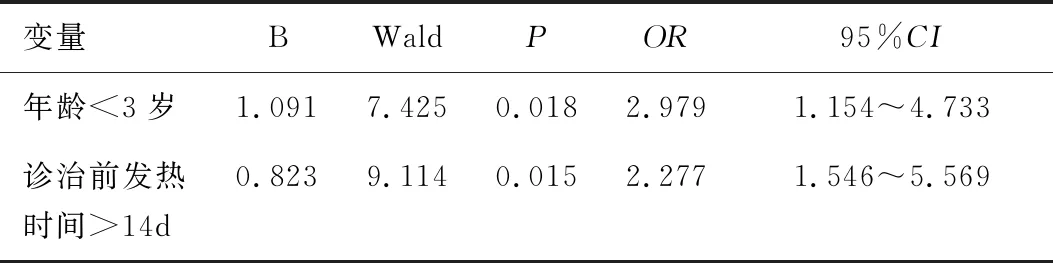
表2 合并肠道菌落失调的危险因素Logistic回归分析Table 2 Logistic regression analysis of risk factors of intestinal colony disorder
3讨论
目前关于KD的病因尚未定论,在临床确诊中常因该病临床症状及相关实验室检查指标均缺乏特征性,因此易导致漏诊、误诊及错失最佳治疗时间,引起诸如冠状动脉病变、心力衰竭等危重并发症,对KD患儿预后康复造成不良影响。有研究表明KD病因与肠源性感染存在不可分割的关系[9-10]。本文对KD合并肠道菌群失调的患儿的危险因素进行分析探讨。
3.1年龄、发热时间对KD合并肠道菌群失调患儿的影响
KD多发于幼龄儿童,何海玲等[11]对58例KD患儿进行分析,其中<3岁发病者占70.7%(41/58);黄小凤等[12]对250例KD患儿进行不同年龄段的临床分析,其中<3岁占79.2%(198/250)。本组67例KD患儿中,<3岁的患儿占70.15%,与上述研究结果相似。临床症状中发热是KD患儿最为常见的发病症状,本研究中67例KD患儿均发热,经服用适当剂量的阿司匹林类解热镇痛药后逐渐缓解症状。而该类药物易引起胃肠道反应等不良症状[13],且发热病程愈长则阿司匹林服用疗程愈久,从而引起肠道感染、肠道菌群失调发生腹泻等症状[14]。本研究提示年龄<3岁及发热时间>14d(延迟治疗)的KD患儿与合并肠道菌群失调的发生有密切联系。导致其更易合并肠道菌群失调的原因可能是:①该年龄段的患儿肠道菌群受炎症影响易发生调节紊乱[15];②KD早期症状不典型,影响诊断准确性,从而耽误治疗,无法有效对抗体内炎症反应;③临床在治疗KD发热时通常使用阿司匹林类解热镇痛药,然而长期、大量服用会引发肠道菌群失调引起腹泻,尤其在后期治疗中腹泻更为严重,抑制了患儿的机体免疫功能,从而阻碍机体康复。
3.2应对策略
KD在第10~18d中为病发高峰期,因此延迟治疗(诊治前发热时间>14d)的KD患儿更易出现肠道菌群失调。一旦对KD患儿确诊,特别是<3岁的患儿应尽早给予治疗,及时控制炎症与其他不良症状等[16-18]。同时临床上应有意关注KD患儿是否并发肠道菌群失调及程度,若肠道的微生态环境被破坏,将严重影响预后效果,如发生腹泻、二次感染等,因此在运用药物治疗KD患儿时可考虑联合应用微生态调节剂对患儿肠道的功能进行保护。
综上所述,KD常见于幼龄儿童,其中<3岁、诊治前发热时间>14d的KD患儿并发肠道菌群失调的风险更高,应重点关注发生此类患儿。同时早期积极诊断治疗对缓解肠道菌群失调或其他并发症的发生至关重要。本研究对于应用KD合并肠道菌群失调患儿的综合评估及防治具有参考意义。
