HPV的定量和分型检测在ASCUS分流诊断中的作用比较
2020-05-13李柱南
孟 瑜,吴 丹,李柱南,许 颖,陈 忆,林 婧
(上海交通大学医学院附属国际和平妇幼保健院宫颈疾病诊疗中心,上海 200030)
宫颈癌是中国女性最常见的癌症之一。根据国家癌症中心2016年公布的数据显示:宫颈癌是我国第二大女性恶性肿瘤。2015年,我国宫颈癌新发及死亡病例数分别为9.89万例及3.05万例[1]。目前,宫颈细胞学检查和高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)的检测被用于筛查宫颈癌前病变和宫颈癌。尽管存在宫颈细胞学检查异常的指南共识,但临床工作中仍存在许多问题。例如意义不明的非典型鳞状细胞 (atypical squamous cells of undetermined significance,ASCUS)的组织病理学检查结果涵盖了从炎症、宫颈上皮内瘤变 (cervical intraepithelial neoplasia,CIN) 到浸润性宫颈癌,临床上如何加强ASCUS患者的管理并给予个体化处理是亟待解决的难题。
ASCUS是宫颈细胞学 (The Bethesda system,TBS) 分类中一种较为含糊的类别,指形态改变较良性反应性改变明显,但在数量和程度上又不足以诊断为鳞状上皮内病变的一组阴道、宫颈的细胞学病理改变。可能与许多因素有关,如急、慢性炎症,霉菌,阴道毛滴虫,HPV等刺激有关,也有一些是修复性细胞、化生性细胞、萎缩性细胞、少数或个别不典型的鳞癌、腺癌细胞等;制片的薄厚(细胞覆盖的量)、染色的深浅度及炎症细胞的多少都会影响到诊断[2]。ASCUS的诊断个体差异性很大,临床上难以做出准确的、可重复性判读。
HR-HPV检测有助于ASCUS的诊断和治疗,现已被推荐为ASCUS分流诊断的主要手段。目前有两种HR-HPV检测技术应用于宫颈癌筛查:HC2定量检测(Qiagen)和Cobas分型检测(Roche),分别于2003年和2011年获得美国食品药品管理局的批准。然而,在中国大部分地区居民收入较低的情况下,限制了使用这些昂贵的检测手段进行大规模的宫颈癌初级筛查。本研究的目的是探索和比较HR-HPV定量和分型检测在ASCUS分流诊断中的价值。
1资料与方法
1.1研究对象
选择2015年1月至2017年12月在上海交通大学医学院附属国际和平妇幼保健院就诊的3 607名通过液基细胞学(liquid-based cytology,LCT)检测结果为ASCUS的病例,同时进行HR-HPV定量或分型检测,随后进行阴道镜检查并做组织病理学活检。作者在收集资料过程中,可获取用于识别所有对象的个体信息。纳入标准是:①有性生活史且非妊娠状态;②LCT检测结果为ASCUS;③HR-HPV与LCT同时检测;④LCT检查后两个月内进行阴道镜检查及组织病理学活检。排除标准为:①我院缺失或未进行LCT、HR-HPV或阴道镜活检的数据;②LCT检查前三天有急性生殖道炎症、性生活、阴道冲洗或阴道用药;③宫颈手术史:如宫颈激光手术、宫颈锥切术、全子宫切除术、放疗或化疗;④其他生殖器肿瘤;⑤不完整的临床数据。
对所有受试者进行病理学检查结果随访,收集年龄、绝经状态、孕次、产次、HPV检测结果和组织病理学活检结果并进行统计学分析。本研究经过上海交通大学医学院附属国际和平妇幼保健医院伦理委员会批准(批准编号:GKLW2015-28)。所有受试者均同意参加并签署了知情同意书。
1.2 研究方法
1.2.1液基细胞学检测
使用Auto Cyto Prep自动芯片染色机(Tri Path,City,ST,USA)处理LCT细胞学。 细胞学合格的妇科医生根据国际癌症协会的Bethesda系统(TBS;2001)的细胞学诊断标准进行诊断。
1.2.2 HR-HPV检测
对所有在2015年12月及之前的受试者,HR-HPV的检测是使用DML2000基因杂交信号放大系统第二代混合辅助技术(HC2),使用HC2-HPV检测试剂盒(Digene,City,ST,USA)进行定量检测13种类型的HR-HPV (包括-16、-18、-31、-33、-35、-39、-45、-51、-52、-56、-58、-59和-68)。HR-HPV DNA≥1.00pg/mL被认为是阳性,结果为定量检测,但不分型。
2016年1月及之后的受试者,HR-HPV使用Cobas 4800检测系统和试剂(Roche,Basel,Switzerland),通过聚合酶链反应进行基因分型可检测出14种HR-HPV(包括HPV-16、-18、-31、-33、-35、-39、-45、-51、-52、-56、-58、-59、-66和-68),并将HR-HPV分类为HPV-16、HPV-18或其他12种类型之一。含有一种或多种类型的阳性被认为是HR-HPV阳性(HPV-16和-18分别为300和600拷贝/mL),但不测定HR-HPV定量。
1.2.3阴道镜检查和组织活检
由经验丰富的阴道镜专家进行阴道镜检查、宫颈活检和子宫颈管内膜刮取术(endocervical curettage ,ECC)。用棉签在患者宫颈表面处将其分泌物擦拭干净,然后对患者的宫颈鳞柱交界处进行检查,取3.00%的醋酸溶液抹在患者宫颈表面处维持1分钟后再观察,最后实施碘溶液试验工作,确定病变范围并取多点活检,进行图像评估,做出诊断。如果阴道镜检查成像不满意,则进行ECC。所有标本均送病理组织学检查,病理诊断结果包括宫颈炎、CIN1、CIN2、CIN3、鳞癌及腺癌。CIN2及以上病变的病理学诊断定义为CIN2+。
1.3统计学方法
本研究数据采用SPSS 21.0(IBM Corp,Armonk,NY,USA)进行统计学分析。定量资料先行正态性检验,符合正态分布的定量数据用均值±标准差表示,使用两独立样本t检验进行比较;非正态分布数据用中位数(范围)表示,并使用Mann-WhitneyU检验进行比较。定性数据用百分比表示并使用卡方检验进行比较。先行单因素分析,将有统计学意义的因素作为多因素分析的因变量进行Logistic回归。以P<0.05为差异有统计学意义。
2结果
2.1病例特征
3 607例ASCUS病例的平均年龄为40.73±11.65岁(17~81岁)。其中27.47%(991/3 607)进行HR-HPV定量检测,72.53%(2 616/3 607)进行HR-HPV分型检测。在阴道镜检查中,79.60%(2 871/3 607)的病理组织学诊断为正常,20.27%(731/3 607)存在CIN,其中16.14%(582/3 607)病例诊断为CIN1和4.13% (149/3 607)病例为 CIN2及以上病变,0.14%(5例)病例被诊断为宫颈癌。
2.2 HR-HPV感染和宫颈病变按年龄分组比较
所有受试者的HR-HPV检测结果和宫颈活检病理学诊断结果按年龄分组的统计结果如表1所示。根据组织病理学诊断结果将患者分为两组:正常/ CIN1和CIN2+/宫颈癌。30岁以下人群中HR-HPV感染阳性率和CIN2及以上病变的发生率最高, 随着年龄的增长而下降,见表1。
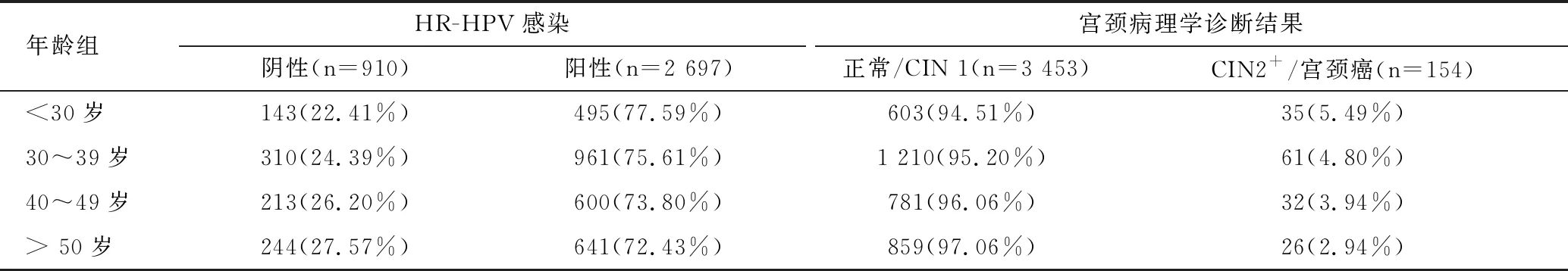
表1 按年龄对HR-HPV感染和宫颈病变的比较[n(%)] Table 1 Comparison of HR-HPV infection and pathological results among different age groups [n(%)]
2.3与ASCUS分流诊断相关的单因素分析
单因素分析显示两组的年龄,绝经状态和HR-HPV感染情况存在显著差异(P<0.05),提示年轻,绝经前状态和HR-HPV感染的ASCUS患者更易发生CIN2及以上病变,见表2。
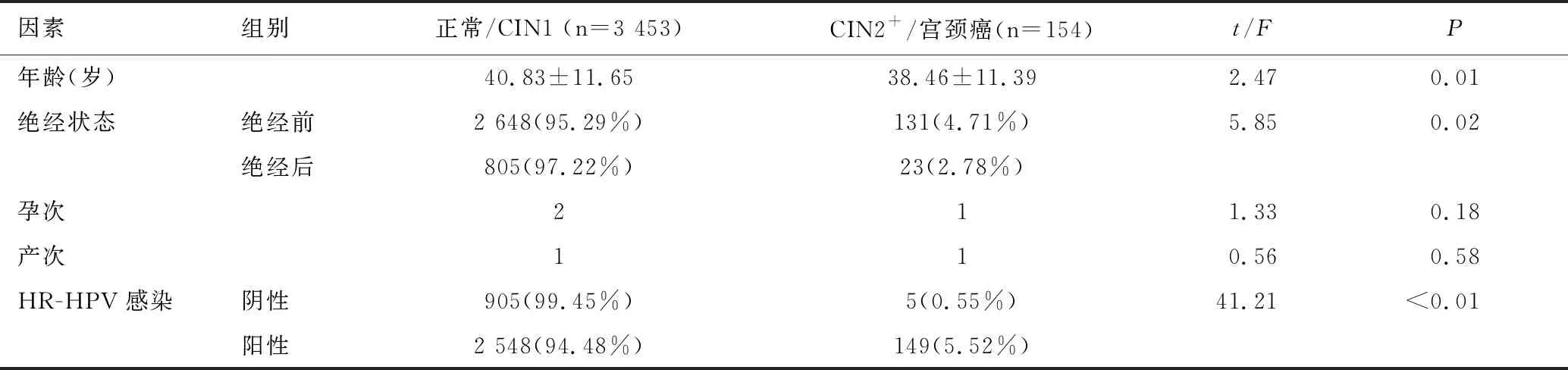
表2 年龄、绝经状态和HR-HPV感染与ASCUS分流诊断之间的关系Table 2 Relationships of age,menopausal status and HR-HPV infection with ASCUS triage diagnosis by univariate analysis
2.4 ASCUS分流诊断中HR-HPV定量和分型检测的价值比较
基于HR-HPV定量检测而言,HR-HPV病毒载量在宫颈高级别和低级别病变的患者之间没有显著差异(t=0.88,P=0.38);基于HR-HPV分型检测而言,HPV-16或-18型阳性的患者相比其他12种HPV阳性患者,更易发生CIN2及以上病变(χ2分别为133.24,7.60,2.52,P均<0.05),表明HR-HPV分型检测对ASCUS的分流诊断具有价值,见表3。
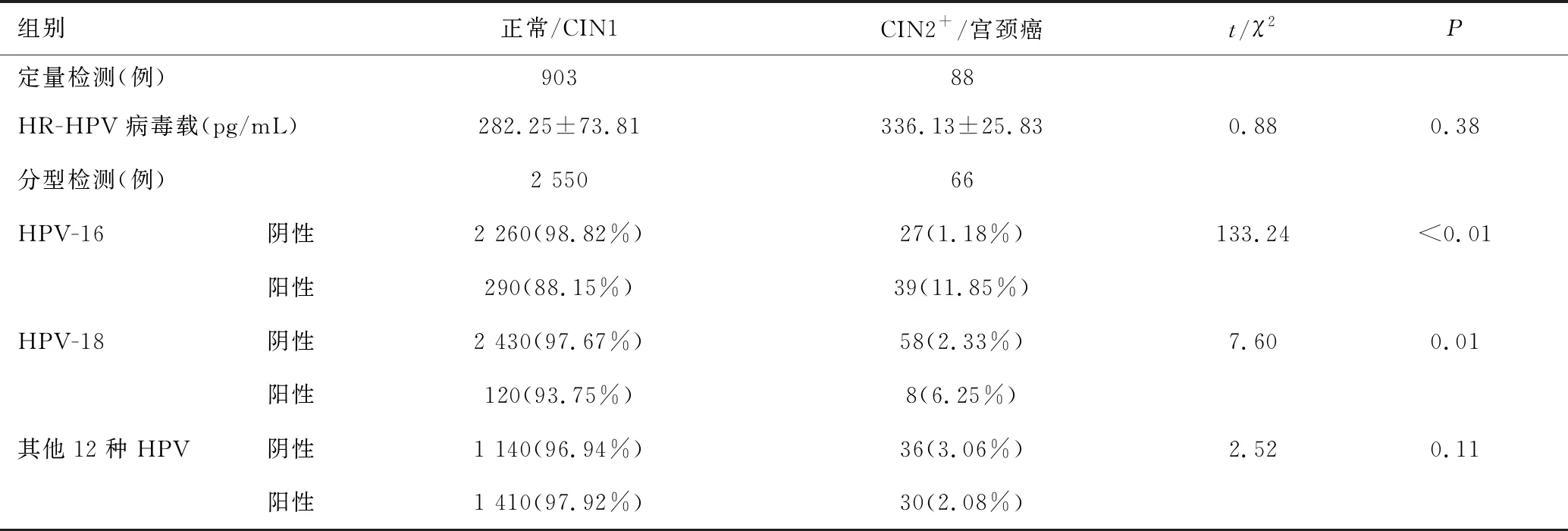
表3 HR-HPV定量和分型检测在ASCUS分流诊断中的价值比较Table 3 Values of HR-HPV quantification and genotyping in triage diagnosis of ASCUS
2.5与ASCUS分流诊断相关因素的多因素分析
将单因素分析中有统计学意义的指标,即绝经状态、年龄、HR-HPV感染、HPV-16和HPV-18型阳性纳入多因素logistic回归模型中。结果显示只有HR-HPV感染、HPV-16阳性和HPV-18阳性是CIN2及以上病变的独立危险因素(95%CI:1.25~14.12,P=0.02;95%CI:4.88~14.04,P<0.01;95%CI:1.06~5.28,P=0.04)。这些结果表明HR-HPV分型检测才是具有价值的ASCUS分流手段,见表4。
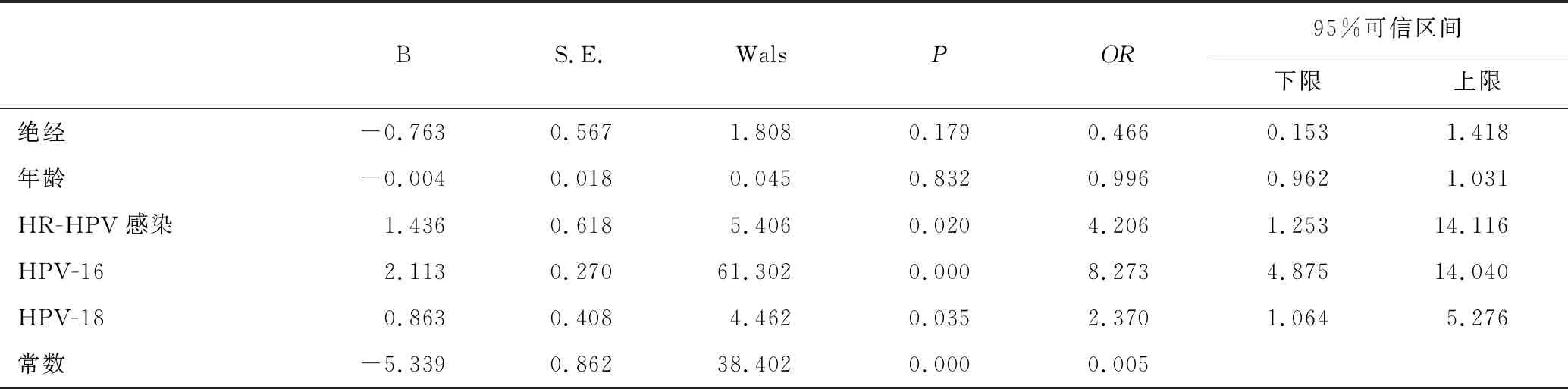
表4 与ASCUS分流诊断相关的多因素Logistic回归分析Table 4 Factors associated with triage diagnosis of ASCUS by multifactorial logistic regression analysis
3讨论
3.1 ASCUS分流诊断的意义
目前宫颈细胞学检查仍占宫颈癌筛查的主导地位,但在中国,由于病理医生尤其是细胞学医师的诊断水平参差不齐,细胞学结果并未被视为最重要的诊断依据。临床上当细胞学检查提示为ASCUS时,可能是宫颈细胞增生活跃的良性改变,也可能是潜在的恶性病变,临床医师难以对其进行明确分类。本研究的目的是评估HR-HPV检测用于ASCUS合并CIN2及以上宫颈病变的诊断价值,以便提供及时和适宜的治疗。2001年在美国启动了 ALTS (ASCUS-LSIL Traige Study) 即 ASCUS 及LSIL分流研究推荐了三种常用分流方法:①6个月后重复子宫颈细胞学检查,再次为ASCUS的患者推荐行阴道镜检查;②进行HR-HPV检测,结果阳性的患者推荐行阴道镜检查;③直接行阴道镜检查。研究发现单次的HR-HPV检测可发现和诊断92.40%的CIN3患者,与直接行阴道镜检查具有相同的敏感性,但仅使一半的患者接受阴道镜检查[3]。最新的研究分析了2011年至2015年间我国ASCUS患者的HR-HPV检测和组织学随访情况,ASCUS的发生率为3.77%(83 199/2 206 588例),ASCUS患者中HR-HPV阳性率为34.98%(6 498/18 574例),ASCUS合并HPV阳性的妇女CIN2及以上的检出率为13.98%,明显高于HPV阴性的妇女(2.84%)[4]。宫颈鳞癌的检出率为3.95%。
本研究中3 607例ASCUS患者的阴道镜活检病理学结果显示:79.60%的病例未见异常,20.27%是CIN或宫颈癌(其中CIN 1占16.14%,CIN2及以上病变占4.13%;宫颈癌占0.14%)。这些数据表明当宫颈细胞学检查提示为ASCUS的患者需要进一步评估:若只进行常规观察随访会遗漏部分宫颈高级别病变甚至宫颈癌;若对所有ASCUS患者进行阴道镜检查又会大大增加医生工作量及患者的经济负担和精神压力。研究发现阴道镜检查能会增加患者的焦虑情绪并对其未来的生育能力和生活质量产生不利影响[4]。因此,综合考虑个体化的ASCUS分流诊断策略对早期发现宫颈病变至关重要。最佳分流策略必须确定可能发展为宫颈浸润癌的癌前病变,同时避免过度检测和不必要的短暂HPV感染治疗。
3.2 ASCUS分流诊断中的年龄因素
研究显示2011年至2015年间在接受ASCUS(Papanicolaou)Pap检测联合HPV检测的18 574名女性中,HR-HPV阳性率为34.98%(6 498/18 574例),其中30岁以下女性的感染率最高[5]。性活跃的年轻女性可能有更多机会造成子宫颈上皮的损伤,如果有多个性伴侣,则容易发生多种HPV感染。随着年龄的增长,获得性免疫力增加,HPV暴露风险普遍降低,感染率随之降低。这些观察结果解释了在本研究中3 607例ASCUS患者中CIN2及以上病变在30岁以下患者中发生率最高,而随着年龄的增长发生率则呈下降趋势。
3.3 HR-HPV感染在ASCUS分流诊断中的价值
持续的HR-HPV感染是发生CIN与宫颈癌的生物学病因,也是与宫颈病变进展相关的主要因素。有效的HR-HPV定量或分型检测可能在宫颈癌的预防和治疗中发挥重要作用。HPV采用HC2(Qiagen)或Cobas(Roche)检测具有相似的准确性和良好的一致性[6],因此两者均可用于评估临床中的HR-HPV感染。由于其高灵敏度和阴性预测值,HR-HPV的检测一直以来被认为是ASCUS分流管理的理想方法。
有研究分析ASCUS患者在6个月内的组织学结果,其中CIN2及以上病变的检出率为7.87%(473/6 012例),ASCUS合并HPV阳性的妇女中CIN2及以上病变的检出率为13.98%,明显高于HPV阴性的妇女(2.84%)[5]。本研究发现HR-HPV阳性的ASCUS患者中CIN2及以上病变的检出率为5.52%,HR-HPV阴性的ASCUS患者中CIN2及以上病变的检出率为0.55%,表明HR-HPV阳性与ASCUS中CIN2及以上病变的风险显著相关,进一步表明ASCUS分流诊断中HR-HPV检测具有比重复细胞学更高的敏感性。
因此,我们认为HR-HPV检测有助于ASCUS的分流诊断,HR-HPV阳性患者需要进行阴道镜检查。HR-HPV阴性的患者可以减少阴道镜检查的数量,减少随访工作压力,并且可以相对安全地延长临床筛查的间隔时间。
3.4 ASCUS分流诊断中HR-HPV定量和分型检测的价值比较
目前已经检测到超过100种类型的HPV,按照 HPV与宫颈癌的关系,将HPV基因型分为高危型、中间型和低危型,其中15种为高危型(16、18、31、33、35、39、45、 51、52、56、58、59、68、73和82)。研究发现上海地区女性宫颈HPV总感染率为33.6%,高危型 HPV感染中居前六位的依次是HPV-16、52、58、53、33、18;低危型HPV感染中居前三位的依次是HPV-81、11、6。有病理组织学结果的宫颈病变组HPV总感染率为41.9%,其中宫颈低级别病变组HR-HPV感染中居前五位的依次是HPV-16、58、52、18、33;宫颈高级别病变组HR-HPV感染中居前五位的依次是HPV-16、58、33、18、52[7]。因此,HR-HPV分型检测在宫颈癌筛查中至关重要。
目前HR-HPV检测已被推荐为ASCUS分流诊断的主要手段,但其特异性仍有待加强。我们发现相比于HR-HPV定量检测,HR-HPV分型检测在ASCUS分流诊断中更具优势。 HPV-16和-18阳性是宫颈高级别病变的独立危险因素。因此,HPV-16和HPV-18阳性患者应进行阴道镜检查和组织病理学活检以免漏诊,且需要密切的临床随访。总之,HR-HPV分型检测可以实现高质量的ASCUS分流诊断,并可为建立ASCUS分流管理策略提供可靠的依据。
3.5本研究的局限性
因宫颈癌的发展不仅与持续的HR-HPV感染有关,还与年龄、吸烟、性伴侣数量、自身免疫力下降(如HIV感染)和使用长期口服避孕药有关。 因此,仅凭HR-HPV检测来预测宫颈癌的发展可能缺乏客观性和特异性,需要加入以上干扰因素进行模型调整,期待日后有多中心、大样本的前瞻性临床研究来建立更有效的ASCUS分流方案。
综上所述,优化宫颈癌筛查的目的是为了提高效率、避免误诊、减少过度诊断和治疗,并降低宫颈癌的发病率。我们建议ASCUS的分流诊断应该是个体化的,细胞学家不应该将ASCUS视为模糊诊断,临床医生应该仔细评估ASCUS,并尽快做出明确的诊断,以免误诊及延误治疗。HR-HPV分型检测有助于ASCUS的分流诊断,有助于宫颈高级别病变的早期筛查。鉴于HPV-16或-18感染的宫颈病变进展风险较高,可将HPV-16或-18阳性视为ASCUS患者分流的特异性标记,而非HPV的定量检测。HPV-16 或-18 阳性的患者建议进一步行阴道镜检查,其他HR-HPV阳性的患者可以选择定期随访,当然,临床上应灵活应用筛查手段,对于那些具有宫颈癌高危因素和随访困难的患者,仍可直接使用阴道镜检查和组织病理学活检来确诊。
