腺样囊性癌TrkC差异表达的PDX模型的建立与鉴定*
2020-05-13马廷耀王雪莲陈晓红许春萍武骏江凌燕许洪波周晶宋晓明李文伟
马廷耀,王雪莲,陈晓红,许春萍,武骏,江凌燕,许洪波,周晶,宋晓明,李文伟
100730 北京,首都医科大学附属北京同仁医院 耳鼻咽喉头颈外科 (马廷耀、王雪莲、陈晓红、武骏、江凌燕、许洪波、周晶);100716 北京,亦康(北京)医药科技有限公司(许春萍、宋晓明、李文伟)
腺样囊性癌(adenoid cystic carcinoma,ACC)是源于分泌腺的一种罕见肿瘤,最常发生在头颈部的小唾液腺,占所有唾液腺恶性肿瘤的约10%~22%[1-2]。这类疾病的临床特点为初期生长缓慢、周围神经侵袭性、晚期局部隐匿性扩散与多发远处转移,其中以肺部转移最为多见;患者在5年后生存率急剧下降,10年的生存率较低(37%~57%)[3]。
目前,该病的主要治疗方式仍是原发部位的手术治疗,术后予以辅助放疗。但ACC的嗜神经侵袭(perineural invasion,PNI)特性易导致手术切缘阳性,增加远处转移风险。而对于远处转移,尚没有确切疗效的细胞毒性药物及针对性的靶向药物。因此嗜神经性是ACC预后不良的关键因素,也是药物研发的重要突破点。有研究表明,神经营养因子3(neurotrophic factor,NT-3)及其特异性受体原肌球蛋白受体激酶C(trypomyosin-receptor C,TrkC)在涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)中, 通过调节SACC细胞与施万细胞(Schwann cells,SC)的相互作用,促进了PNI和SACC患者的预后不良。通过阻断NT-3 / TrkC轴来中断SACC细胞与SC的相互作用可能是SACC患者中抗PNI治疗的有效策略[4]。
针对ACC的有效药物研发,需建立ACC的研究工具。目前,国内有ACC的细胞系两株,分别是SACC-83、SACC-LM,但这些细胞系已经构建有近30年,脱离人体培养时间过长,丢失较多人体内生物学特性。人源肿瘤异种移植模型(patient-derived tumor xenograft,PDX)是将新鲜肿瘤组织切成组织小块直接移植至免疫缺陷小鼠体内,从而很好地保持了肿瘤的异质性。由于没有经过任何人工培养,其生物学特性保持地更为完整,从而与临床相似度更高,是目前研究最合适的肿瘤动物模型。有鉴于此,我们尝试从北京同仁医院头颈外科收集新鲜的ACC肿瘤组织,藉此构建有TrkC表达差异的PDX模型研究,现报告如下。
1 资料和方法
1.1 新鲜肿瘤组织采集
1.1.1 组织收集来源 本次研究共收集了10例患者肿瘤组织进行了PDX实验。10例患者的肿瘤组织均经我院病理科确诊为ACC组织。其中成功5例,3例完成了鉴定。在完成鉴定的3例患者中,一例(ACC001)肿瘤组织来源于头皮转移灶,病理类型为实性型;一例(ACC004)来源于右侧上颌窦,病理类型为筛状型;一例(ACC008)来肿瘤组织源于左侧上颌窦,病理类型为高级别转化型。另外两例的PDX肿瘤组织尚在鉴定中,一例(ACC009)来源于左侧鼻腔,病理类型为混合型;另一例(ACC011)来源于会厌喉面,病理类型为实性型。本次研究获得首都医科大学附属北京同仁医院伦理委员会审批立项(编号:2016-09-13)。
1.1.2 主要器具 无菌操作器械:眼科剪、眼科镊子、手术剪、手术钳、手术刀、无菌培养皿(直径90 mm)、无菌手套、手术衣、口罩、帽子、无菌隔离服。其他配套器械:3 L保温壶、冰袋、标本管(50 mL BD离心管)、冰箱。
1.1.3 试剂 青霉素(0.48g/瓶,80万IU),链霉素(1g/瓶,100万IU),改良型RPMI-1640培养基,D-Hanks溶液。
1.1.4 组织保存液的配制 使用含100IU/mL青霉素和100μg/mL链霉素的1640培养基,调整pH值为7.4,0.22 μm膜抽滤灭菌,分装到标本管中4℃保存备用。
1.1.5 标本采集 手术摘取新鲜肿瘤组织由主刀医生进行。医师选取质量较好的瘤组织,避开溃疡坏死部位,切取瘤块体积约为0.5cm × 0.5cm × 1cm左右大小,尽量保证足够多的肿瘤组织。尤其注意的是要在手术台无菌条件下切剪取瘤组织,保持肿瘤组织标本无菌。将取下的肿瘤组织块放入盛有保存液的标本管中,加盖后塑料薄膜(封口膜)密封保存。将装有新鲜肿瘤标本试管放入装有冰袋的保温壶,送交肿瘤实验室。整个运送过程在6小时内完成。
1.2 建立人ACC PDX皮下移植瘤模型
1.2.1 实验动物 NCG小鼠, 江苏集萃药康生物科技有限公司。
1.2.2 实验动物屏障系统 1)笼具(规格:370mm × 180mm × 157mm):名称:独立送风隔离笼具;型号:独立通风系统(independent ventilation system,IVC),VNP72G3-2型;购自苏州市苏杭科技器材有限公司;2)饲养环境:无特定病原体屏障环境中,IVC饲养:恒定温度(22℃~26℃)和湿度(40%~70%)。
1.2.3 主要设备及器具 包括YT-CJ-2ND+型超净工作台、套管针(棱牌注射穿刺针)、眼科剪、眼科镊、康宁一次性使用培养皿、YDS-175-216型液氮生物容器、冻存管、速冻管、游标卡尺。
1.2.4 动物饲养及使用 1)每只笼具的标记内容;2)采用打耳洞法动物标记;3)动物无菌饲养尾箱,工作照明12小时,动物照明12小时;4)观察动物活动指标。
1.2.5 肿瘤原代接种方法 开启超净工作台,将改良型RPMI-1640培养基分别倒入3个培养皿中,从保温壶中取出标本管,用眼科镊将其中的肿瘤组织放到一只培养皿中清洗,清洗后放入第二个培养皿,持眼科剪与眼科镊,对肿瘤组织进行修剪,剪除脂肪、纤维及坏死组织,将组织块放到另一只培养皿中,然后将其修剪成约2mm×2mm×2mm。每个套管穿刺针芯内放入1~2个瘤块,注入酒精消毒后的动物背部皮下进行原代接种。每只动物共接种四个点,分别是左、右前肢肩胛骨皮下脂肪垫处,与之对应的左、右靠臀部皮下处。
1.2.6 肿瘤传代接种 颈椎脱位方法处死第一代(标记为P0)接种的动物,酒精消毒皮肤。使用眼科剪剪开瘤体处皮肤,眼科镊分离瘤体与皮肤,边分离边剪开皮肤,直至将整个瘤体分离并放入盛有1640培养基的培养皿中。使用眼科剪与眼科镊修剪瘤体,剪除脂肪、纤维及坏死组织,选取鱼肉样长势旺盛的瘤组织块做转接。移至另一盛有1640培养基的培养皿中,将瘤块修剪成2mm×2mm×2mm大小,转接方法和转接部位与肿瘤原代接种方法相同。将第一代(P0)小鼠皮下肿瘤组织转接到第二代(P1)3只小鼠皮下。余下瘤块分别用于作病理、速冻和冻存。按上述方法,将第二代(P1)肿瘤一直转接到第四代(P5)供长期保存。从第三代(P4)开始测量小鼠体重和肿瘤体积。用游标卡尺测量小鼠活体肿瘤的长径a和短径b,按照公式V=1/2a×b2计算活体肿瘤的体积,绘制出生长曲线图。
1.3 免疫组化染色方式
1.3.1 标本处理 标本经10%中性甲醛固定,常规石蜡包埋,制备5 μm厚度空白切片(10张/标本),苏木精—伊红(hematoxylin-eosin,HE)染色证实为ACC。
1.3.2 主要试剂 TrkC兔抗人单克隆抗体(克隆系)购自Cell Signaling Technology 公司,免疫组化二抗试剂盒购自北京中杉金桥生物技术有限公司。
1.3.3 检测方法及结果判读 采用免疫组化染色PV二步法试剂盒检测ACC切片组织中TrkC表达,操作步骤严格按照试剂盒说明书进行,以已知ACC组织为阳性对照,以兔源IgG 单克隆抗体替代一抗做阴性对照。Leica光学显微镜下观察检测结果,阳性信号为棕色,TrkC定位于细胞膜。
2 结 果
2.1 患者临床资料
5例完成PDX建立的患者中,初发病例3例,占60%(3/5),复发病例2例,占40%(2/5)。5例患者的临床信息汇总如下(表1)。一例患者肿瘤原发部位为左侧颞下窝,病理类型为实性型,治疗方式为手术切除后行根治性放疗,33个月后复发,52个月发生全身转移;一例患者肿瘤原发部位为右侧上颌窦,病理类型为筛状型,治疗方式为手术切除,取材组织来源于原发灶;一例患者为男性,年龄66岁,肿瘤原发部位为左侧上颌窦,病理类型为高级别转化型,治疗方式为手术切除,19个月后复发,二次手术切除后行根治性放疗,取材组织来源于鼻咽部复发灶;一例患者为男性,年龄67岁,肿瘤原发部位为左侧鼻腔,病理类型为混合型,治疗方式为手术切除后行根治性放疗,取材组织来源于左侧鼻腔;一例患者为男性,年龄58岁,肿瘤原发部位为会厌喉面,病理类型为实性型,治疗方式为手术切除后行根治性放疗,取材组织来源于喉肿物。5例患者的病理信息汇总如下(表2)。
2.2 ACC PDX模型建立
一共接种10例,确定生长的模型有5例:其中1例处于P4代(ACC001),1例处于P3代(ACC004),1例处于P1代(ACC008),2例处于P0代(ACC009与ACC011);确定建模失败的有5例。总体而言,建模成功率为50%。
2.3 PDX病理分析
在裸鼠体内成功荷瘤后,我们对比了成瘤前、后的HE染色和免疫组化检查,观察标本荷瘤前后的组织类型变化,结果显示病理特点和肿瘤形态基本一致(图1)。ACC001病人中可见实性型ACC,肿瘤细胞为基底样,胞质少,呈实性巢团状在纤维间质内浸润性生长,纤维间质黏液样变性,而ACC001 PDX中,肿瘤细胞为基底样,胞质少,大部分呈实性巢团状生长方式,形态同ACC001病人;ACC004病人及PDX:筛状型ACC,如图所示肿瘤大部分呈筛状生长方式,此型以微囊腔隙的肿瘤细胞巢为其形态学特点,本例局部可见鳞状上皮化生;ACC008 PDX:图片显示高级别转化区域:肿瘤细胞核多形性、泡状核、核仁明显,核分裂像多见,与ACC008病人基本符合。
表1 5例PDX患者临床信息
Table 1. Clinical Information of 5 PDX Patients
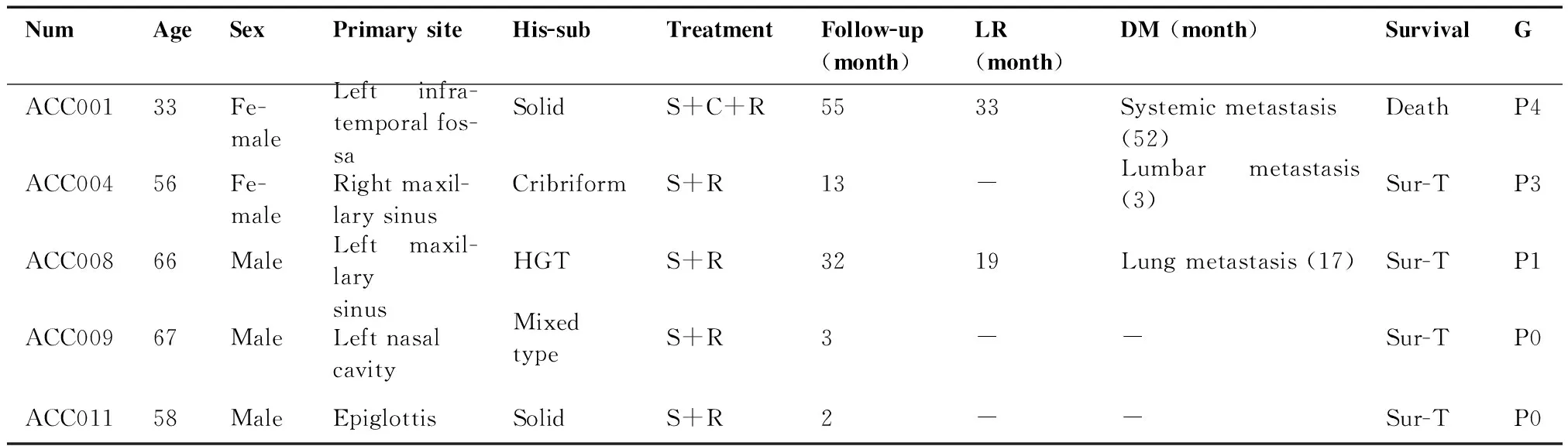
NumAgeSexPrimary siteHis-subTreatmentFollow-up (month)LR (month)DM (month)SurvivalGACC00133Fe-maleLeft infra-temporal fos-saSolidS+C+R5533Systemic metastasis (52)DeathP4ACC00456Fe-maleRight maxil-lary sinusCribriformS+R13-Lumbar metastasis (3)Sur-TP3ACC00866MaleLeft maxil-lary sinusHGTS+R3219Lung metastasis (17)Sur-TP1ACC00967MaleLeft nasal cavityMixed typeS+R3--Sur-TP0ACC01158MaleEpiglottisSolidS+R2--Sur-TP0
PDX=patient-derived tumor xenograft; Num=number; His-sub=histological subtype; LR=local recurrence; DM=distant metastasis; G=generation; S+C+R=surgery+chemotherapy+radiotherapy; S+R=surgery+radiotherapy; Sur-T=survival with tumor; HGT=high grade transformation.
表2 5例PDX患者病理信息
Table 2. Pathological Information of 5 PDX Patients
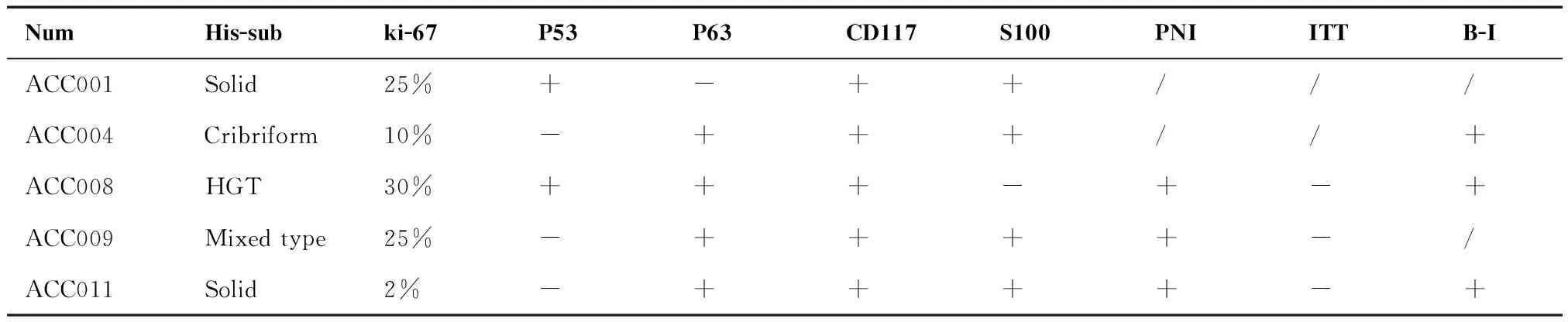
NumHis-subki-67P53P63CD117S100PNIITTB-IACC001Solid25%+-++///ACC004Cribriform10%-+++//+ACC008HGT30%+++-+-+ACC009Mixed type25%-++++-/ACC011Solid2%-++++-+
PDX=patient-derived tumor xenograft; Num=number; His-sub=histological subtype; PNI=perineural invasion; ITT=intravascular tumor thrombus; B-I=bone invasion; HGT=high grade transformation.
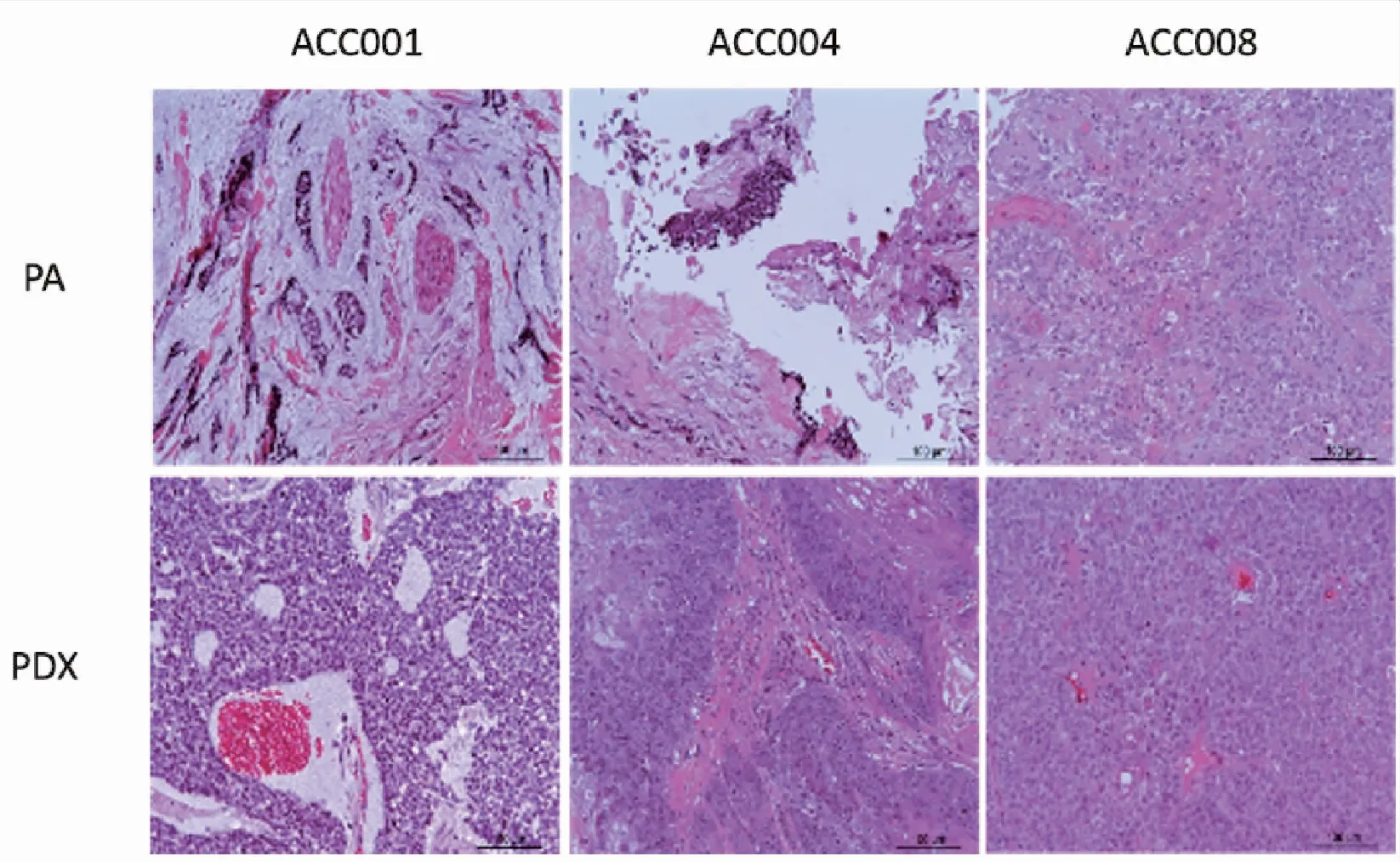
图1 患者及PDX肿瘤组织病理形态对照(20×10)
Figure 1. Histopathology of Tumors in PA and PDX (20×10)
Most of the tumor tissue of patients (acc001 and acc004) were used for inoculation, and only a few were fixed, so there were few tumor cells. The pathological characteristics and morphology of an xenograft tumor was consistent with those of a patient’s tissue. PA: Patient; PDX: Patient-derived tumor xenograft.
2.4 TrkC的免疫组化及PDX肿瘤生长曲线
TrkC在ACC004 PDX模型肿瘤组织中不表达,在ACC001和ACC008 PDX模型肿瘤组织中呈现强阳性表达,其阳性率接近百分之百(图2)。根据前文中所述实验方法,计算活体肿瘤体积,绘制出生长曲线图(图3)。因ACC008为P1代,暂不到量瘤的代数,P3以后才看肿瘤生长状态量,图中仅描述了ACC001与ACC004的情况。可看出肿瘤生长速度较快,且呈前期缓慢,后期加快的趋势。ACC001生长速度明显快于ACC004。
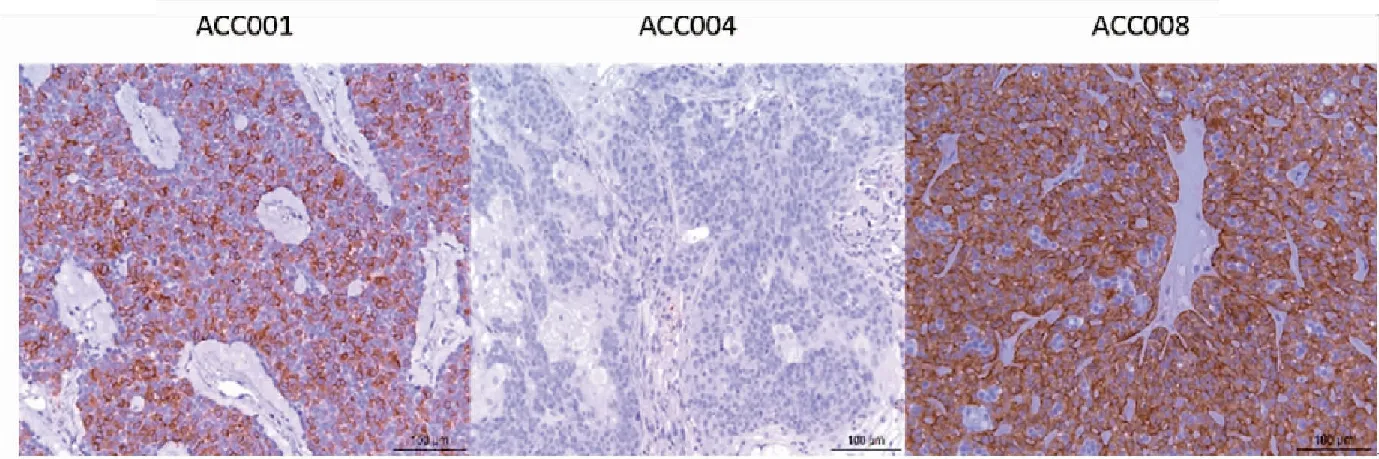
图2 3例PDX中TrkC的免疫组化结果 (20 X 10)
Figure 2. Immunohistochemical Results of TrkC in 3 Cases of PDX (20×10)
ACC004: Negative; ACC001: Positive; ACC008: Strong positive.
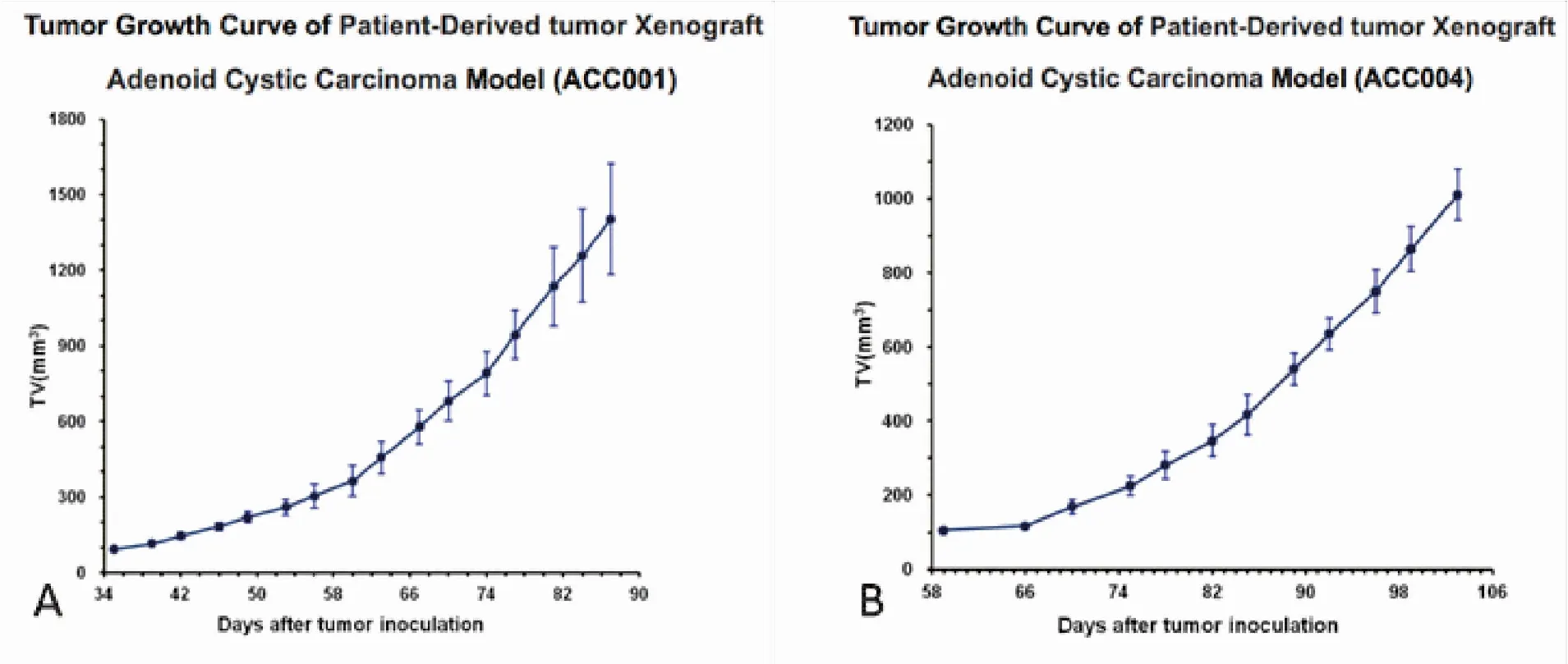
图3 PDX肿瘤生长曲线
Figure 3. Tumor Growth Curve of Patient-Derived Tumor Xenograft
3 讨 论
ACC是一种原发于腺体的恶性肿瘤,也是头颈部唾液腺肿瘤中最常见的恶性肿瘤之一。ACC最显著的临床特征是局部复发率和远处转移率较高,PNI的发生率可高达48%[5]。据报道,患者的5年生存率为80.8%,局部复发率为40%,淋巴结转移率为3.8%,远处转移率为28.5%[6]。影响患者预后的主要因素是局部复发和远处转移,特别是肺部转移。由于ACC对普通的细胞毒化疗药物不敏感,故目前对该病的肺部转移尚没有特别有效的化疗药物治疗。另外,靶向治疗也没有显示出稳定的临床疗效,免疫治疗也因为这类肿瘤的突变负荷低而没有显示出明显的临床应答反应。因此,筛选有效药物控制肿瘤远处转移,是目前ACC研究的重点与难点。
筛选针对远处转移的有效药物需要建立药物筛选的合理模型。然而,据文献报道,目前国际上常用6株的ACC细胞系(即ACC2、ACC3、ACCM、ACCNS、ACCS和CAC2)存在交叉污染和错误识别[7]。而对于国内的ACC细胞系SACC-83,目前尚不确定其是否存在交叉污染或错误识别等问题。即使是没有被污染的体外细胞系,由于通常其脱离人体时间培养时间长,多代培养及传代使得无法完全反映肿瘤在人体内的生物学状态,药效评价效果有限。因此,建立原代的动物体内生长模型,或许是筛选ACC有效药物的最好方法之一。肿瘤动物模型是临床前评估抗肿瘤药物疗效和预测药物毒性的有效工具,PDX模型是最常用的动物模型之一。PDX模型通过直接转移、体内培养的方式很好地保留了肿瘤异质性,这对于药物的研究有极为重要的临床意义。
ACC具有嗜神经生长特性,被侵袭的神经组织为肿瘤细胞提供了良好的庇护所,导致手术难以完全切净。有研究表明,临床上发生PNI的SACC患者接受放化疗的疗效显著低于无PNI的对照组患者[8-9]。这说明PNI特性是SACC的重要不良预后因素。最新的研究表明,PNI的发生和SC与肿瘤细胞间存在的一种特殊亲和力有关,这可能是通过神经营养因子(neurotrophin,NT)与其TrkC之间的结合实现的[10]。有研究发现NT-3激活SACC细胞的TrkC特异性受体,通过下游Ras、Erk1/2、Ark和Bcl信号通路来提高SACC的侵袭能力[11]。孙沫逸等[12]研究发现TrkC在无嗜神经性的腺泡细胞癌中无表达,而ACC中TrkC中阳性率高达90.6%(29/32),有无嗜神经性侵袭是造成TrkC差异表达的重要原因。目前暂未发现有文献表明TrkC的差异表达和病理类型有明显相关性。因此,针对TrkC靶向抑制剂的研究有望成为药物控制ACC远处转移的重要突破点。
在本研究中,我们收集10例腺样囊性癌患者的新鲜肿瘤组织,皮下接种至免疫缺陷鼠体内。一般情况下,模型建立需2~4个月,若在6个月内仍未观察到肿瘤生长,则表示建模失败[13-15]。成功传代建立PDX模型5例。考虑到移植成功率和肿瘤生长的均一性,我们一般选择P2代以上的肿瘤(即传代两次以上)开展体内药效测试。为了保证和患者肿瘤组织的一致性,每次传代后需要做HE染色确认病理组织结构的一致,并且传代不超过10次。根据患者免疫组化的表达差异,可尝试定制PDX模型,进行个体化药物治疗及放化疗敏感性实验。本研究中病理特点和形态鉴定一致的有3例,并在3例PDX模型中,检测出了TrkC的差异表达。TrkC差异表达的PDX模型建立有助于评估TrkC在ACC肺转移进展中的影响。如图3中我们可看到相较于ACC004,ACC001的肿瘤生长速度明显较快,生长趋势稳定,有望进展为肺转移。这一差异的原因或与TrkC的阳性表达有关,但因PDX模型例数较少且无相同病理类型对照,有待在下一步研究中补充认定。此外对于TrkC表达阴性的ACC004 PDX模型与表达阳性的ACC001与ACC008 PDX进行药物实验,有望实现TrkC靶点抑制剂研发与疗效评估,极有可能为预后较差的ACC病理类型提供新的治疗思路。
当然,PDX模型仍有一些无法避免的缺陷,内源性原发性肿瘤与环境的相互作用无法通过皮下植入来维持,远距离转移的肿瘤特异趋向性几乎没有体现。在未来的研究中,我们需要增加PDX模型数量,进行与患者同步的药物实验。通过PDX肿瘤生长曲线进行疗效评价。
综上所述,在本项研究中,我们成功建立了ACC PDX小鼠模型中的TrkC差异表达模型,这将为今后ACC进行个体化的药物选择,如根据TrkC表达差异,进行药物筛选和设计临床试验奠定了基础。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
