牙本质基质蛋白1糖基化修饰对小鼠骨骼肌损伤修复的影响
2020-05-13周梦琪范琪琪
周梦琪,范琪琪,孙 瑶
(同济大学附属口腔医院种植科,上海牙组织修复与再生工程技术研究中心,上海 200072)
骨骼肌是一种含水量极高的弹性结缔组织,在机体中发挥力量传递及结构支持的作用。骨骼肌损伤是运动和生活中最常见的创伤之一,损伤后骨骼肌需要经历自我修复再生[1]。骨骼肌的损伤和再生是一个连续病理过程的不同阶段,包括:骨骼肌的变性坏死,肌纤维结构破坏;炎性细胞浸润;骨骼肌干细胞激活;再生肌纤维的分化成熟,直至肌功能恢复。骨骼肌的修复依赖多种肌再生因子发挥作用[2]。随着年龄的增长,由于骨骼肌干细胞数量及微环境的改变,骨骼肌修复能力显著减退[3]。
近年来,蛋白聚糖(proteoglycan,PG)在组织的发育与再生中的作用受到广泛关注。近期有研究表明,多种蛋白聚糖在骨骼肌中随着年龄的增长表达降低,并通过调控细胞因子及调节骨骼肌微环境影响骨骼肌再生[4⁃6]。牙本质基质蛋白 1(glycosyla⁃tion of dentin matrix protein 1,DMP1)是一种酸性细胞外基质蛋白,其蛋白质N 端(DMP1⁃N)经过糖基化修饰形成蛋白聚糖形式的分子 DMP1⁃PG[7]。DMP1⁃PG 在软骨和类骨质中高度表达,并在骨发育和骨改建中发挥重要作用[8],缺乏 DMP1⁃PG 的骨组织呈现老龄骨的特征[9],并且影响骨折愈合[10]。近期研究发现在骨骼肌中存在大量DMP1⁃PG。然而关于DMP1⁃PG 在骨骼肌中增龄性变化和损伤修复中的作用无相关报道。本研究构建了DMP1 糖基化位点突变(DMP1⁃S89G)的小鼠,造成小鼠体内缺乏DMP1⁃PG,通过骨骼肌损伤模型探究 DMP1⁃PG 对小鼠骨骼肌损伤修复的影响及其作用机制。
1 材料与方法
1.1 实验动物
DMP1⁃S89G 小鼠由课题组前期设计并委托北京奥赛图生物基因技术有限公司构建。前期研究发现氨基酸S89是小鼠DMP1 主要的糖基化位点,据此采用基因敲入技术将DMP1 的丝氨酸89 替换为甘氨酸89,以干扰DMP1 的正常糖基化过程。体外和体内实验证明S89⁃G89 明显减少DMP1 糖基化水平。年轻(5 周龄)及老龄(12月龄)WT 小鼠购于上海南方模式生物有限公司。所有实验动物在12 h光照/12 h 黑暗循环下在SPF 设施中饲养。对小鼠进行的所有实验方案均由同济大学动物伦理委员会(TJLAC⁃017⁃027)批准。
1.2 腓肠肌冰冻损伤模型
按照文献[11]报道方法建立小鼠腓肠肌冰冻损伤模型。使用 5 周龄雄性 WT 小鼠和 DMP1⁃S89G 小鼠建立冰冻损伤模型。腹腔注射0.3%戊巴比妥钠(50 mg/kg)后,对手术区皮肤进行消毒,沿胫骨后侧做2 cm 皮肤切口,暴露腓肠肌。将在液氮中冷却15 s 的金属棒置于暴露的腓肠肌表面冻融3 个循环,用4⁃0 丝线缝合皮肤,并将小鼠置于37 ℃的恒温垫上2 h。
1.3 H⁃E染色
在冰冻损伤后2、7、14 d 及 1 个月,将小鼠麻醉处死后取伤侧腓肠肌,将腓肠肌放在4%多聚甲醛中于4 ℃放置24 h 后,通过梯度乙醇脱水,包埋在石蜡中。对组织切片,每个切片 4 μm 厚。将切片脱蜡和再水化后,进行H⁃E 染色。
1.4 免疫荧光染色
对切片进行抗原修复并用山羊血清封闭处理。将切片与 anti⁃DMP1⁃N⁃9B6.3(1 ∶500;美国贝勒牙学院秦春林教授赠予)一起孵育,在4 ℃环境过夜。然后用PBS 洗涤,将切片与用荧光标记的二抗室温敷育1 h 用DAPI 对切片进行复染色,封片后用荧光显微镜(Nikon Eclipse 80i,日本尼康公司)观察。
1.5 RT⁃qPCR实验
冰冻损伤后2、7、14 d,取冰冻损伤鼠伤侧腓肠肌,使用Transcriptor First Stand cDNA Synthesis Kit(瑞士Roche 公司)反转录提取 RNA。然后,使用FastStart Essential DNA Green Master Kit ( 瑞 士Roche 公司)和 Light Cycler 96 Instrument 系统(瑞士Roche 公司)分析靶基因的相对mRNA 表达。引物购自生物工程(上海)股份有限公司,引物序列列于表1。GAPDH 用作每个基因的内源对照。
1.6 统计学分析
实验数据用GraphPad Prism 6.0 软件进行统计学分析。采用多个独立样本t检验和多因素方差分析来验证各组评价参数的差异。P<0.05 为差异有统计学意义。

表1 Real⁃time PCR 引物序列Tab.1 Primer sequences for real⁃time PCR
2 结 果
2.1 DMP1⁃PG在小鼠骨骼肌中的表达
DMP1⁃PG 是 DMP1 蛋白 N 端的糖基化形式,通过免疫荧光染色,用抗DMP1⁃N 端抗体观察DMP1⁃PG 的表达,DMP1⁃PG 在腓肠肌纤维连接处广泛表达(图1A、B)。此外,与 5 周龄 WT 小鼠相比,12月龄WT 小鼠肌纤维连接处观察到少量DMP1⁃PG(图1C、D)。RT⁃qPCR 结果显示,5 周龄 WT 小鼠腓肠肌DMP1⁃PG 相对表达量为(0.012 3±0.004 5),显著高于12月龄小鼠腓肠肌的(0.000 5±0.000 2),差异有统计学意义(P<0.01)。
2.2 DMP1⁃PG在小鼠骨骼肌损伤修复过程中的表达
为了观察DMP1⁃PG 在小鼠骨骼肌再生过程中的表达,建立了WT 小鼠腓肠肌的冰冻损伤模型。在小鼠腓肠肌损伤修复过程中,评估 DMP1⁃PG mRNA 表达水平,结果显示:在腓肠肌损伤后2 d,DMP1⁃PG 表达有下降趋势(P<0.01);损伤后 7 d,DMP1⁃PG 表达量显著上调 (P< 0.001);损伤后14 d,DMP1⁃PG 表达量下降至正常水平(图2)。
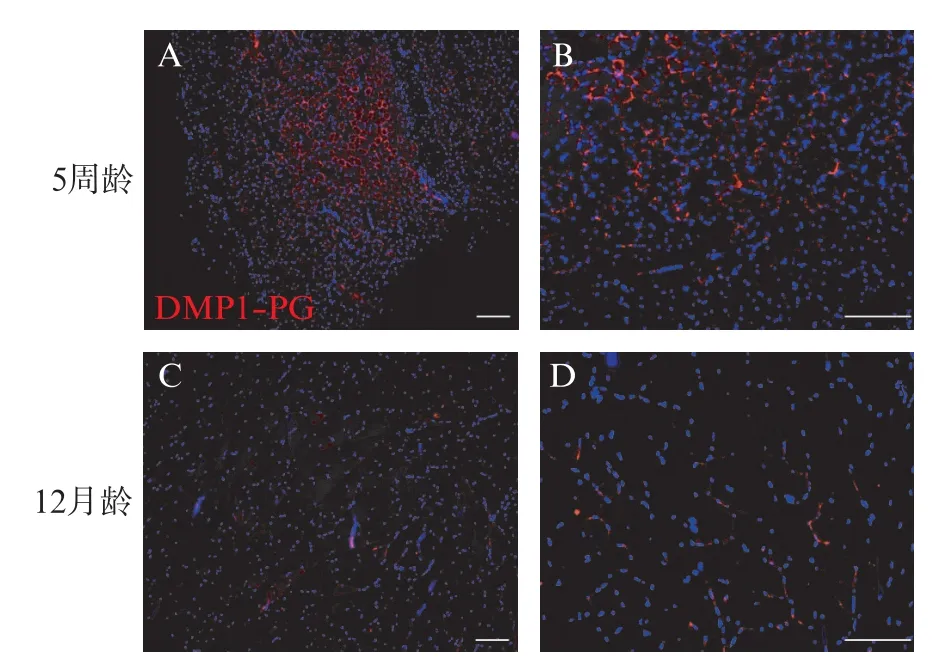
图1 DMP1⁃PG 在小鼠骨骼肌中的表达Fig.1 Expression of DMP1⁃PG in mouse skeletal muscle
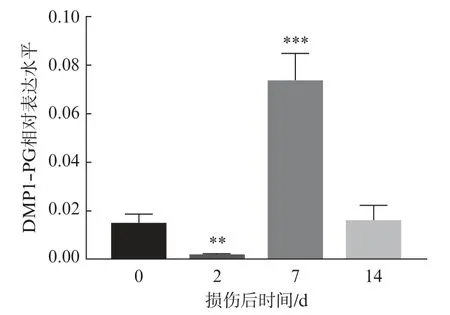
图2 DMP1⁃PG 在小鼠骨骼肌损伤后不同时间点的表达Fig.2 Expression of DMP1⁃PG at different time points after mouse skeletal muscle injury
2.3 DMP1⁃PG缺失抑制小鼠骨骼肌损伤修复
为了进一步探究DMP1⁃PG 在小鼠骨骼肌损伤修复中的作用,对 5 周龄 WT 小鼠和 DMP1⁃S89G小鼠建立冰冻损伤模型,分别于损伤后2、7、14、30 d收取损伤腓肠肌。H⁃E 染色显示,损伤后 2 d,WT小鼠损伤处肌纤维肿胀坏死,大量炎性细胞浸润,DMP1⁃S89G 小鼠炎性细胞浸润较少;骨骼肌损伤后7 d,WT 小鼠损伤处出现大量中央成核肌纤维;损伤后14 d,出现大量多核肌纤维融合形成的肌管,DMP1⁃S89G 小鼠损伤后7 d 中央成核肌纤维形成较少,损伤后14 d 多数肌纤维仍处于融合状态;损伤后1 个月,WT 小鼠损伤处出现大量成熟肌纤维,DMP1⁃S89G 组成熟肌纤维较少。说明在冰冻损伤后,在WT 野生型小鼠中,骨骼肌能够较快的修复,但是在缺乏DMP1⁃PG 的小鼠模型中,肌肉损伤修复的速度减缓,呈现明显修复不良(图3)。

图3 损伤后不同时间点小鼠骨骼肌H⁃E 染色Fig.3 Histological characterization of mouse skeletal muscle using H⁃E staining (Scale bar=100 μm)
2.4 DMP1⁃PG缺失抑制小鼠骨骼肌再生相关因子的表达
为探究DMP1⁃PG 影响小鼠骨骼肌损伤修复的机制,使用 RT⁃qPCR 测定损伤后 2、7、14 d 小鼠腓肠肌肌再生相关因子的表达。结果显示,损伤后2 d,MyoD mRNA 的表达显著上调,而 DMP1⁃S89G小鼠MyoD mRNA 表达量显著低于WT 小鼠(P<0.000 1),见图4A。HGF 和 Myf5 mRNA 表达相似,损伤后2、7、14 d 其表达量显著增加;在损伤后2 d,DMP1⁃S89G 小鼠 HGF 和 Myf5 mRNA 表达量显著低于 WT 小鼠(P<0.01),见图4C、E。Myoge⁃nin mRNA 表达量在损伤后 2、7、14 d 显著上调,且在损伤后 2、7 d,DMP1⁃S89G 小鼠的表达量均显著低于 WT 小鼠(P<0.000 1),见图4B。损伤后 2、7 d,MGF 表达量显著上调,而损伤后 7 d DMP1⁃S89G 小鼠的表达量显著低于 WT 小鼠(P<0.001),见图4D。在损伤后 2、7、14 d,Myosatin mRNA 表达量显著下调,但在 DMP1⁃S89G 小鼠和 WT 小鼠中表达差异无统计学意义(P>0.05),见图4F。

图4 DMP1⁃PG 缺失对损伤后小鼠骨骼肌再生因子表达的影响Fig.4 Effect of reduced DMP1⁃PG on the expression of regeneration factors in mouse skeletal muscle after injury
2.5 DMP1⁃PG缺失抑制小鼠骨骼肌血管再生相关因子的表达
RT⁃qPCR 检测结果显示,DMP1⁃PG 糖基化减少会显著抑制小鼠腓肠肌损伤后2 d VEGF mRNA的表达(P<0.01),见图5A;而 HIF⁃1α mRNA 的表达在损伤后2 d 显著上调(P<0.000 1),见图5B;损伤后 2、7、14 d,Angpt1 mRNA 的表达在 DMP1⁃S89G 组显著上调(P<0.01),见图5C。
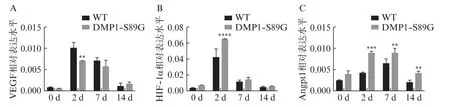
图5 DMP1⁃PG 减少对损伤后小鼠骨骼肌血管再生因子表达的影响Fig.5 Effect of reduced DMP1⁃PG on the expression of angiogenesis factors in mouse skeletal muscle after injury
3 讨 论
骨骼肌再生是一个受多种因素调节的复杂过程,其再生过程分为 3 个阶段[12]。第 1 阶段为损伤炎症期,发生于损伤的早期,此时肌纤维结构破坏,周围有大量炎性细胞浸润。第2 阶段为损伤修复期,出现在损伤后5 ~10 d,原本静息状态下的骨骼肌干细胞被激活,迁移、增殖、分化,与损伤的肌纤维融合以修复受损骨骼肌。第3 阶段发生于损伤后14~21 d,此时再生的肌纤维成熟,称为组织塑形期[1,13⁃14]。此过程受多种因素影响,其中存在于细胞外基质中的多种蛋白聚糖,在骨骼肌的发育和再生中的作用在近年来引起了关注。蛋白聚糖通过调控一些细胞因子,如 MGF[15]和 HGF[16⁃17]影响骨骼肌干细胞的活化、迁移和增殖,从而影响骨骼肌的发育、修复。随着年龄的增长,骨骼肌中大多数蛋白聚糖表达减少,骨骼肌再生能力下降[18]。研究结果表明,表达多配体蛋白聚糖syndecan 的骨骼肌干细胞数量随着年龄的增长而降低[19⁃20]。
DMP1 是一种在机体中广泛分布的酸性蛋白,水解后断裂成 DMP1⁃NH2端(简称 DMP1⁃N)和 DMP1⁃COOH 端(简称 DMP1⁃C)。DMP1⁃N 通过共价键连接一个糖胺聚糖链形成DMP1⁃PG,具有蛋白聚糖的特性,其在未矿化的类骨质、前期牙本质、软骨基质中大量表达,参与牙本质和骨的矿化,调节骨改建,维持骨细胞外基质环境稳态[21⁃22]。研究表明,老龄小鼠骨组织中 DMP1⁃PG 表达下降,DMP1⁃PG 减少会导致牙本质变薄,骨组织骨量下降,骨脆性增加,呈现老龄骨特性[9],并且 DMP1⁃PG 的缺乏会导致骨折愈合异常[10]。近年来的研究也发现 DMP1⁃PG 在多种软组织,如血脑屏障中表达,并发挥关键作用[23]。作为机体重要的软组织,骨骼肌也有DMP1⁃PG 的表达,但DMP1⁃PG 在骨骼肌中的增龄性变化及对骨骼肌损伤修复的影响有待进一步揭示。
在本研究中,首先检测了 DMP1⁃N/DMP1⁃PG在小鼠骨骼肌中的增龄性表达变化,结果显示DMP1⁃N/DMP1⁃PG 集中表达在年轻小鼠骨骼肌肌纤维连接处,而在老龄小鼠骨骼肌中表达显著下降。为了进一步探讨DMP1⁃PG 是否会影响小鼠骨骼肌生成和维持,从而影响骨骼肌损伤修复,对年轻小鼠建立了经典的骨骼肌损伤模型,并检测有无DMP1⁃PG 对于骨骼肌的影响。利用RT⁃qPCR 实验检测冰冻损伤后不同修复时间点骨骼肌DMP1⁃PG mRNA的表达水平,结果显示,损伤后 2 d,DMP1⁃PG 表达有下降趋势,这可能是由于损伤处肌肉组织结构被严重破坏导致,而损伤后7 d 表达显著上调,损伤后14 d DMP1⁃PG 表达恢复至正常水平。这些结果提示,DMP1⁃PG 参与小鼠骨骼肌损伤修复过程。氨基酸S89是小鼠DMP1 唯一的糖基化位点,并高度保守,据此本研究通过基因敲入技术将该位点的丝氨酸替换为甘氨酸,干扰DMP1 的糖基化过程,构建了一种缺乏 DMP1⁃PG 的 DMP1⁃S89G 小鼠,H⁃E 结果显示,与 WT 小鼠相比,DMP1⁃S89G 小鼠骨骼肌损伤后炎性细胞浸润较少,损伤后7 d 中央成核的再生肌纤维形成减少,再生肌纤维融合、成熟过程滞后。本研究结果表明,DMP1⁃PG 缺失会抑制小鼠骨骼肌损伤后修复的关键过程。
肌肉组织是一种内分泌器官,骨骼肌再生受到多种因子的调控[24]。骨骼肌再生受到肌源性调控因子(MRFs)MyoD、myogenin、Myf5 表达调控[25]。MyoD 和Myf5 协同作用使骨骼肌干细胞进入细胞增殖周期并调控其分化,缺乏MyoD 会导致骨骼肌干细胞分化延迟,当敲除MyoD 和Myf5 的基因后,增殖的干细胞无法进一步分化[26]。Myogenin 也参与骨骼肌干细胞细胞分化,是干细胞分化标志物[27]。同时骨骼肌干细胞的激活、增殖、活化还受到 Myostain 的负调控[28]。骨骼肌受损后,除了肌肉本身,血管、浸润的炎性细胞、细胞外基质也会释放相关因子,诱导骨骼肌再生,包括成MGF 和HGF。本研究测定了上述因子在小鼠骨骼肌损伤修复过程中的表达,结果显示骨骼肌损伤后多种MRF 表达显著上调,参与骨骼肌损伤后修复;而当DMP1⁃PG 缺失后,这些肌再生因子的表达则显著下调。这说明DMP1⁃PG 缺失后小鼠骨骼肌损伤修复异常可能是由于肌再生因子表达受到抑制。此外,血管再生也是骨骼肌损伤后修复的重要环节,新生的血管可为骨骼肌再生提供营养和氧气,并且维持骨骼肌所处环境的稳态[29⁃30]。有研究表明 HIF⁃1α、Angpt1 和VEGF 可直接参与骨骼肌损伤修复[31⁃33]。本研究结果显示,DMP1⁃PG 缺失后在小鼠骨骼肌损伤修复过程中 VEGF 表达下降,HIF⁃1α、Angpt1 表达上升,说明损伤处新生血管较少,损伤处缺氧状态改善不足,提示DMP1⁃PG 缺失后损伤小鼠骨骼肌的血管再生受到抑制,进而抑制骨骼肌再生。
综上,本研究结果表明DMP1⁃PG 在小鼠骨骼肌中增龄性减少,并参与了小鼠骨骼肌损伤修复过程。冰冻损伤后,在缺乏DMP1⁃PG 的小鼠模型中,肌肉损伤修复的速度减缓,修复成度明显不良,且这种抑制作用可能与DMP1⁃PG 缺失导致的肌再生相关因子和血管再生因子表达异常有关。但是当DMP1⁃PG 恢复至正常水平后,小鼠骨骼肌损伤后修复能力是否能恢复正常,DMP1⁃PG 在肌肉再生和肌肉干细胞分化过程中的作用还需要进一步探讨。
