液相色谱-串联质谱法快速测定猪肝脏中恩拉霉素残留量
2020-05-09吴银良
张 艳,付 岩,吴银良
(宁波市农业科学研究院,浙江 宁波 315040)
恩拉霉素(Enramycin)是1966年由日本武田药品研究所发现的一株杀真菌素链霉菌(StreptomycesfungicidicusNo.B5477)经发酵获得的次级代谢产物,属于多肽类抗生素。恩拉霉素的主要成分有恩拉霉素A和恩拉霉素B,此外还有少量的恩拉霉素C和恩拉霉素D[1]。动物使用后,能改善肠道内的细菌群,可促进猪、鸡增重和提高饲料转化率,且具有低毒、低残留特性,2005年在国内开始获批生产使用[1]。该药物是少数几种可用于饲料添加的抗生素之一,但生产中为追求效益往往超量使用,一方面损伤动物的脏器组织[2],另一方面势必造成其在动物产品中残留量增加。目前我国GB 31650-2019《食品中兽药最大残留限量》和原农业部第235号公告均未规定恩拉霉素在动物可食性组织中的最大残留量(MRL)[3-4],但日本规定了恩拉霉素在猪、鸡的可食性组织(肌肉、肝脏、肾脏和脂肪)中的MRL为30 μg/kg[5]。为保障我国动物性食品安全和促进国际贸易,迫切需要建立快速准确的动物性食品中恩拉霉素的检测方法。
目前已建立的生物材料中恩拉霉素的分析方法相对较少,分析对象主要为饲料,少数为动物性食品,分析手段有微生物法[6-7]、薄层色谱法[8]、液相色谱法[9]和液相色谱-串联质谱法(LC-MS/MS)[5,10-11];恩拉霉素人工抗原方面的研究亦有一定报道[12-13],但未见相关免疫分析方法的报道。而动物性食品中恩拉霉素的分析方法多为液相色谱-串联质谱法,分析对象为鸡肉[5,10]和猪肉[11],待测物均为恩拉霉素A和恩拉霉素B,目前尚未见有关动物肝脏中恩拉霉素的分析方法报道;所建方法均采用固相萃取进行净化,净化小柱有Waters Oasis HLB、Agilent Bond Elut ENV以及IRISTMPolymeric SPE,前处理较复杂,且Boison等[5]建立的方法对鸡肉中恩拉霉素A和恩拉霉素B的定量下限分别为66 μg/kg和50 μg/kg,无法满足相关残留限量的要求。本研究利用恩拉霉素易溶于稀盐酸的特点,建立了稀盐酸-乙腈混合溶液提取,有机溶剂液液萃取净化,LC-MS/MS分析猪肝脏中恩拉霉素的方法。该方法具有简单、快速、准确和灵敏的特点,能满足相关残留监控的需要。
1 实验部分
1.1 仪器与试剂
Waters UPLC超高效液相色谱仪、XevoTMTQ-S micro串联质谱仪(美国Waters公司),配置电喷雾离子源;Ultra-Tyrrax T25型匀质器(德国IKA公司);低温高速离心机(德国Sigma公司)。
恩拉霉素A和恩拉霉素B均由安徽普洛生物科技有限公司提供,含量分别为98.6%和92.3%。甲醇、乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,美国Tedia公司);盐酸、乙酸乙酯和正己烷(分析纯,国药集团化学试剂有限公司);实验用水为Milli-Q超纯水。
1.2 色谱及质谱条件
色谱条件:色谱柱为Acquity BEH C18(100 mm×2.1 mm,1.7 μm);流动相:A相为0.1%甲酸溶液,B相为甲醇;流速:0.3 mL/min;进样量:10 μL;梯度洗脱条件:在0.5 min内保持80%A,然后在2.5 min内线性降至25%A,保持2 min后在0.1 min内线性升至80%A,保持1.9 min。
质谱条件:离子源为电喷雾电离源(ESI),正离子模式电离;检测方式为多反应监测(MRM);毛细管电压为2.0 kV;萃取锥孔电压为25 V;RF透镜电压为0.5 V;离子源温度为150 ℃;脱溶剂气温度为500 ℃;锥孔气流速为50 L/h;脱溶剂气流速为1 000 L/h;其它条件见表1。

表1 恩拉霉素A和恩拉霉素B的保留时间、母离子、子离子、锥孔电压及碰撞能量Table 1 Retention times,precursor ions,product ions,cone voltages and collision energies of enramycin A and enramycin B
*quantitative ion
1.3 样品前处理
称取试样2.5 g(精确至0.01 g)于50 mL离心管中,加入10 mL 0.1 mol/L盐酸-乙腈(3∶7,体积比),以10 000 r/min均质1 min,再以9 500 r/min离心5 min后,取上清液,相同条件下重复提取1次,合并提取液,依次加入8 mL乙酸乙酯和2 mL正己烷,涡旋1 min后以5 000 r/min离心2 min,取下层水相(约6.5 mL),用0.1%甲酸定容至10 mL,过0.22 μm滤膜后,供LC-MS/MS测定。
1.4 加标回收实验
利用经测定不含恩拉霉素的猪肝脏样品进行加标实验,样品处理与“1.3”方法相同,恩拉霉素A和恩拉霉素B的加标浓度为15、30、60 μg/kg。样品称样后加入标准溶液,涡旋混匀放置0.5 h后进行样品处理。
1.5 精密度实验
按照“1.4”进行空白加标实验,每一加标浓度进行3批次实验,每批次5个平行样品,计算批内相对标准偏差(RSD)及批间RSD。
2 结果与讨论
2.1 仪器条件的优化
多肽类抗生素因结构上含有氨基基团而在正离子模式下易带正电荷,且易带2个或3个电荷[5]。本实验用0.1%甲酸溶液-甲醇(80∶20,体积比)分别配制1.0 mg/L的恩拉霉素A和恩拉霉素B单标溶液,发现相同条件下恩拉霉素A和恩拉霉素B带3个电荷的准分子离子峰的响应分别约为带2个和4个电荷准分子离子峰响应的50倍和10倍,因此优化得到带3个电荷的准分子离子峰的质谱条件(表1)。其中定量离子对(m/z786.0>95.0和m/z790.8>95.0)与文献报道相同[5,10-11],本方法选择的定性离子为m/z1 089.0,与文献[5]中恩拉霉素B的定性离子一致。
采用超高效液相色谱常用的Acquity BEH C18柱(100 mm×2.1 mm,1.7 μm)在“1.2”的梯度条件下,对比了水相中甲酸浓度为0.1%、0.2%和0.4%,有机相为甲醇或乙腈时恩拉霉素A和恩拉霉素B的分离效果,发现恩拉霉素A和恩拉霉素B在甲酸为0.1%时的响应和信噪比均最好;且有机相为甲醇时,恩拉霉素A和恩拉霉素B的响应比有机相为乙腈时高70%左右,信噪比约高40%,因此确定以0.1%甲酸溶液-甲醇为流动相。
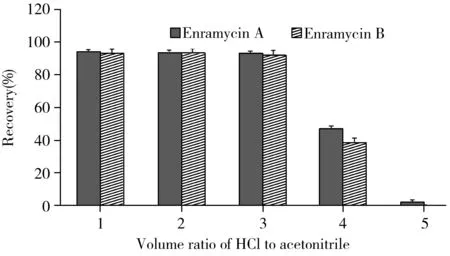
图1 不同体积比0.1 mol/L盐酸和乙腈混合溶剂对恩拉霉素提取回收率的影响(加标200 μg/kg)Fig.1 Effects of different volume ratio for 0.1 mol/L HCl- acetonitrile on recoveries of enramycin (added 200 μg/kg) volume ratio of 0.1 mol/L HCl to acetonitrile(1-5):5∶5, 4∶6,3∶7,2∶8,1∶9,respectively
2.2 前处理条件的优化
目前多肽类抗生素常用的提取剂有甲醇[14]、甲醇-水[5,15-16]、盐酸-乙腈[10-11]等。而恩拉霉素易溶于盐酸,因此本研究按照“1.3”的方法对比了不同比例0.1 mol/L盐酸和乙腈混合溶剂的提取效果(图1),发现0.1 mol/L盐酸和乙腈的体积比为3∶7、4∶6和5∶5时的提取回收率均高于92.0%,且差异较小;同时经研究发现乙腈比例越高,基质效应越小,因此本研究采用0.1 mol/L盐酸-乙腈(3∶7)作为提取溶剂。
对于动物性食品中多肽类抗生素的净化目前多采用固相萃取法,萃取小柱主要有HLB、PLS、Strata-X、Bond Elut ENV和IRISTMPolymeric SPE等[5,10-11,14-16]。考虑到恩拉霉素易溶于盐酸,本研究尝试在提取液中加入有机溶剂采用液液萃取净化提取液,结果发现按“1.3”步骤得到的加标样品提取液中加入8 mL乙酸乙酯涡旋后,水相和有机相分层较好,但由于分层后水相体积较少(约2.5 mL),回收率(n=3)只有(42±2)%左右;而固定加入8 mL乙酸乙酯,同时加入不同体积(1、2、3 mL)正己烷时的回收率(n=3)分别为(65±3)%、(83±4)%和(82±4)%。当正己烷体积从1 mL增至2 mL时,上层溶液的极性逐渐变弱而导致更多水从上层析出,下层水相体积从2.5 mL增至6.5 mL左右,最终导致回收率逐渐增加;当正己烷体积从2 mL增至3 mL时,下层水相体积基本不变,回收率变化也较小,因此选择加入2 mL正己烷。同时对直接提取进样、液液萃取、ENV固相萃取净化(按“1.3”提取,氮吹至无有机相后按文献[10]操作)的基质效应(以基质标准曲线斜率和溶剂标准曲线斜率之比表示)进行研究,发现液液萃取净化的基质效应得到了明显改善,与固相萃取净化的基质效应差异较小,但操作更加简单快速,且空白样品无杂质干扰(图2A);同时最终上样溶液经样品提取净化等步骤处理后,含盐酸浓度约为0.06 mol/L,且仅作为进样溶液未作为流动相,大量进样(方法研究和实际样品分析)后未发现对ESI源的喷雾电流和ESI污染有明显影响,因此采用加入乙酸乙酯和正己烷液液萃取的方法进行样品净化。
2.3 线性实验
在经“1.3”处理的空白样品下层净化液中加入适量恩拉霉素A和恩拉霉素B标准溶液,配制2.0、10、20、50、100、200、500 μg/L系列基质匹配标准工作溶液进行LC-MS/MS分析,以定量离子对峰面积(Y)对质量浓度(X,μg/L)作标准曲线。结果表明,恩拉霉素A和恩拉霉素B在2.0~500 μg/L范围内呈良好的线性关系,回归方程分别为Y=89.6X+205(r2=0.998 9)和Y=97.8X+189(r2=0.997 8)。
2.4 方法的回收率、相对标准偏差与检出限
按照“1.4”和“1.5”方法进行加标和精密度实验,结果表明,恩拉霉素A和恩拉霉素B的平均回收率为80.8%~90.3%,批内RSD为0.90%~4.5%,批间RSD为3.0%~4.3%。分别以信噪比S/N=3和S/N=10计算检出限和定量下限,恩拉霉素A和恩拉霉素B在猪肝脏中的检出限分别为3.0、4.0 μg/kg,定量下限分别为10、12 μg/kg(表2)。本方法的灵敏度与文献[10]相当,明显优于文献[5]的方法灵敏度(恩拉霉素A和恩拉霉素B的定量下限分别为66、50 μg/kg);同时本方法操作更简便,单个样品从前处理到分析仅需0.5 h左右,比现有方法耗时短(通常需1.5~3 h)。空白猪肝脏样品的加标回收MRM色谱图见图2B。
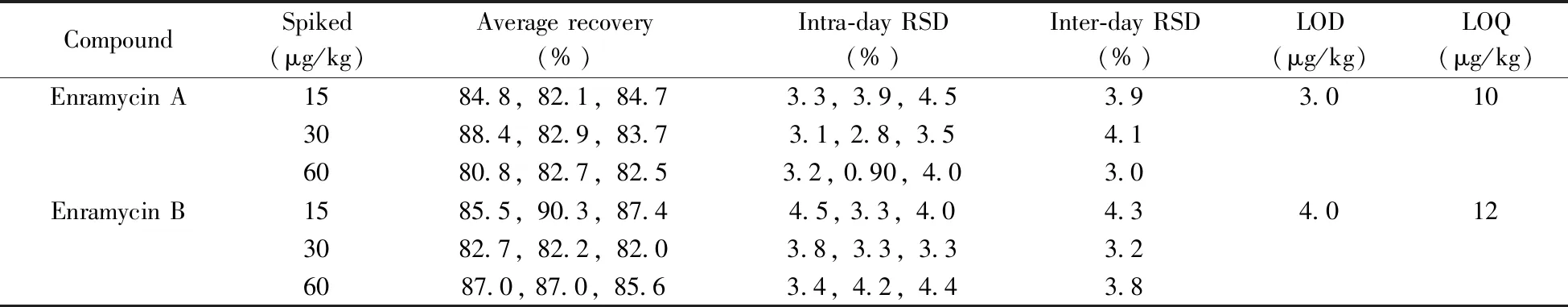
表2 猪肝脏中恩拉霉素的平均回收率、相对标准偏差、检出限和定量下限Table 2 Average recoveries,relative standard deviations(RSD),the limits of detection(LOD) and the limits of quantitation(LOQ) of enramycin in swine liver
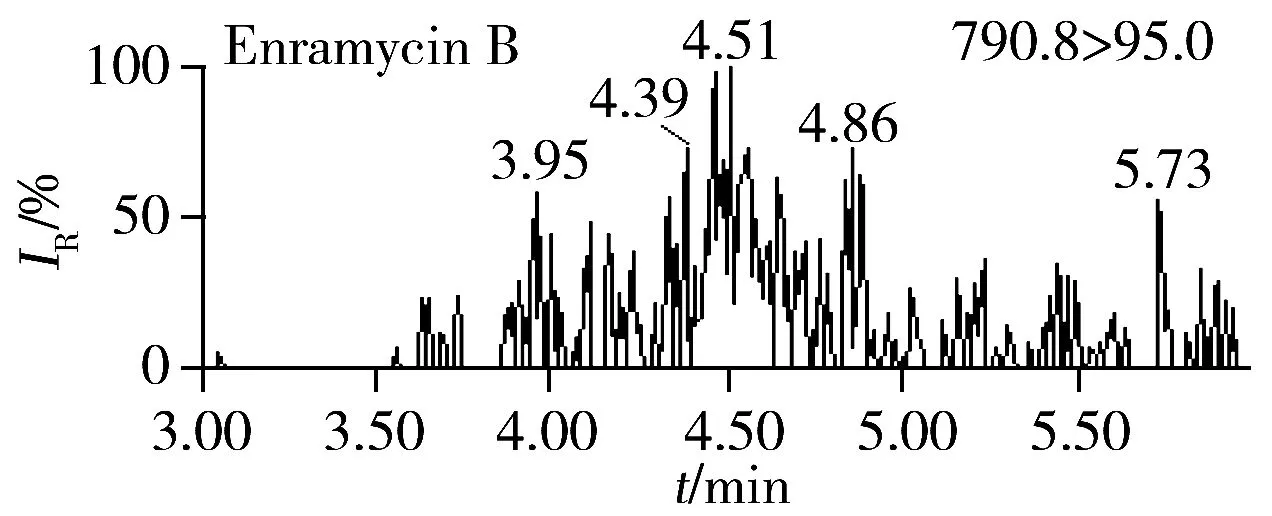
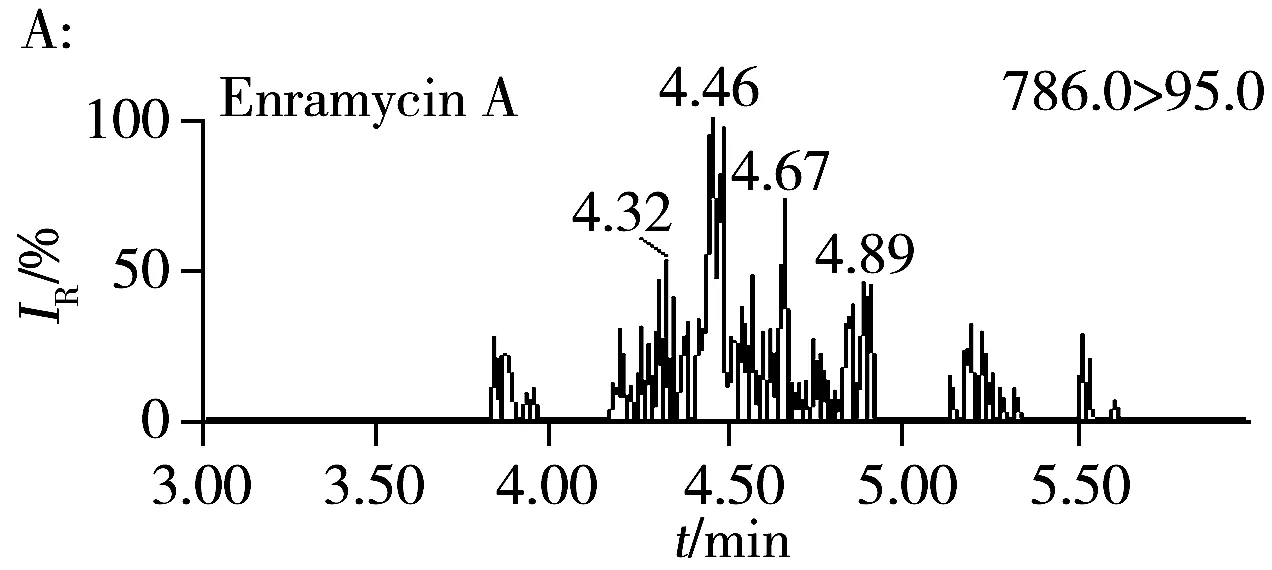
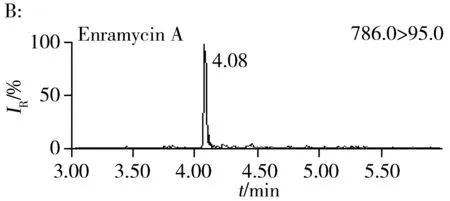
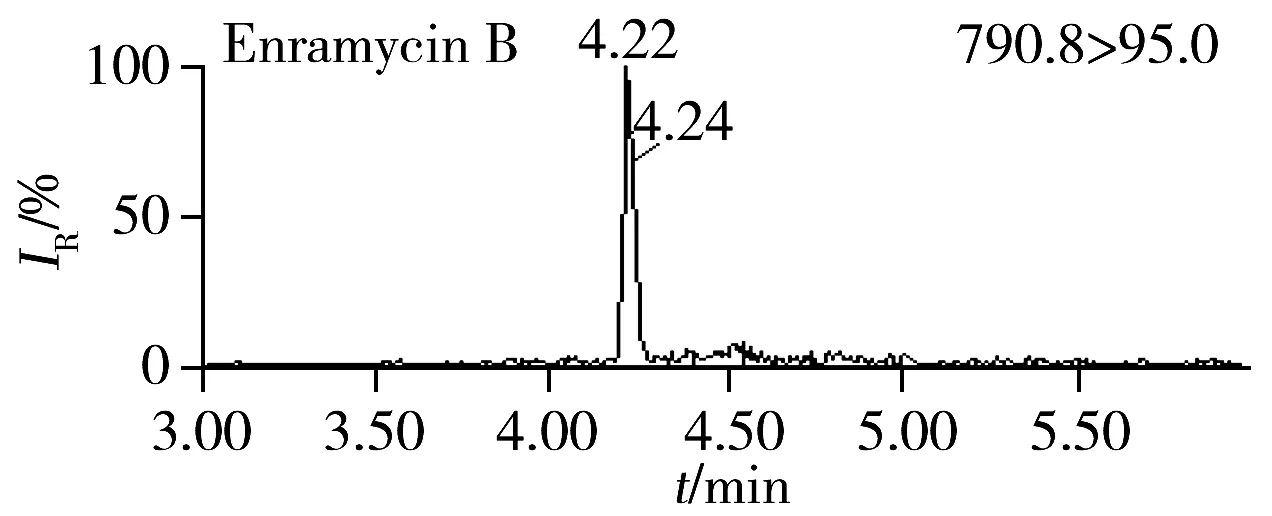
图2 空白猪肝脏样品(A)和加标样品(B,15 μg/kg)的MRM色谱图Fig.2 MRM chromatograms of swine liver blank sample(A) and fortified sample(B,15 μg/kg)
2.5 方法应用
采用优化后的样品前处理方法和分析条件分别对采自宁波当地大型超市的22个猪肝脏样品进行了分析,均未检出恩拉霉素A和恩拉霉素B。
3 结 论
通过优化样品提取和仪器条件,建立了猪肝脏样品中恩拉霉素A和恩拉霉素B同时分析的液相色谱-串联质谱方法。样品经0.1 mol/L盐酸-乙腈(3∶7)提取后,通过加入有机溶剂液液萃取净化即可满足分析要求。经方法验证,恩拉霉素A和恩拉霉素B在15、30、60 μg/kg加标浓度下,平均回收率为80.8%~90.3%,批内RSD为0.90%~4.5%,批间RSD为3.0%~4.3%,检出限分别为3.0、4.0 μg/kg,定量下限分别为10、12 μg/kg。该方法简单实用,能够满足实际残留监控的需要。
