免疫相关LncRNA与膀胱癌预后关系分析及预测模型建立
2020-05-06柳子川
王 尧,周 旻,柳子川,游 华
(广州医科大学附属肿瘤医院 内科,广东 广州 510095)
膀胱癌是泌尿系统中常见的恶性肿瘤,在我国近年来的发病率和病死率均呈逐步上升态势[1]。在临床上,高发于65岁以上的男性,男女发病比例为3∶1~4∶1。其中70%为非肌层浸润性膀胱癌,30%为肌层浸润性膀胱癌。非肌层浸润性膀胱癌的特征是高复发率和低死亡率,而肌层浸润性膀胱癌中约50%存在潜在致死性[2]。自1976年膀胱灌注卡介苗(BCG)成功应用后的数10年期间,肌层浸润性、局部晚期和转移性膀胱癌的治疗并未取得重要进展[3]。近年来,随着免疫治疗的兴起,尤其是免疫检查点抑制剂(Immune check point inhibitors,ICIs)的出现改变了晚期膀胱癌的传统治疗模式[4],然而其客观缓解率仍有限,因此结合免疫相关因素对膀胱癌患者进行风险分层有助于判断预后及治疗反应。长链非编码RNA(Long noncoding RNA,LncRNA)是指长度大于 200 bp并且不具备蛋白编码功能的RNA,它在肿瘤免疫应答过程如抗原暴露、抗原识别、免疫激活、免疫细胞浸润、肿瘤清除等不同阶段中发挥着广泛的调控作用[5]。既往研究表明,多种LncRNA如TP73-AS1、LNMAT2、ITGB1等能够促进膀胱癌的发生发展,是潜在治疗靶点[6-8]。然而免疫相关LncRNA在膀胱癌预后中的作用尚不明确,本研究旨在通过分析TCGA数据库中的基因表达谱来探索免疫相关LncRNA与膀胱癌患者预后的关系并建立预测模型。
1 材料与方法
1.1 数据采集 本研究从TCGA数据库(https://cancergenome.nih.gov/)下载了393例膀胱癌患者肿瘤和正常组织的基因表达谱及相应临床数据。排除总生存期<30 d以及临床分期不明确的患者,每个肿瘤组织对应一个患者。资料采集时间为2019年10月1日。
1.2 提取免疫相关LncRNA 通过GSEA网站(http://software.broadinstitute.org/gsea/index.jsp)下载免疫相关基因集(Immune system process M13664,Immune response M19817),分析提取免疫相关基因[9]。通过免疫相关基因-LncRNA共表达方法鉴定获得免疫相关的LncRNA。
1.3 构建预测模型 使用R Survival 包对单因素分析中具有显著统计学差异的LncRNA进行多因素分析,根据 Akaike Information Criterion(AIC)确定最优的预测模型。每个患者的风险评分根据LncRNA表达水平(exprgene)和多因素分析中加权线性组合的回归系数β来确定,具体计算公式如下:Risk score =β1gene1×expr(gene1)+β2gene2×expr(gene2)+…+βn geneN×expr(geneN)。采用中位风险评分法分为低风险组和高风险组。
1.4 GSEA和ESTIMATE分析 通过基因富集分析(Gene set enrichment analysis,GSEA)分析两组患者在免疫相关功能中的富集状态,依照基因表达倍数改变降序排列。使用ESTIMATE(Estimation of sTromal and immune cells in mAlignant tumors using expression data)方法评估每个样本中免疫细胞浸润水平、基质细胞含量及肿瘤纯度[10]。
1.5 统计分析 采用Kaplan-Meier法绘制生存曲线,组间差异采用log-rank检验。单因素及多因素生存分析采用COX比例风险模型。构建ROC曲线并验证模型的拟合程度。采用主成分分析(Principal component analysis,PCA)观测两组免疫相关基因的分布。所有统计学处理采用R(3.5.2)软件,P<0.05(双侧)定义为有统计学差异。
2 结果
2.1 病例特征 本研究共纳入393例膀胱癌患者,其中男性290人(73.8%),女性103人(26.2%),平均年龄为68.1岁(34~90岁)。各项临床病理特征详见表1。
表1 393例膀胱癌患者的临床病理特征

指标年龄 <60岁 ≥60岁性别 男 女肿瘤分级 高 低肿瘤分期 Ⅰ Ⅱ Ⅲ IVT分期 T1 T2 T3 T4 不确定淋巴结受累 N0 N1-N3 Nx远处转移 M0 M1 Mx例数(%)85(21.6)308(78.4)290(73.8)103(26.2)374(95.2)19(4.8)2(0.5)123(31.3)137(34.9)131(33.3)4(1.0)113(28.8)189(48.0)58(14.8)29(7.4)227(57.8)126(32.0)40(10.2)185(47.1)10(2.5)198(50.4)
2.2 免疫相关LncRNA与膀胱癌患者预后关系 通过GSEA免疫相关基因集(Immune system process M13664,Immune response M19817)分析提取TCGA数据集中331个免疫相关基因,通过免疫相关基因-LncRNA共表达方法鉴定获得531个免疫相关的LncRNA(相关系数Cor>0.6,P<0.001)。进一步通过单因素COX回归分析筛选出9个和膀胱癌预后相关的LncRNA(见表2)。
表2 单因素COX分析筛选与膀胱癌预后相关的免疫相关LncRNA
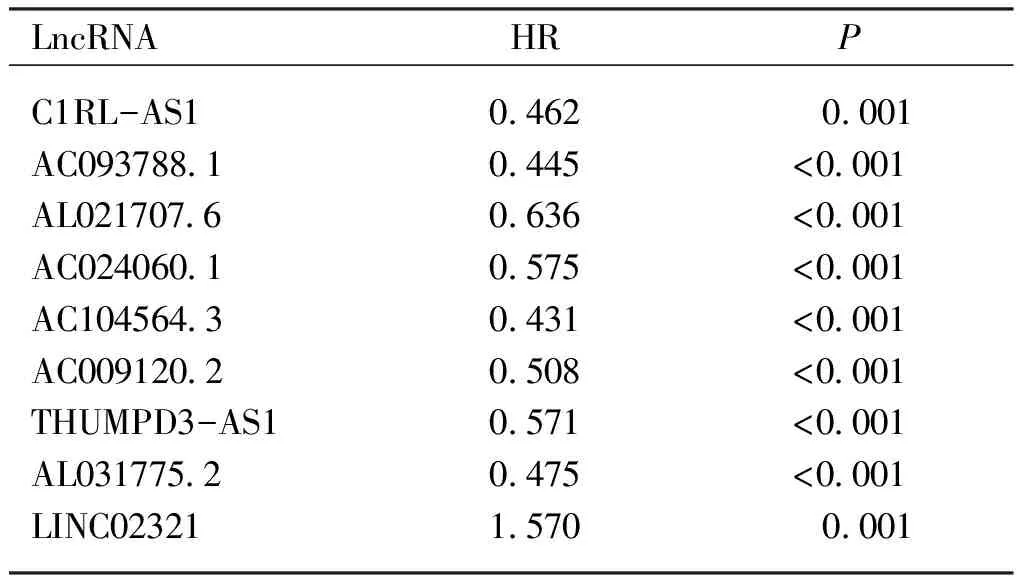
LncRNAHRPC1RL-AS1AC093788.1AL021707.6AC024060.1AC104564.3AC009120.2THUMPD3-AS1AL031775.2LINC023210.462 0.445 0.636 0.575 0.431 0.508 0.571 0.475 1.570 0.001 <0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.001
2.3 预测模型的建立和验证 通过对上述9个LncRNA进行多因素分析,根据AIC值确定最终纳入模型的5个LncRNA(见表3),按照每个LncRNA的表达量及回归系数β计算每位患者的风险评分,根据风险评分中位值将患者分为高风险组(n=196)和低风险组(n=197)。通过绘制Kaplan-Meier生存曲线,两组间生存率差异具有统计学意义(P<0.001,见图1A),高、低风险组患者的5年生存率分别为28.5%和58.1%。高风险组和低风险组的风险评分(见图1B)及5个LncRNA的表达情况(见图1C)如图所示。预测模型的ROC曲线下面积AUC为0.690(见图2A)。
表3 多因素COX回归分析筛选出用于构建模型的的免疫相关LncRNA
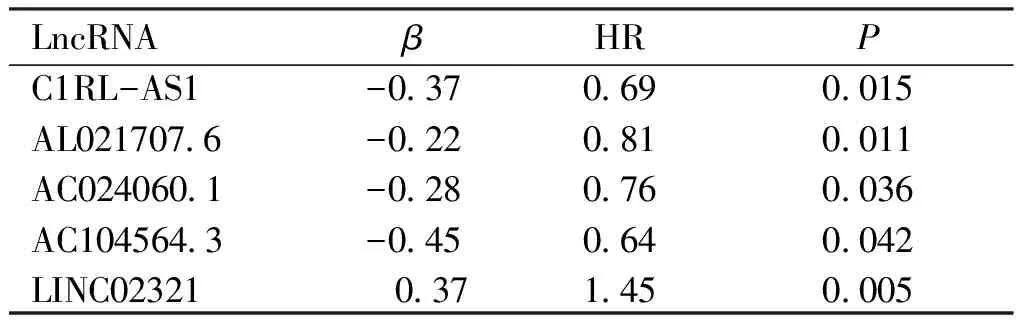
LncRNAβHRPC1RL-AS1AL021707.6AC024060.1AC104564.3LINC02321-0.37 -0.22 -0.28 -0.45 0.370.69 0.81 0.76 0.64 1.450.0150.0110.0360.0420.005
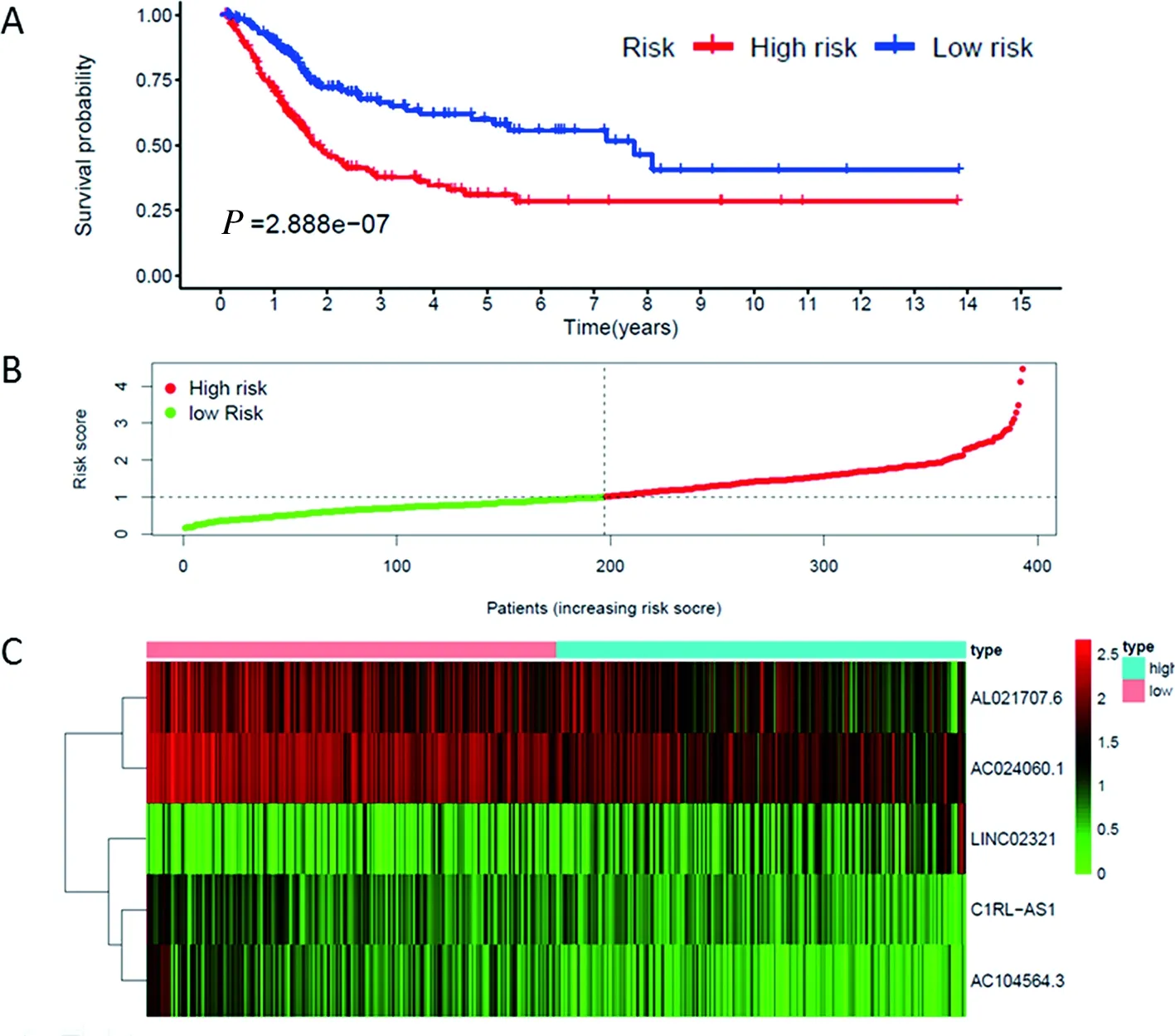
A:预测模型的Kaplan-Meier生存曲线;B:高风险组和低风险组的风险评分;C:5个免疫相关LncRNA的表达热图。图1 预测模型的生存曲线及分组特征
2.4 高风险组及低风险组的免疫特征 根据免疫基因表达谱进行主成分分析(PCA),发现高、低风险组患者免疫相关基因的分布具有明显的差异(见图2B)。通过GSEA进一步分析显示,在高风险组中的免疫系统和免疫应答途径相关基因明显富集(见图2C、D)。通过ESTIMATE分析发现高风险组的免疫评分高,低风险组较低(见图3)。高风险组所包含的免疫细胞和基质细胞数量较多,而肿瘤纯度低,两组间具有统计学差异(P<0.001)。
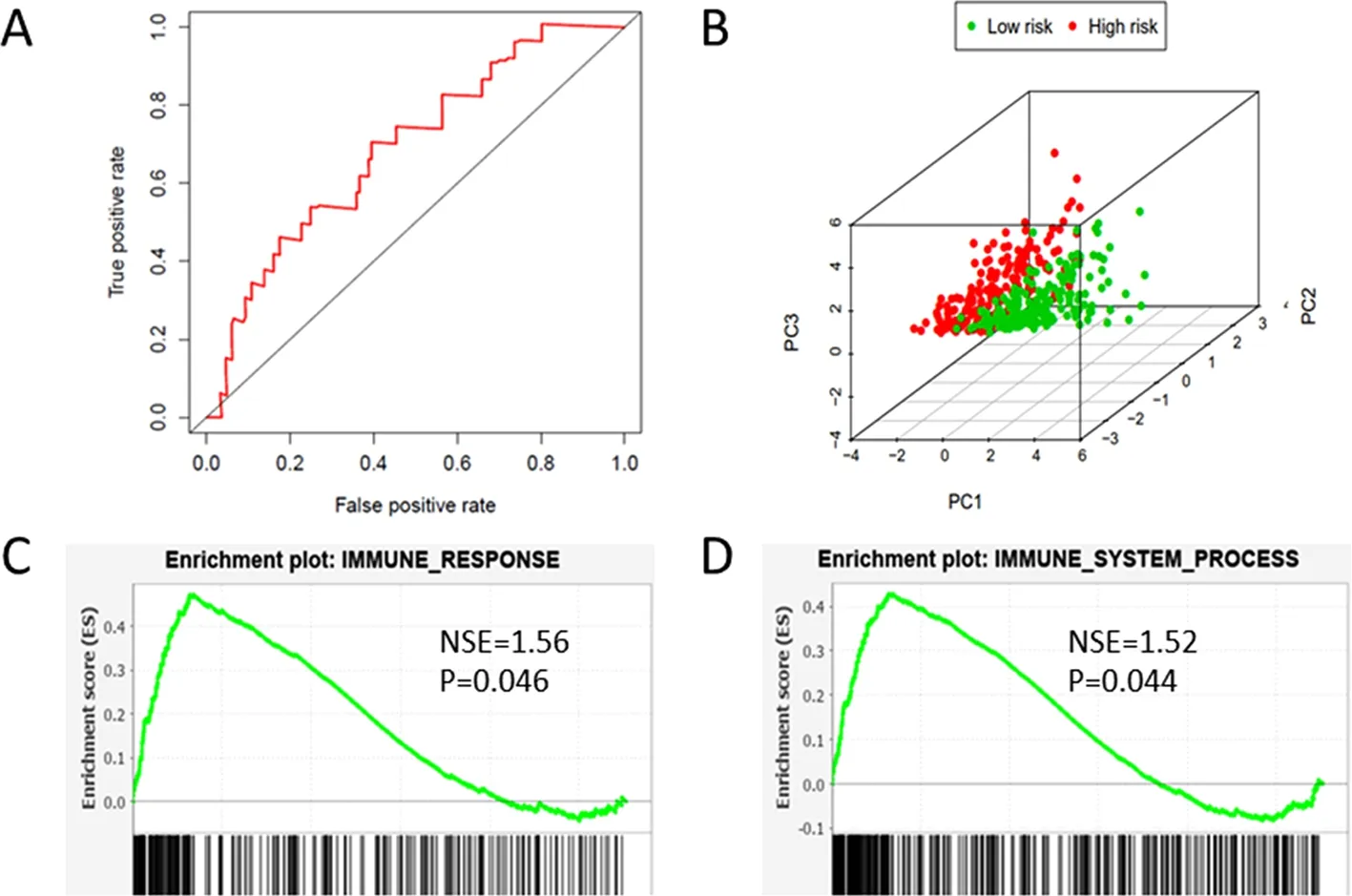
A:预测模型的ROC曲线; B:高风险组和低风险组中免疫基因的分布; C:免疫应答相关基因的富集分析;D:高风险组中的免疫系统相关基因的富集分析;NSE:标准化富集评分。图2 预测模型的验证及分组免疫特征
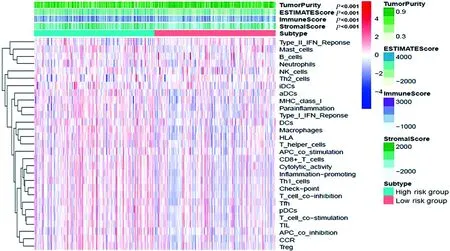
图3 高风险组及低风险组的ESTIMATE分析
3 讨论
免疫系统具有识别和消灭肿瘤细胞的功能,但是肿瘤细胞能够通过免疫逃逸和免疫抑制躲避免疫系统的监控,免疫应答异常与肿瘤的发生、发展密切相关[11]。近年来研究发现LncRNA在免疫应答中发挥着重要的调控作用,包括调节骨髓造血干细胞分化及发育;调节免疫细胞的发育、分化和活化状态;调控细胞因子受体调节免疫应答;参与自噬、炎症等过程的激活等[12]。免疫相关LncRNA对多种肿瘤的生存预后具有预测价值,是癌症治疗的潜在靶点[13-14]。
本研究分析了TCGA数据库中393例膀胱癌患者的全基因组表达数据,通过生存分析和Cox回归模型,探讨了免疫相关LncRNA与膀胱癌预后的关系。用于构建模型的5种免疫相关LncRNA在单因素及多因素分析中均与患者预后密切相关,是患者预后的独立因素。其中LINC02321为危险基因,C1RL-AS1、AL021707.6、AC024060.1、AC104564.3为保护基因。先前研究发现AL021707.6参与了中性粒细胞自发凋亡的调控,相应的基因产物也可能成为炎症反应过度的治疗靶点[15]。而其它的LncRNA目前无相关临床或基础研究,它们在膀胱癌中的作用机制尚不明确,仍有待于进一步探索。
膀胱癌的发病率及临床特点,如病理分型、组织类型、发生部位在不同患者中有明显差异,同一分期的患者预后也有所不同,因此对于膀胱癌的预后因素需要有更多的认知。该模型将患者分为高风险组和低风险组,两组间的生存率具有明显的统计学差异,预测模型ROC曲线下面积AUC为0.690,明显高于其它临床病理因素,可作为TNM分期的有益补充。
近年来免疫治疗在肌层浸润性膀胱癌领域取得了一系列突破性进展,研究表明ICIs的疗效有赖于肿瘤的免疫原性,目前在膀胱癌中预测ICIs疗效的标志物主要包括:PD-L1的表达水平、膀胱癌的luminal和basal分型、肿瘤的突变负荷、ECOG评分以及转移器官等[16]。肿瘤微环境由肿瘤细胞本身、间质细胞、微血管、微淋巴管、组织液、众多细胞因子及少量浸润细胞等共同构成,其中的淋巴细胞在抗肿瘤免疫过程中具有重要作用,本研究通过ESTIMATE分析发现两组之间的免疫微环境组成具有明显的统计学差异(P<0.001),高风险组的肿瘤微环境中包含的更多的免疫细胞和基质细胞,其免疫评分明显高于低风险组。通过主成分分析发现高、低风险组患者免疫相关基因的分布具有明显的差异,说明两组的免疫状态不同,并且通过GSEA分析显示该高风险组中的免疫系统和免疫应答途径相关基因明显富集,进一步提示高风险组具有更强的免疫原性,或许更适合于免疫治疗。
综上所述,我们通过分析免疫相关LncRNA与膀胱癌患者生存状态的关系并基于此构建的预测模型对判断患者的预后具有重要意义。高风险组及低风险组患者的免疫状态存在明显差异,有可能成为评估是否适合免疫治疗的参考指标。该模型的建立为临床医师的治疗选择提供了方便,然而作为一项探索性的研究,其应用价值仍有待于多中心大样本的临床研究进一步验证。
