MFHAS1促进诱导M2型巨噬细胞极化减轻马兜铃酸诱导急性肾损伤的研究
2020-05-03张黎孙婧邓秋芳甘金城叶茂
张黎 孙婧 邓秋芳 甘金城 叶茂
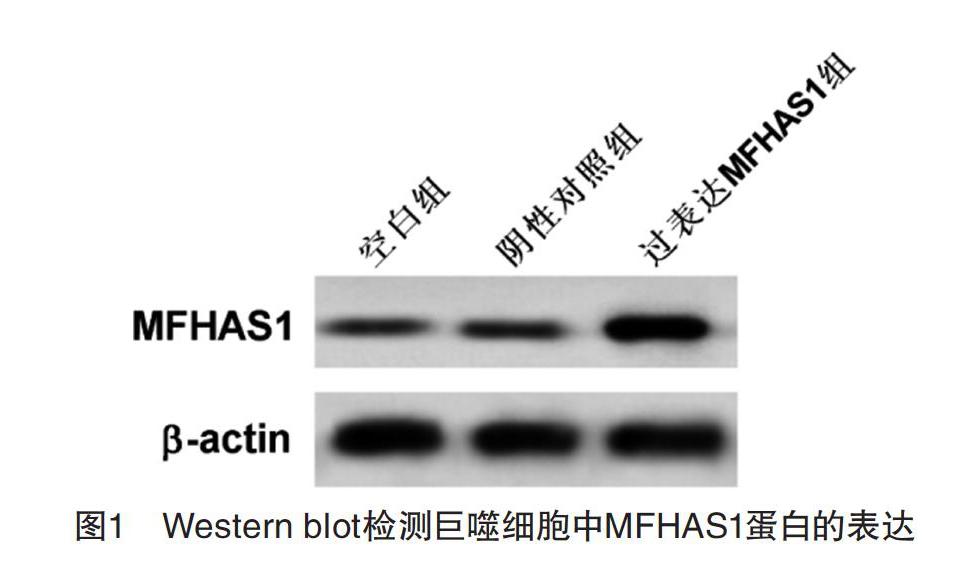
【摘要】 目的:研究MFHAS1對M2型巨噬细胞极化的影响以及M2型巨噬细胞对马兜铃酸诱导的肾上皮细胞HK-2急性损伤的影响。方法:Real-time PCR检测MFHAS1 mRNA的表达,MTT法检测细胞存活率,流式细胞术检测细胞凋亡和M2型巨噬细胞表面胞膜分子CD86和CD206的表达,Western blot检测MFHAS1及M2型巨噬细胞中Arg1和MRC1蛋白的表达,ELISA检测巨噬细胞培养上清中IL-10的含量。结果:THP-1细胞中过表达MFHAS1可使M2型巨噬细胞的Arg1、IL-10和MRC1表达量均显著上升(P<0.05),同时M2型巨噬细胞表面胞膜分子CD206表达量显著上升(P<0.05),CD86的表达显著下降(P<0.05),即THP-1细胞中过表达MFHAS1可促进IL-13诱导巨噬细胞向M2型极化;M2型巨噬细胞能抑制马兜铃酸对HK-2细胞的凋亡诱导作用,提升细胞存活率。结论:过表达MFHAS1可促进IL-13诱导巨噬细胞向M2型极化,M2型巨噬细胞可抑制马兜铃酸对肾上皮HK-2细胞的凋亡诱导作用,提升细胞存活率,减轻细胞损伤。
【关键词】 急性肾损伤 THP-1 HK-2 MFHAS1 马兜铃酸 M2型巨噬细胞 存活率 凋亡率
MFHAS1 Promoted the Polarization of M2 Macrophage to Alleviate Acute Renal Injury Induced by Aristolochic Acid/ZHANG Li, SUN Jing, DENG Qiufang, GAN Jincheng, YE Mao. //Medical Innovation of China, 2020, 17(04): 00-011
[Abstract] Objective: To investigate the effect of MFHAS1 on polarization of M2 macrophages and the effect of M2 macrophages on acute kidney injury of renal epithelial HK-2 cells induced by aristolochic acid. Method: Real-time PCR was carried out to detect the expression levels of MFHAS1 mRNA. MTT assay was applied to detect cell viability. Flow cytometry was used to detect apoptosis and the expression levels of CD86 and CD206 on the surface of M2 macrophages. Western blot was used to detect the protein expression levels of MFHAS1, Arg1 and MRC1. ELISA was applied to detect the content of IL-10 in the supernatant of macrophage culture. Result: Overexpression of MFHAS1 in THP-1 cells significantly increased the expression of Arg1, IL-10 and MRC1 of M2 macrophages (P<0.05), while the expression of CD206 on the surface of M2 macrophages significantly increased (P<0.05), and the expression of CD86 significantly decreased (P<0.05). In other words, the overexpression of MFHAS1 in THP-1 cells promoted the induction of IL-13 on polarization of M2 macrophages. M2-type macrophages inhibited the apoptosis induction effect of aristolosic acid on HK-2 cells and elevated the cell survival rate. Conclusion: Overexpression of MFHAS1 promotes the induction of IL-13 on polarization of M2 macrophages. M2 macrophages inhibits the apoptosis induction effect of aristolosic acid on renal epithelial HK-2 cells, improve cell survival rate and alleviates cell injury.
[Key words] Acute kidney injury THP-1 HK-2 MFHAS1 Aristolochic acid M2 macrophages Survival rate Apoptotic rate
First-authors address: Nanxishan Hospital of Guangxi Zhuang Autonomous Region, Guilin 541002, China
doi:10.3969/j.issn.1674-4985.2020.04.002
急性肾损伤(Acute kidney injury,AKI)是临床最常见的肾病,也是临床危重症[1-3]。中草药成分—马兜铃酸(Aristolochic acid,AA)是导致急性肾损伤的一个很重要的原因,AA肾毒性的分子机制主要是指AA通过影响miRNA、内质网应激、氧化应激而直接或间接地诱导肾脏细胞凋亡[4]。急性肾损伤的危重性,使得研究其发生时的修复机制成为热点。恶性纤维组织细胞瘤扩增序列1(malignant fibrous histiocytoma amplified sequence 1,MFHAS1)属于ROCO蛋白家族成员[5-6],是恶性纤维组织细胞瘤(MFHS)和胃肠道肿瘤的预测癌蛋白[7]。MFHAS1还可以通过raf/mek/erk途径调节红细胞生成[8]。研究发现,MFHAS1具有诱导巨噬细胞极化的作用[9]。Ng等[10]发现敲除巨噬细胞中MFHAS1能提高炎性因子IL-6生成,提示MFHAS1可能参与免疫调节作用。MFHAS1在急性肾损伤中表达情况和作用尚不清楚,本课题假设MFHAS1可通过巨噬细胞的免疫调节作用在急性肾损伤中发挥作用。本课题建立THP-1细胞向M2巨噬细胞诱导系统及巨噬细胞和肾小管上皮细胞系HK-2共培养模型,用AA模拟HK-2细胞急性肾损伤,检测巨噬细胞转染MFHAS1对急性肾损伤的影响及作用机制的研究,现报道如下。
1 材料与方法
1.1 材料 人单核细胞细胞株THP-1、人肾小管上皮细胞(human renal tubular epithelial cells)HK-2购自ATCC;马兜铃酸-Ⅰ(aristolochic acid, AAⅠ)、佛波酯(PMA)、胰蛋白酶Trypsin、四氮唑蓝(MTT)和二甲基亚矾(Dimethyl sulfoxide,DMSO)购自Sigma-Aldrich公司;IL-13购自Peprotech公司;抗Arg1抗体、抗MRC1抗体、抗MFHAS1抗体和抗购自Abcam公司;胎牛血清(fetal bovine serum,FBS)、RPMI-1640培养基、Trizol试剂、Real-time PCR 试剂盒、反转录试剂盒(RT-PCR)购自美国Invitrogen公司;引物和MFHAS1过表达载体购自上海吉玛制药技术有限公司;IL-10 ELISA检测试剂盒(美国Raybio)购自深圳市科润达生物工程有限公司;流式抗体PE-CD86、PE-CD206、双染色流式法细胞凋亡检测试剂盒购自美国BD公司;流式细胞仪购自美国BD公司,光学显微镜、全自动酶标仪及Real-time PCR仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养 用细胞培养液(10% FBS+RPMI 1640培养基+1%青霉素+1%链霉素)培养THP-1和HK-2细胞,于37 ℃ 5% CO2湿度95%培养箱中培养。每天换液1次,每2~3天用Trypsin消化传代。实验前24 h换无血清培养基,培养24 h换培养基为含AAⅠ(40 μg/mL)的培养基,设置空白组(不加AA的培养基),对照组(加AA的培养基)和实验组(加AA及MFHAS1的培养基,即过表达MFHAS1组)。
1.2.2 细胞转染 培养THP-1细胞至对数生长期,用细胞培养液稀释细胞浓度至1×106个/mL,
200 μL/孔接种于6孔板中,细胞培养至基本融合为一层时进行转染。先用无血清OptiMEM培养液稀释脂质体Lipofectamine 2000、MFHAS1的载体,之后取等体积脂质体和载体混匀后室温孵育20 min,将混合液加入到培养好的细胞孔板中,混匀,培养6 h,换完全培养基,转染48 h收集细胞,进行实验。
1.2.3 诱导THP-1细胞分化为M2型巨噬细胞 待THP-1细胞培养至对数生长期,稀释为1×106个/mL,以每孔100 μL接种于6孔板中,向培养液中加入终浓度为10 ng/mL的PMA诱导24 h,使其分化为M0型巨噬细胞。弃培养液,收集细胞,洗涤2遍,加入含终浓度为20 ng/mL IL-13的RPMI 1640培养基,继续培养48 h,诱导其向M2型巨噬细胞极化。
1.2.4 Real-time PCR检测mRNA的表达和M2型巨噬细胞分化指标 按照上述诱导条件处理48 h后的各组细胞,用Trizol试剂提取总RNA,再将RNA反轉录为cDNA,反应程序为37 ℃ 15 min、85 ℃ 5 s;4 ℃ 12 h,测定浓度后超低温冷冻保存。取cDNA按照real-time PCR的说明书进行反应,反应程序为:94 ℃ 5 min;94 ℃ 30 s、56 ℃ 35 s、72 ℃ 35 s,35个循环;72 ℃ 10 min。检测MFHAS1 mRNA表达水平和各组细胞M2巨噬细胞极化标志物Arg1、IL-10和MRC1。β-actin上游引物5-CATCCTGCGTCTGGACCT-3,下游引物5-TCAGGAGCAATGATCTTG-3;MFHAS1上游引物5-CGTGCCCTCAAGATCCTCTG-3,下游引物5-GGTGAGCTGATTGCGACTAAG-3。运用Bio-Rad PCR检测系统进行数据分析,经内参照β-actin进行校正。
1.2.5 流式细胞术检测M2型巨噬细胞表面胞膜分子的改变 将加入IL-13诱导后的细胞孵育60 h,
收集细胞,冷PBS重悬洗涤细胞2次,加入40 μL冷PBS重悬细胞,加入等体积小鼠血清,封闭
30 min去除非特异性结合,加入流式抗体PE-CD86、PE-CD206各5 μL,4 ℃避光反应30 min,冷PBS洗涤3次,加入200 μL PBS,流式细胞仪检测细胞表面胞膜分子的改变。
1.2.6 ELISA检测巨噬细胞培养上清中IL-10的含
量 收集诱导后的巨噬细胞培养液上清,根据试剂盒说明书进行操作,在测定孔中加入测定缓冲液和培养液上清,室温震荡2.5 h,洗板,然后加入生物素标记的抗体,室温震荡1.0 h,洗板,然后加入链霉亲和素溶液,室温震荡45 min,洗板,加入底物,室温避光30 min,酶标仪检测450 nm吸光度值,计算含量。
1.2.7 M2型巨噬细胞和HK-2细胞共培养模型的建立及分组 根据1.2.3的方法,将接种于Transwell上层小室中的THP-1细胞(2×105个/mL)诱导极化为M2型巨噬细胞,诱导结束后,弃上清,细胞洗涤2次,加入无血清培养液;Transwell下层小室中加入培养至对数生长期的HK-2细胞,下层小室再分别加入终浓度为0(培养液对照)和40 μg/mL的AAⅠ。分别设置HK-2细胞组(下层小室:HK-2细胞)、HK-2细胞+M2型巨噬细胞组(下层小室:HK-2细胞,上层小室:M2型巨噬细胞组)、HK-2细胞+马兜铃酸组(下层小室:HK-2细胞+40 μg/mL
AAⅠ)和HK-2细胞+马兜铃酸+M2型巨噬细胞组(下层小室:HK-2细胞+40 μg/mL AAⅠ,上层小室:M2型巨噬细胞组)。
1.2.8 MTT实验测定细胞存活率 收集各组共培养的HK-2细胞,洗涤2遍,稀释后取100μL细胞(2×104个/mL)加入96孔板,每孔加入20 μL(5 g/L)MTT,继续培养4 h后弃去培养液,每孔加入150 μL DMSO,室温振荡5 min,酶标仪测定OD 490 nm处的吸光度(A)值,按照公式存活率(%)=(实验组A均值-阴性对照组A均值)/阴性对照A均值-空白对照A均值)×100%计算存活率。
1.2.9 流式细胞术测定细胞凋亡率 将各组处理后HK-2细胞,以每孔2×107个细胞接种于6孔板中,置于37 ℃ 5% CO2培养箱中培养至融合度为70%~80%,弃去培养液,用PBS缓冲液洗涤2次,用无EDTA的Trypsin消化,离心收集细胞,按照Annexin V/PI试剂盒说明书进行操作,先加100 μL
binding buffer重悬细胞,再加入5 μL Annexin V-FITC和5 μL碘化丙啶(PI)混匀,室温避光反应20 min,加入400 μL binding buffer,用流式细胞仪测定细胞凋亡率。
1.2.10 Western blot检测蛋白表达 将转染后培养48 h的各组巨噬细胞(阴性对照组、空白组、过表达MFHAS1组)进行收集,加入RIPA重悬细胞,超声冰浴破碎,收集蛋白,测定总蛋白浓度。进行SDS-PAGE,然后转膜,室温封闭2 h,加入一抗MFHAS1(1︰200)或抗Arg1抗体(1︰500)、抗MRC1抗体(1︰800),4 ℃孵育过夜,用TBST缓冲液洗膜2次,加入稀释的二抗室温孵育1 h,显影后扫描,以β-actin为内参照,分析蛋白表达水平。
1.3 统计学处理 使用SPSS 21.0统计软件进行分析,计量资料采用(x±s)表示,两组间比较采用t检验,多组间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 转染后巨噬细胞中MFHAS1的表达 结果显示,与阴性对照组相比,过表达MFHAS1组巨噬细胞中MFHAS1的mRNA和蛋白表达量均显著上升(P<0.05)。见图1和表1。
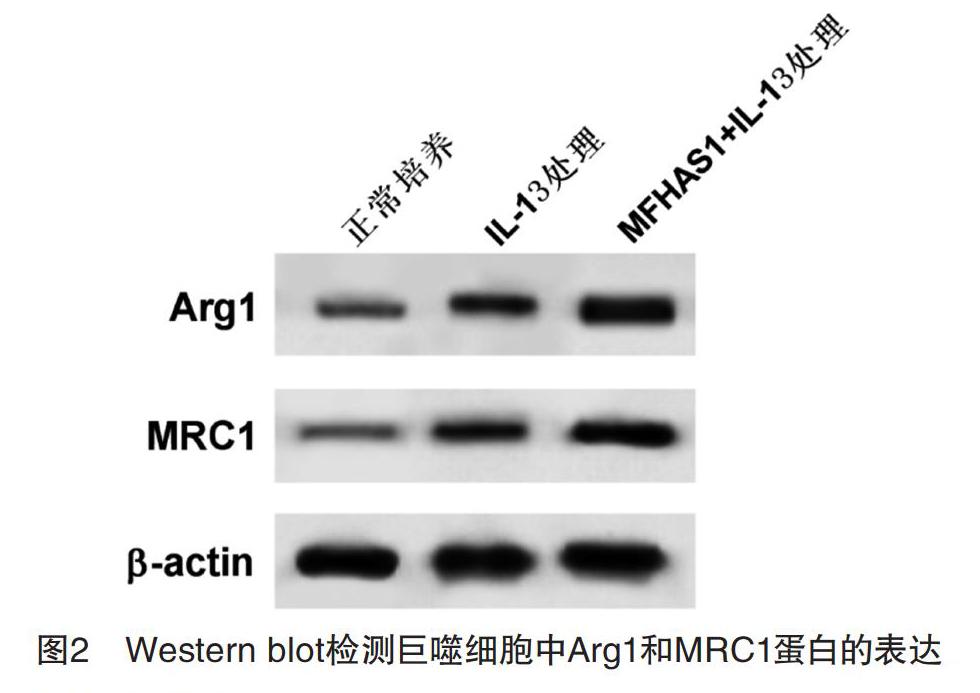
2.2 MFHAS1的表达对巨噬细胞极性转换的影响 Western blot和ELISA結果显示,与正常培养组相比,IL-13处理组巨噬细胞中IL-10和MRC1表达量和Arg1分泌量均显著上升(P<0.05);与IL-13处理组相比,MFHAS1+IL-13处理组巨噬细胞中IL-10和MRC1表达量和Arg1分泌量均显著上升(P<0.05),见图2和表2。说明MFHAS1过表达可促进IL-13诱导巨噬细胞向M2型极化。
2.3 过表达MFHAS1对M2型巨噬细胞表面胞膜分子表达的影响 流式细胞术结果表明,与正常培养组相比,IL-13处理组M2型巨噬细胞表面胞膜分子CD206的表达量显著上升(P<0.05),CD86的表达量无显著变化;与IL-13处理组相比,MFHAS1+IL-13处理组M2型巨噬细胞表面胞膜分子CD86的表达量显著下降(P<0.05),而CD206的表达量显著上升(P<0.05),见表3和图3。说明过表达MFHAS1可促进IL-13诱导巨噬细胞向M2型极化。
2.4 M2型巨噬细胞提高AA处理后HK-2细胞存活率 预实验结果发现,当AA为40 μg/mL浓度时,HK-2细胞的凋亡率较高且没有细胞坏死,因此选40 μg/m AA诱导HK-2细胞凋亡的急性肾损伤模型。MTT结果表明,与HK-2细胞组细胞活力(100%)相比,HK-2细胞+M2型巨噬细胞组HK-2细胞活力(115.68±8.98)%上升,但差异不显著,HK-2细胞+AA组的活力(64.78±5.43)%显著下降(P<0.05);与HK-2细胞+AA组(64.78±5.43)%相比,HK-2细胞+AA+M2型巨噬细胞组细胞活力(88.94±6.82)%显著上升(P<0.05)。说明M2型巨噬细胞能减轻AA对HK-2细胞的毒性,提升细胞活力。
2.5 M2型巨噬细胞可抑制马兜铃酸对HK-2细胞的凋亡诱导作用 流式细胞术结果表明,与HK-2细胞组凋亡率(9.27±0.76)%相比,HK-2细胞+M2型巨噬细胞组HK-2细胞凋亡率(7.52±0.44)%下降,但差异无统计学意义(P>0.05),HK-2细胞+AA组的细胞凋亡率(26.83±3.17)%显著上升(P<0.05);与HK-2细胞+AA组相比,HK-2细胞+AA+M2型巨噬细胞组细胞凋亡率(17.38±2.28)%显著下降(P<0.05),见图4。说明M2型巨噬细胞能抑制AA对HK-2细胞的凋亡诱导作用。
3 討论
近年来,急性肾损伤(AKI)的发病率在逐年增长,含马兜铃酸(AA)的中草药导致的AKI在全球范围广泛存在[11-13]。AA通常会造成肾小管萎缩和间质纤维化,甚至进展为肾衰竭,它主要的靶细胞是肾小管上皮细胞HK-2[14]。研究急性肾损伤的修复机制,也成为临床急性肾损伤基础研究的热点和重点。
研究表明,ROCO蛋白家族成员—MFHAS1具有依赖于TLR(toll like receptor)的潜在免疫调节作用[5,9],TLR2参与全身炎症、心脏功能障碍和急性肾损伤的过程。Chen等[15]研究发现,MFHAS1具有巨噬细胞极化诱导剂的作用,人结直肠癌细胞通过上调MFHAS1诱导肿瘤相关巨噬细胞RAW264.7向M2型巨噬细胞极化。Zhong等[16]研究发现,在人胚胎肾细胞系中,MFHAS1与E3泛素连接酶paraja2形成复合物,促进MFHAS1的泛素化积累,对TLr2介导的JNK/p38通路具有正调节作用,并促进M1巨噬细胞极化、M2到M1巨噬细胞转化和炎症反应。本研究发现,在人单核细胞细胞株THP-1细胞中过表达MFHAS1,在巨噬细胞诱导过程中可促进M2型巨噬细胞极化相关指标Arg1、IL-10和MRC1表达,同时M2型巨噬细胞表面胞膜分子CD206表达量上升,M1型巨噬细胞表面胞膜分子CD86的表达下降,说明THP-1细胞中过表达MFHAS1在巨噬细胞诱导过程中可促进巨噬细胞向M2型极化,本研究结果验证了Chen等[15]关于MFHAS1可作为M2型巨噬细胞极化诱导剂的研究结果。MFHAS1在针对涉及急性肾损伤的作用尚不清楚。
刘权等[17]发现,M2型巨噬细胞能够减轻草酸钙肾结石对肾上皮细胞HK2的损伤凋亡作用,促进HK-2的细胞增殖。有研究表明,骨髓来源的间充质干细胞(MSCs)可通过增加浸润至肾脏的巨噬细胞数量,减少炎性细胞特别是中性粒细胞的数量,从而减轻缺血/再灌注损伤诱导的AKI[18]。本研究通过建立M2型巨噬细胞与AA诱导的HK2细胞共培养模型,进一步实验发现,M2型巨噬细胞能抑制AA对肾上皮细胞HK-2的凋亡诱导作用,提高细胞存活率。证实了MFHAS1在人急性肾损伤中通过促进单核细胞向M2型巨噬细胞的诱导极化,参与AA诱导的AKI的免疫调节过程,减轻病症。
巨噬细胞聚集是慢性马兜铃酸肾病(AAN)的早期特征,而巨噬细胞对AKI的作用通常存在不同观点,上述的研究结果表明巨噬细胞可减轻AKI病症,而Dai等[19]通过建立慢性AAN小鼠模型,证实巨噬细胞是AAN关键的炎症细胞,其通过与TGF-β/Smad3介导的肾纤维化和NF-κB驱动的肾炎症相关的机制,加重慢性AAN进行性肾小管间质损伤。Li等[20]通过建立脓毒症诱导的大鼠AKI模型发现,72 h后明显检测到M2巨噬细胞,M2巨噬细胞耗竭后,肾损伤加重,肾功能下降,M2巨噬细胞通过上调IL-10的表达和抑制TNF-α的分泌来减弱由脓毒症引起的AKI。Geng等[21]研究表明,在体外与MSCs共培养可诱导巨噬细胞向M2型极化,在横纹肌溶解症导致的AKI小鼠模型中,小鼠注射与MSCs共培养获得的M2型巨噬细胞可减轻肾损伤,而注射M0和M1型巨噬细胞则使小鼠AKI损伤加重。M2型巨噬细胞在AKI中的作用机制及其与疾病原因和严重程度是否相关,还需要详细研究。
综上所述,本研究阐述了MFHAS1在AA诱导的AKI中通过促进诱导单核细胞向M2型巨噬细胞极化,积累的M2型巨噬细胞通过抑制AA对HK-2细胞的凋亡诱导作用,提高HK2细胞存活率,减轻AA导致的AKI。本研究为急性肾损伤的临床基础研究提供新的思路和方向。
参考文献
[1]杨莉.急性肾损伤[J].中华检验医学杂志,2011,34(5):476-480.
[2]闻英,席修明.急性肾损伤的流行病学研究进展[J/OL].中华重症医学电子杂志(网络版),2017,3(2):143-147.
[3] Wen Y,Jiang L,Xu Y,et al.Prevalence, risk factors, clinical course, and outcome of acute kidney injury in Chinese intensive care units: a prospective cohort study [J].Chin Med J (Engl),2013,126(23):4409-4416.
[4]涂玥, 万毅刚, 孙伟, 等. 马兜铃酸肾毒性的临床特征、分子机制及治疗策略[J]. 南京中医药大学学报, 2018,34(1):12-18.
[5] Dihanich S.MASL1:a neglected ROCO protein[J].Biochem Soc Trans,2012,40(5):1090-1094.
[6] Sakabe T,Shinomiya T,Mori T,et al.Identification of a novel gene, MASL1, within an amplicon at 8p23.1 detected in malignant fibrous histiocytomas by comparative genomic hybridization[J].Cancer Res,1999,51(3):511-515.
[7] Weng W H,Wejde J,Ahlen J,et al.Characterization of large chromosome markers in a malignant fibrous histiocytoma by spectral karyotyping, comparative genomic hybridization (CGH), and array CGH[J].Cancer Genet Cytogenet,2004,150(1):27-32.
[8] Kumkhaek C,Aerbajinai W,Liu W,et al.MASL1 induces erythroid differentiation in human erythropoietin-dependent CD34+ cells through the Raf/MEK/ERK pathway[J].Blood,2013,121(16):3216-3227.
[9] Zhong J,Shi Q Q,Zhu M M,et al.MFHAS1 Is Associated with Sepsis and Stimulates TLR2/NF-κB Signaling Pathway Following Negative Regulation[J].PLoS One,2015,10(11):e0143662.
[10] Ng A C,Eisenberg J M,Heath R J,et al.Human leucine-rich repeat proteins: a genome-wide bioinformatic categorization and functional analysis in innate immunity[J].Proc Natl Acad of Sci USA,2011,108(Suppl 1):4631-4638.
[11] Jadot I,Declèves A E,Nortier J,et al.An Integrated View of Aristolochic Acid Nephropathy: Update of the Literature[J].Int J Mol Sci,2017,18(2):297.
[12] Arlt V M,Stiborova M,Schmeiser H H.Aristolochic acid as a probable human cancer hazard in herbal remedies: a review[J].Mutagenesis,2002,17(4):265-277.
[13] Debelle F D,Vanherweghem J L,Nortier J L.Aristolochic acid nephropathy:a worldwide problem[J].Kidney Int,2008,74(2):158-169.
[14]陈文,谌贻璞,李安,等.马兜铃酸肾病的临床与病理表现[J].中华医学杂志,2001,81(18):1101-1105.
[15] Chen W,Xu Y,Zhong J,et al.MFHAS1 promotes colorectal cancer progress by regulating polarization of tumor-associated macrophages via STAT6 signaling pathway[J].Oncotarget,2016,7(48):78726-78735.
[16] Zhong J,Wang H,Chen W,et al.Ubiquitylation of MFHAS1 by the ubiquitin ligase praja2 promotes M1 macrophage polarization by activating JNK and p38 pathways[J].Cell Death Dis,2017,8(5):e2763.
[17]刘权,关晓峰,陶芝伟,等.M2型巨噬细胞对草酸钙晶体刺激肾小管上皮细胞损伤的影响[J].广东医学,2018,38(3):331-335.
[18]胡婕,张利,崔少远,等.间充质干细胞通过调节天然免疫系统减轻急性肾损伤的机制研究[J].中华危重病急救医学,2016,28(3):235-240.
[19] Dai X Y,Huang X R,Li Z,et al.Targeting c-fms kinase attenuates chronic aristolochic acid nephropathy in mice[J].Oncotarget,2016,7(10):10841-10856.
[20] Li X,Mu G,Song C,et al.Role of M2 Macrophages in Sepsis-Induced Acute Kidney Injury[J].SHOCK,2018,50(2):233-239.
[21] Geng Y,Zhang L,Fu B,et al.Mesenchymal stem cells ameliorate rhabdomyolysis-induced acute kidney injury via the activation of M2 macrophages[J].Stem Cell Res Ther,2014,5(3):80.
(收稿日期:2019-08-22) (本文編辑:周亚杰)
