乙酰紫草素联合奥沙利铂对人结肠癌HT29 细胞增殖及凋亡的影响
2020-04-29赵景明李国峰
赵景明,李 惠,李国峰
(长春中医药大学附属医院,吉林 长春 130000)
结肠癌为消化道高发肿瘤,致死率高居恶性肿瘤的第2 位[1],该疾病早期症状不明显,多数患者确诊时即为晚期,失去了手术的最佳时机,化疗是主要治疗手段,但其较大的毒副作用及耐药性而难以让人满意[2]。乙酰紫草素为紫草主要活性成分,对黑色素瘤B16F10、骨肉瘤S180、Lewis 肺癌及胃癌细胞SGC-7901 等均有较好的抑制作用[3-6]。研究发现,中药联合化疗药物能提高抗肿瘤疗效,显著降低化疗药物的毒副作用[7],因此,本研究探讨乙酰紫草素联合奥沙利铂对人结肠癌HT29 细胞增殖及凋亡的影响。
1 材料
1.1 试剂与药物 乙酰紫草素(成都德思特生物技术有限公司,批号20160518,纯度>98%);奥沙利铂(美国Sigma 公司,批号20160608);MTT检测试剂盒(美国Sigma 公司,批号20160921);Annexin V-FITC /PI(上海翊圣生物科技有限公司,批号 40302ES60);逆转录试剂盒(批号20161125)、实时定量PCR 检测试剂盒(批号20160917)(日本TaKaRa 公司);p-PI3K(批号ab32089)、p-Akt(批号ab38449)、GAPDH 抗体(批号ab8245)购自英国Abcam 公司。
1.2 细胞 人结肠癌HT29 细胞,来源于中国科学院上海细胞库。
1.3 仪器 WD-2102A 型全自动酶标仪(北京六一仪器厂);FACS Canto II 流式细胞仪(美国BD公司);ABI 7500 快速实时荧光定量PCR 仪(美国ABI 公司);EBX-700 蛋白电泳转印系统(上海书俊仪器设备有限公司)。
2 方法
2.1 细胞增殖抑制率检测 常规条件下,将HT29 细胞培养至对数生长期,调整细胞浓度为1×105/mL,以每孔200 μL 接种于96 孔细胞培养板中,分为空白组、乙酰紫草素组(10 μmol/L)、奥沙利铂组(1 μmol/L)和联合给药组(10 μmol/L 乙酰紫草素+1 μmol/L 奥沙利铂),各组的药物剂量设置依据于徐锦程[8]、薛德冬等[9]报道,并结合预实验。细胞培养箱中培养24 h,弃去培养液,加入含有相应终浓度药物的完全培养基处理24、48、72 h,测定490 nm 处光密度值(OD),细胞增殖抑制率=(1-OD给药组/OD空白组)×100%。
2.2 细胞凋亡率检测 常规条件下,将HT29 细胞培养至对数生长期,以每孔1×106个细胞接种于6 孔细胞培养板中,分为空白组、乙酰紫草素组(10 μmol/L)、奥沙利铂组(1 μmol/L)和联合给药组(10 μmol/L 乙酰紫草素+1 μmol/L 奥沙利铂),细胞培养箱中培养24 h,弃去培养液,加入含有相应终浓度药物的完全培养基继续培养48 h。4 ℃下离心收集细胞,并在预冷的磷酸盐缓冲液中重悬细胞,加入5 μL Annexin V-FITC /PI 溶液,避光孵育20 min 后在流式细胞仪中检测,Cell Quest 软件分析细胞凋亡率。
2.3 细胞凋亡相关基因检测 按“2.2”项下方法处理细胞后收集,TRIzol 提取细胞总RNA,逆转录法获取cDNA,实时定量PCR 反应体系为6 μL蒸馏水、2 μL cDNA、1 μL 正向引物、1 μL 反向引物、10 μL 2×SYBR Green Mix。采用2-△△Ct法,以GAPDH 为内参基因,引物由上海基尔顿生物公司合成,序列见表1。

表1 引物序列Tab.1 Primer sequences
2.4 细胞PI3K/Akt 通路相关蛋白检测 按“2.2”项下方法处理细胞后收集,加入适量RIPA裂解液提取细胞总蛋白。BCA 法测定细胞总蛋白浓度,确定蛋白上样量后,经12% SDS-PAGE 凝胶电泳,半干法转印至PVDF 膜上,加入稀释后的p-PI3K、p-Akt 及GAPDH 抗体(均为1∶2 000),4 ℃下孵育过夜,加入对应二抗,室温下孵育0.5 h。洗膜后显色、曝光、拍照,分析各条带光密度值,并计算蛋白相对表达量。
2.5 统计学分析 采用SPSS 17.0 软件进行处理。计量资料以(±s)表示,多组间比较采用单因素方差分析,两两比较采用Bonferroni 法。以P<0.05表示差异具有统计学意义。
3 结果
3.1 乙酰紫草素联合奥沙利铂对HT29 细胞增殖的影响 HT29 细胞经乙酰紫草素、奥沙利铂和联合给药处理24、48、72 h 后,细胞增殖抑制率均增加(P<0.05);与乙酰紫草素组比较,奥沙利铂组的细胞增殖抑制率增加(P<0.05);联合给药组的细胞增殖抑制率高于乙酰紫草素组及奥沙利铂组(P<0.05)。见表2。
表2 乙酰紫草素联合奥沙利铂对HT29 细胞增殖的影响(±s,n=5)Tab.2 Effect of acetyl shikonin combined with oxaliplatin on HT29 cell proliferation(±s,n=5)
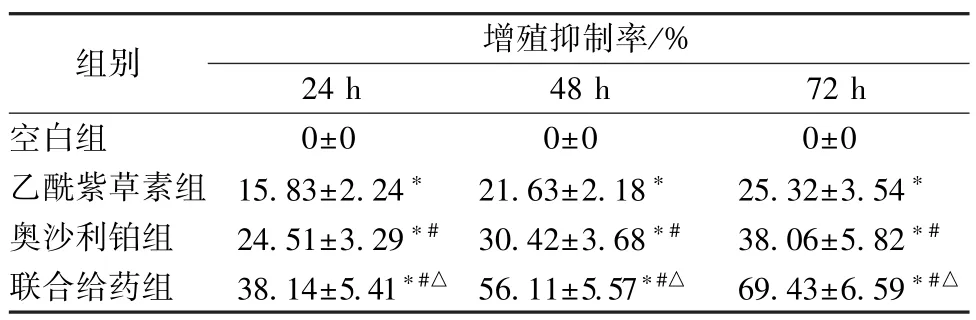
表2 乙酰紫草素联合奥沙利铂对HT29 细胞增殖的影响(±s,n=5)Tab.2 Effect of acetyl shikonin combined with oxaliplatin on HT29 cell proliferation(±s,n=5)
注:与空白组比较,∗P<0.05;与乙酰紫草素组比较,#P<0.05;与奥沙利铂组比较,△P<0.05。
3.2 乙酰紫草素联合奥沙利铂对HT29 细胞凋亡率的影响 HT29 细胞经乙酰紫草素、奥沙利铂和联合给药处理48 h 后,细胞凋亡率均增加(P<0.05);与乙酰紫草素组比较,奥沙利铂组的细胞凋亡率增加(P<0.05);联合给药组的细胞凋亡率高于乙酰紫草素组及奥沙利铂组(P<0.05)。见图1。
3.3 乙酰紫草素联合奥沙利铂对HT29 细胞Ki-67、Bcl-2 及BaxmRNA 表达的影响 HT29 细胞经乙酰紫草素、奥沙利铂和联合给药处理48 h 后,BaxmRNA 表达增加,而Ki-67、Bcl-2 mRNA 表达降低(P<0.05);与乙酰紫草素组比较,奥沙利铂组BaxmRNA 表达增加,而Ki-67、Bcl-2 mRNA 表达降低(P<0.05);联合给药组对BaxmRNA 表达的促进作用,Ki-67、Bcl-2 mRNA 表达的抑制作用最强(P<0.05)。见表3。
表3 乙酰紫草素联合奥沙利铂对HT29 细胞Ki-67、Bcl-2及Bax mRNA 表达的影响(±s,n=5)Tab.3 Effects of acetyl shikonin combined with oxaliplatin on the mRNA expressions of Ki-67,Bcl-2 and Bax in HT29 cells(±s,n=5)
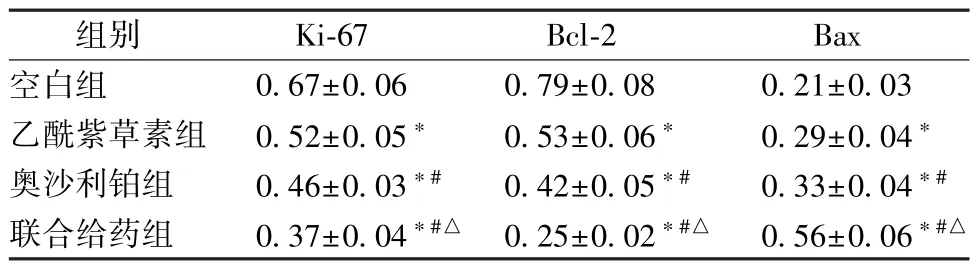
表3 乙酰紫草素联合奥沙利铂对HT29 细胞Ki-67、Bcl-2及Bax mRNA 表达的影响(±s,n=5)Tab.3 Effects of acetyl shikonin combined with oxaliplatin on the mRNA expressions of Ki-67,Bcl-2 and Bax in HT29 cells(±s,n=5)
注:与空白组比较,∗P<0.05;与乙酰紫草素组比较,#P<0.05;与奥沙利铂组比较,△P<0.05。
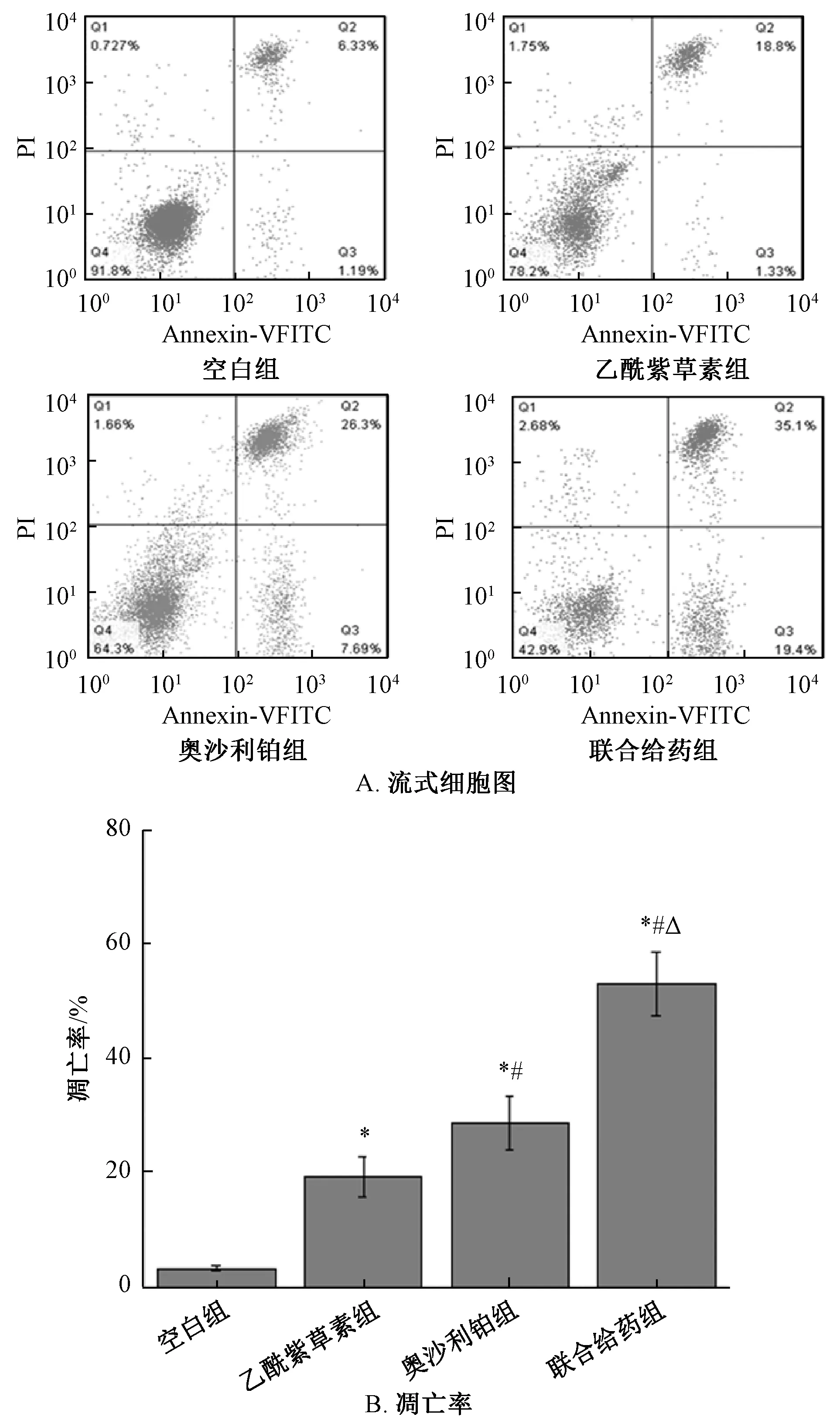
图1 乙酰紫草素联合奥沙利铂对HT29 细胞凋亡率的影响(±s,n=5)Fig.1 Effect of acetyl shikonin combined with oxaliplatin on HT29 cell apoptosis rate(±s,n=5)
3.4 乙酰紫草素联合奥沙利铂对HT29 细胞PI3K/Akt 信号通路的影响 人结肠癌HT29 细胞经乙酰紫草素、奥沙利铂和联合给药处理48 h 后,p-PI3K、p-Akt 蛋白表达均降低(P<0.05);与乙酰紫草素组比较,奥沙利铂组的p-PI3K、p-Akt 蛋白表达降低(P<0.05);联合给药组的p-PI3K、p-Akt 蛋白表达均低于乙酰紫草素组及奥沙利铂组(P<0.05)。见图2、表4。
4 讨论
随着人们摄入膳食纤维和碳水化合物减少,脂肪增加,结肠癌的发病率逐年递增[10]。乙酰紫草素存在于紫草科植物紫草的根中,可以抑制人结肠癌HCT116 细胞的增殖并诱导其凋亡,但关于该成分与化疗药物的联合使用未见报道[9]。本研究发现,与空白组比较,乙酰紫草素组、奥沙利铂组及联合给药组细胞增殖抑制率均明显增加,以联合给药组更明显。
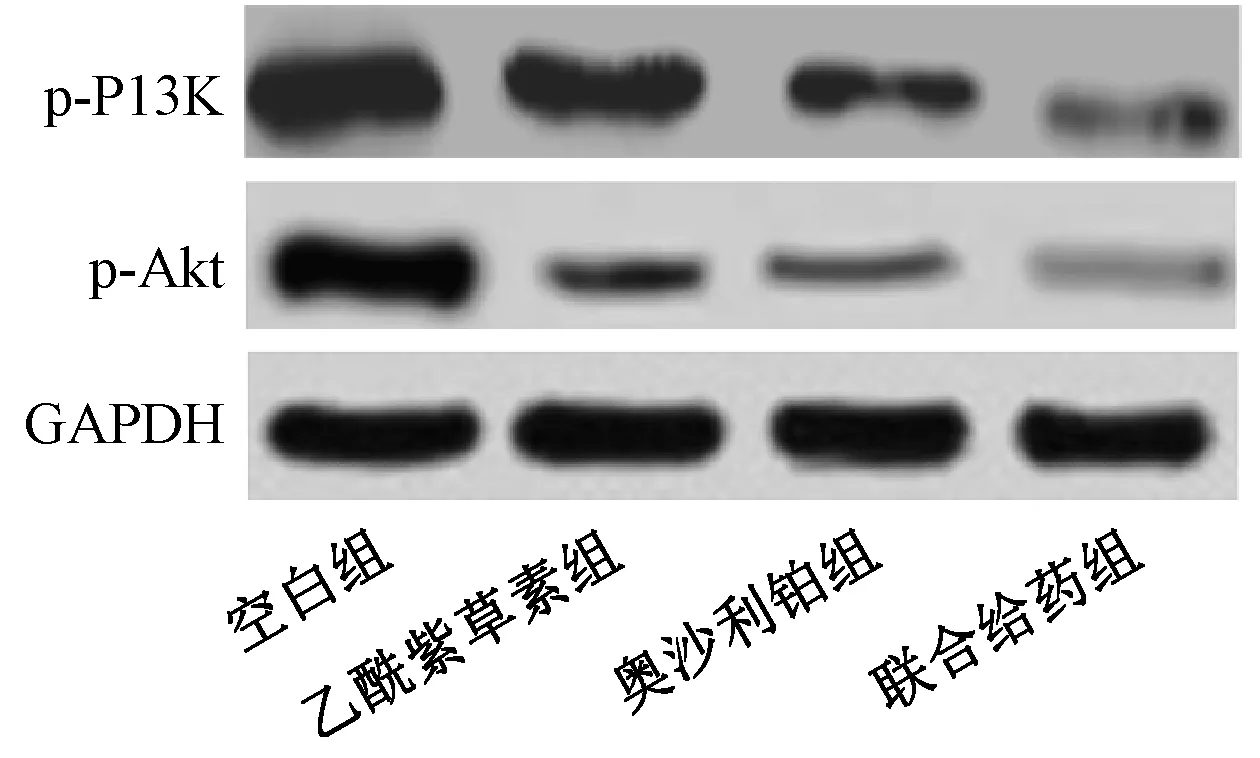
图2 Western blot 检测HT29 细胞p-PI3K、p-Akt 蛋白表达Fig.2 Expressions of p-PI3K and p-Akt protein in HT29 cells detected by Western blot
表4 乙酰紫草素联合奥沙利铂对HT29 细胞PI3K/Akt 信号通路相关蛋白表达的影响(±s,n=5)Tab.4 Effects of acetyl shikonin combined with oxaliplatin on the expressions of PI3K/Akt signaling pathwayrelated proteins in HT29 cells(±s,n=5)

表4 乙酰紫草素联合奥沙利铂对HT29 细胞PI3K/Akt 信号通路相关蛋白表达的影响(±s,n=5)Tab.4 Effects of acetyl shikonin combined with oxaliplatin on the expressions of PI3K/Akt signaling pathwayrelated proteins in HT29 cells(±s,n=5)
注:与空白组比较,∗P<0.05;与乙酰紫草素组比较,#P<0.05;与奥沙利铂组比较,△P<0.05。
肿瘤的形成除了与细胞增殖失控有关外,死亡过程受阻也是重要原因[11],因此,可以通过抑制细胞分裂、增殖,以及诱导细胞凋亡达到预期治疗效果。Ki-67 在多种肿瘤组织中呈现高表达,是评价肿瘤细胞凋亡水平的重要指标[12];Bcl-2 家族蛋白成员间的相互作用在调控肿瘤细胞凋亡过程中也发挥着关键性作用,存在于胞浆或线粒体外膜的促凋亡蛋白Bax 与抗凋亡蛋白Bcl-2 结合后可以激活caspase 途径,最终促进肿瘤细胞凋亡的发生[13]。本研究发现,联合给药组细胞凋亡率、BaxmRNA表达高于乙酰紫草素组和奥沙利铂组,而Ki-67、Bcl-2 mRNA 表达更低。
在细胞的凋亡和增殖过程中,PI3K/Akt 信号通路均发挥重要作用,在肿瘤组织和肿瘤细胞中异常激活[14],p-PI3K 及p-Akt 表达均明显升高[15]。研究[16]表明,抑制PI3K/Akt 信号通路的活化是多种化疗药物的共同机制;胡泽成等[17]报道,青龙衣多糖在体外可直接杀伤或抑制人结肠癌HCT-116细胞,其作用机制与抑制PI3K/Akt 信号通路的活化有关;本研究也发现,与空白组比较,乙酰紫草素组、奥沙利铂组及联合给药组细胞p-PI3K、p-Akt 蛋白表达均明显降低,以联合应用组更明显。
综上所述,乙酰紫草素和奥沙利铂对人结肠癌HT29 细胞均具有抑制增殖及诱导凋亡作用,可能与调控PI3K/Akt 信号通路有关,而且两者联合作用时效果更好。
