盐单胞菌H17降解苯酚的响应面法优化及动力学*
2020-04-27母显杰丁舒心赵娜娜丁晓宇许继飞
母显杰 丁舒心 赵娜娜 丁晓宇 许继飞
(内蒙古大学生态与环境学院,内蒙古环境污染控制与废物资源化重点实验室,内蒙古 呼和浩特 010021)
苯酚是造纸、纺织和煤化工等产业的重要原料[1],其作为一种原生质毒物,随工业废水排放到环境中[2-3],对生态环境和人类健康产生危害,如水生生物大量死亡、人类肝功能及肾功能受损等[4]。美国环境保护署已把苯酚列为优先控制污染物并对其含量提出严格控制要求[5-6]。印染、造纸及石油加工等工业废水中不仅含有苯酚,还含有大量盐分,这大大提高了含酚废水的处理难度[7]。
目前对于高盐含酚废水的处理方法主要有生物降解、吸附、光催化和电化学氧化[8-11],生物降解以其经济、高效、无二次污染而被广泛采用[12]。由于高盐环境会抑制微生物的生长,使一般的苯酚降解菌处理高盐含酚废水效果并不明显,这大大限制了生物技术在高盐含酚废水处理中的应用。嗜盐苯酚降解菌能在高盐条件下良好生长,直接降解苯酚,克服一般菌株在高盐条件无法高效降解苯酚这一难题[13]52。以往对嗜盐苯酚降解菌的降解性能研究主要集中在10%盐度以下,且菌株对于高盐含酚废水的处理效果不佳。GAYATHRI等[14]分离的嗜盐菌菌群在5%盐度下,仅能完全降解50 mg/L的苯酚;王丽娟等[15]分离的芽孢杆菌(Bacillussp.)CCZU-R6只能耐受11%盐度,在此盐度下对500 mg/L苯酚的降解率不到10%。本研究所用的盐单胞菌(Halomonassp.)H17(以下简称为H17)能在0~20%盐度下有效降解200 mg/L苯酚,与其他菌株相比更具应用价值。生物降解特性受多种因素影响,包括碳源、底物浓度、温度、pH、盐度等条件[16],因此优化相关条件对提升降解效率尤为重要。传统的单因素实验不能确定各因素的主次,而响应面法可以在较少的试验次数下预测各因素之间的交互作用,优化试验条件,提高降解效率[17-18]。本研究以H17为研究对象,在单因素试验的基础上,利用响应面法优化该菌株降解苯酚试验条件,并对降解过程进行动力学拟合,以期为高盐含酚废水的生物处理提供参考。
1 材料与方法
1.1 菌株来源
H17从巴丹吉林盐湖的表层沉积物中筛选所得,实验室冷藏保存。
1.2 培养基和试剂
HM培养基[13]52:MgSO4·7H2O 1.00 g、NaCl 100.00 g、KCl 2.00 g、NaBr 0.23 g、NaHCO30.06 g、FeCl3·7H2O 0.05 g、CaCl2·2H2O 0.36 g、葡萄糖1.00 g、酵母提取物1.00 g、蛋白胨0.50 g、琼脂15.00 g,pH为7.0~7.2。该培养基用于菌株培养及分离。
改良Gibbons培养基[19]:K2HPO40.65 g、柠檬酸三钠 3.00 g、MgSO4·7H2O 0.10 g、MnSO4·H2O 0.02 g、NaCl 10.00 g、Fe2(SO4)30.005 g、(NH4)2SO41.00 g、CaCl20.05 g、KH2PO40.50 g、酵母提取物0.20 g、胰蛋白胨0.20 g,添加过滤灭菌的苯酚,pH为8.0。
1.3 试验方法
1.3.1 环境条件对H17降解苯酚的影响
菌悬液以5%(体积分数,下同)接种量接种于苯酚初始质量浓度200 mg/L的改良Gibbons培养基中,在不同温度(15、20、25、30、35 ℃)、pH(5.0、6.0、7.0、8.0、9.0)和葡萄糖质量浓度(0、0.4、0.8、1.2、1.6、2.0 g/L)等条件下165 r/min振荡培养,60 h后取样分析苯酚降解率,每组试验设置3个重复。
1.3.2 优化试验设计
根据单因素试验结果将温度、pH及葡萄糖浓度作为响应面试验自变量,以60 h苯酚降解率为响应值,利用响应面法中Box-Behnken设计试验,通过试验数据拟合响应面模型,确定最优降解条件并进行验证。
1.3.3 降解苯酚动力学研究
在最佳培养条件下,将菌悬液以5%接种量接种于苯酚初始质量浓度分别为0、100、200、400、600、800 mg/L的改良Gibbons培养基中,于30 ℃、pH=8.0、葡萄糖质量浓度0.8 g/L下165 r/min振荡培养,间隔6 h取样,分析苯酚降解速率。
1.4 分析方法
采用紫外分光光度法,测定稀释样在270 nm波长处的光吸收值,参照苯酚标准曲线计算苯酚浓度,并计算苯酚降解率。
采用紫外分光光度法,测定菌液在600 nm波长处的光吸收值,以此来表示菌体的生物量,再据此计算菌体细胞浓度[20]。
Haldane模型用于描述底物既是反应基质、又是抑制剂的生物降解过程[21]。因此,本研究选择Haldane模型(见式(1))分析不同苯酚初始浓度下H17对苯酚的降解速率。
(1)
式中:μ为微生物比生长速率,h-1;μmax为最大比降解速率,h-1;Cs为底物初始质量浓度,mg/L;Ks为饱和常数,mg/L;Ki为抑制常数,mg/L。
2 结果与分析
2.1 温度对H17降解苯酚的影响
当pH为8.0、葡萄糖质量浓度为0.8 g/L时,温度对H17降解苯酚的影响如图1所示。温度为15~35 ℃时,H17对苯酚的降解率变化呈抛物线型,在30 ℃时苯酚降解率达到最大值(72.03%),温度低于或高于30 ℃时,该菌株对苯酚的降解能力均下降,表明H17在30 ℃下能较好降解苯酚。温度影响酶促反应的速率,在最适温度范围内反应速率随温度的升高而加快,但温度过高会使酶变性失活[22],从而抑制菌株降解苯酚的效率。
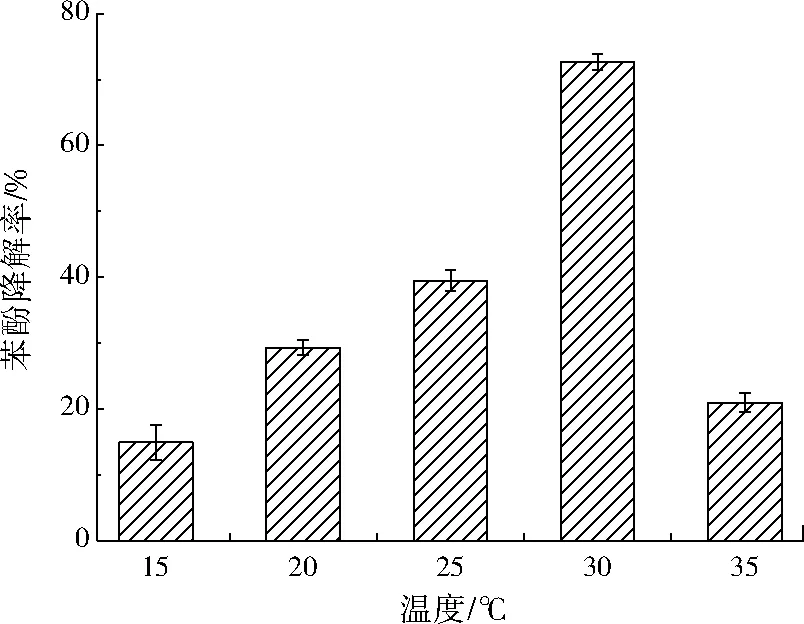
图1 温度对H17降解苯酚的影响Fig.1 Effect of temperature on phenol degradation by H17
2.2 pH对H17降解苯酚的影响
当温度为30 ℃、葡萄糖质量浓度为0.8 g/L时,pH对H17降解苯酚的影响如图2所示。pH为7.0~8.0时,该菌株能较好降解苯酚,苯酚降解率为70%左右,而在强酸强碱条件下,菌株对苯酚的生物降解作用受到抑制,可能是因为强酸强碱条件影响生物体内酶的稳定性和苯酚化学毒性,从而改变底物分子和酶结合[23],影响到H17对苯酚的降解。

图2pH对H17降解苯酚的影响Fig.2 Effect of pH on phenol degradation by H17
2.3 葡萄糖浓度对H17降解苯酚的影响
当温度为30 ℃、pH为8.0时,葡萄糖质量浓度对H17降解苯酚的影响如图3所示。在改良Gibbons培养基中加入一定葡萄糖对该菌株降解苯酚的能力有明显的促进作用。当葡萄糖质量浓度为0.8 g/L时,该菌株对苯酚的降解率达到了最大值(72.91%),远远高于不添加葡萄糖时的苯酚降解率。当葡萄糖质量浓度大于0.8 g/L时,随着葡萄糖浓度的升高,苯酚降解率呈现下降趋势,这可能是由于葡萄糖浓度过高,导致H17优先利用葡萄糖,从而降低苯酚利用率,这与周倩倩等[24]的研究结果基本一致。

图3 葡萄糖质量浓度对H17降解苯酚的影响Fig.3 Effect of glucose mass concentration on phenol degradation by H17
2.4 响应面法对H17降解苯酚条件的优化
2.4.1 响应面优化试验结果
根据Box-Behnken设计试验,以温度、pH和葡萄糖浓度作为影响H17降解苯酚的3个因素,设计了3因素3水平的响应面分析试验,试验因素与水平见表1,试验设计及结果见表2。

表1 响应面试验因素与水平
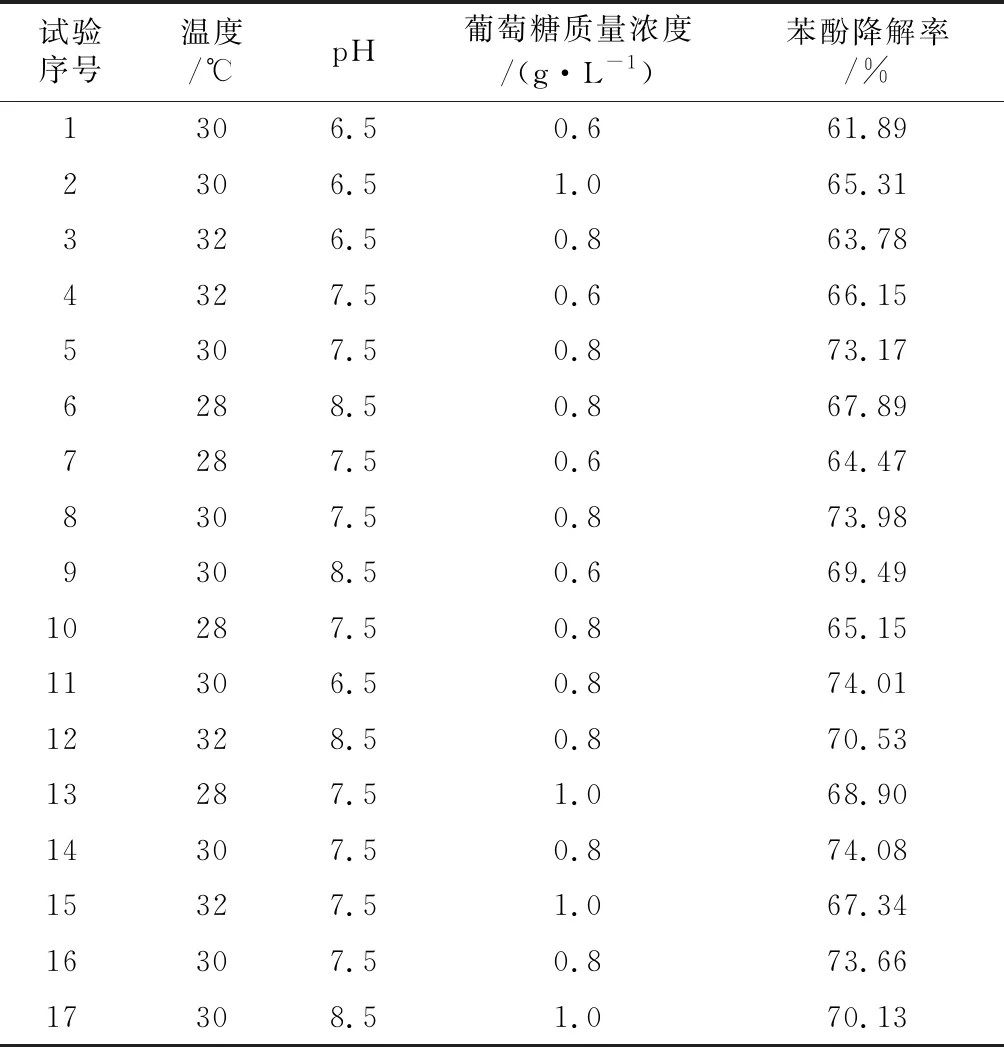
表2Box-Behnken试验设计及H17对苯酚的降解率实测值
2.4.2 模型的建立及显著性分析
利用软件Design Expert 8.0.5对表2中的数据进行回归拟合,以苯酚降解率(Y,%)为响应值,得到的编码方程模型见式(2)。
Y=73.78+0.17A+2.74B+1.21C+AB-0.81AC-0.70BC-3.47A2-3.48B2-3.60C2
(2)
式中:A为温度,℃;B为pH;C为葡萄糖质量浓度,g/L。
由表3可知,编码方程模型的p<0.000 1,说明该模型极显著。模型失拟项p为0.123 3,p>0.05,模型失拟项不显著,表明试验结果与数学模型拟合良好。模型决定系数为0.991 8,表明pH、葡萄糖浓度和温度对H17降解苯酚的影响占99.18%,说明模型的相关度较好,可用于该菌株降解苯酚最佳降解条件的优化。分析可得,对H17降解苯酚产生影响的3个因素排序为pH>葡萄糖浓度>温度。
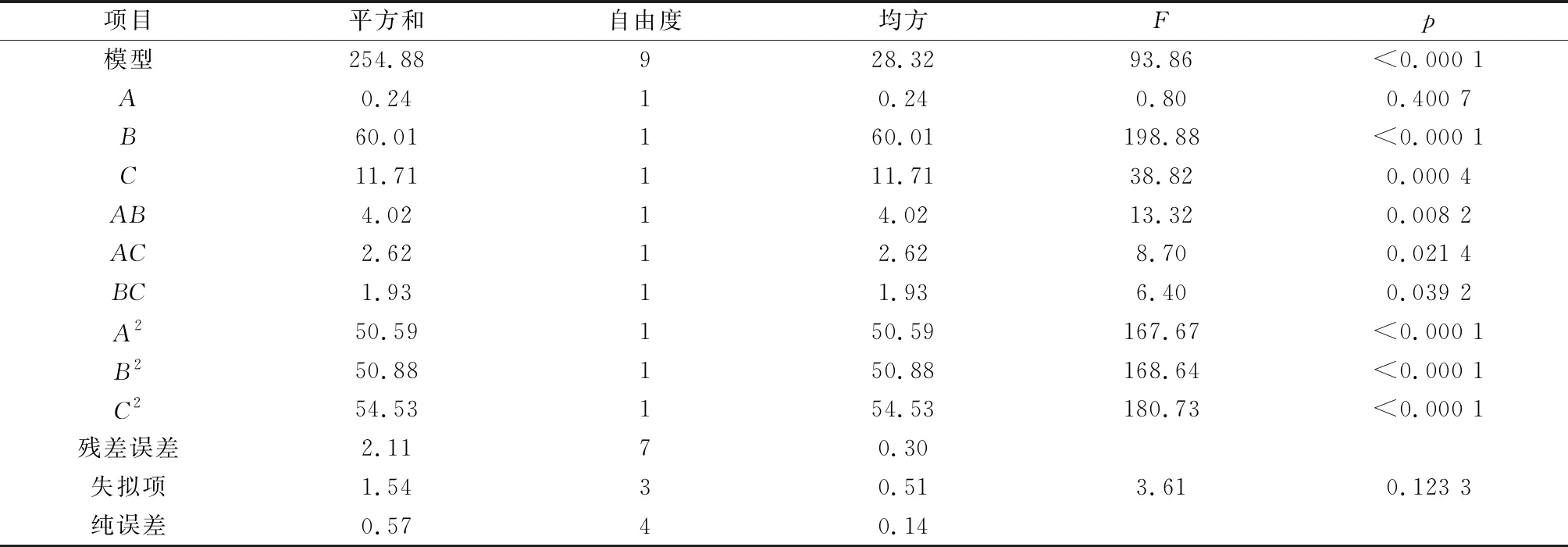
表3Box-Behnken试验回归分析结果
2.4.3 响应面分析及最优条件的确定
各因素对响应值的影响可能不是简单的线性关系而是存在极值点,响应曲面图可直观反映各因素之间的相互作用[25]。等高线可以反映出两因素的交互作用是否显著,等高线呈椭圆形表示两个因素之间的作用显著,等高线呈圆形则表示两因素之间的作用不显著[26-27]。由图4至图6可知,随着温度、pH、葡萄糖浓度升高,苯酚降解率均呈现先升高后降低的趋势。pH与葡萄糖浓度、pH与温度、葡萄糖浓度与温度之间的交互作用均显著。
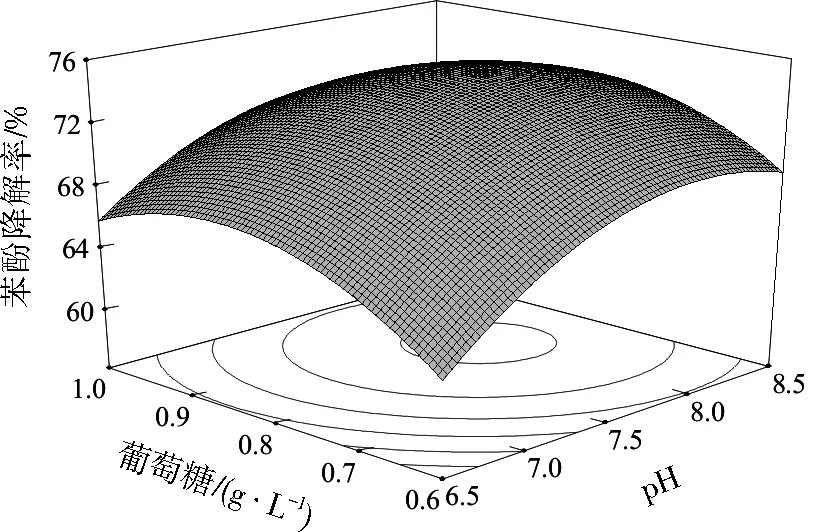
图4 葡萄糖质量浓度与pH对苯酚降解率影响的响应曲面Fig.4 Response surface of glucose mass concentration and pH on the phenol degradation efficiency
通过对试验模型以及响应面分析,获得H17降解苯酚的最佳条件为温度30 ℃、pH=8.0和葡萄糖质量浓度0.8 g/L,在此条件下苯酚降解率的预测值为74.39%。
2.4.4 模型验证
为了检验模型预测的准确性,在预测的最佳条件下进行苯酚降解试验,将H17接种在含苯酚200mg/L的改良Gibbons培养基中,165 r/min培养60 h,得到的苯酚降解率为73.92%,与预测值74.39%偏差很小,表明该模型可有效优化和预测该菌株降解苯酚的条件。可见,响应面法优化得到的降解条件准确,可为高盐含酚废水处理提供依据。
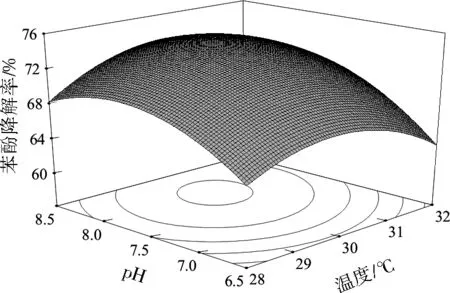
图5pH与温度对苯酚降解率影响的响应曲面Fig.5 Response surface of pH and temperature on the phenol degradation efficiency
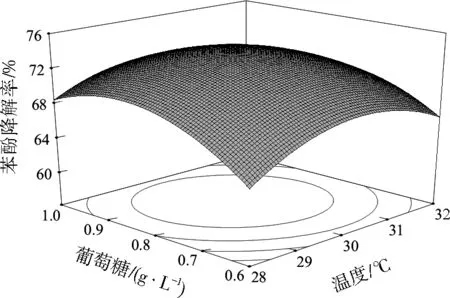
图6 葡萄糖质量浓度与温度对苯酚降解率影响的响应曲面Fig.6 Response surface of glucose mass concentration and temperature on the phenol degradation efficiency
2.5 H17降解苯酚动力学
H17比生长速率与苯酚初始质量浓度之间的关系如图7所示,符合Haldane模型(相关系数为0.998 0),H17降解苯酚的最大比降解速率、饱和常数和抑制常数分别为0.35 h-1、165.91 mg/L和460.13 mg/L。通过方程求导得出最大比生长速率所对应的苯酚初始质量浓度为276 mg/L,即该菌株降解苯酚的最适初始质量浓度。从图7可知,当苯酚初始质量浓度为0~276 mg/L时,随着苯酚初始浓度增大,H17的比生长速率随之提高;当苯酚初始质量质量浓度大于276 mg/L时,其比生长速率随苯酚初始浓度增大呈下降趋势,出现底物抑制作用,这主要是因为苯酚浓度过高抑制了菌株同化作用,降低了菌体比生长速率[28]。
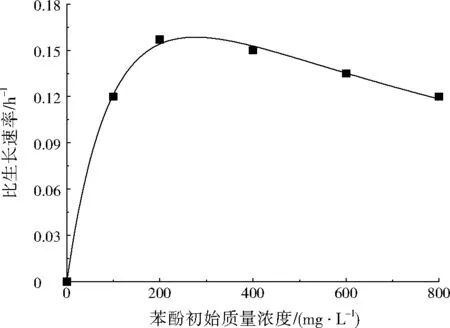
图7H17苯酚降解动力学Fig.7 Phenol degradation kinetics of H17
抑制常数能反映底物对菌株抑制作用的大小,其值越大,菌株耐受的底物浓度越大[29]。H17的抑制常数(460.13 mg/L)明显大于SINGH等[30]报道的苯酚降解菌粘鞭霉菌(Gliomastixindicus)MTCC 3869(43.28 mg/L)和葛启隆等[31]所报道的Diaphorobactersp. PDB3(146.72 mg/L),表明H17对苯酚有较强的耐受能力。
3 结 论
(1) 温度、pH和葡萄糖浓度对H17降解苯酚均有显著影响,响应面法确定的H17降解苯酚最优条件为pH=8.0、温度30 ℃、葡萄糖质量浓度0.8 g/L,苯酚实际降解率可达73.92%。
(2) H17对苯酚的降解动力学符合Haldane模型,其最大比降解速率、饱和常数和抑制常数分别为0.35 h-1、165.91 mg/L和460.13 mg/L。
