ZICI、UCP1、LEP 基因在成年水牛和黄牛肌肉和脂肪组织中的表达模式比较
2020-04-22刘晓妍朱锐锐亐开兴魏雪锋黄洁萍
刘晓妍,冯 雪,朱锐锐,亐开兴,魏雪锋,马 云,3,黄洁萍*
(1.信阳师范学院生命科学学院,河南信阳 464000;2.云南省草地动物科学研究院,云南昆明 650212;3.宁夏大学农学院,宁夏银川 750000)
脂肪分布于哺乳动物身体各处,按沉积部位可分为皮下脂肪、内脏脂肪和肌内脂肪。不同部位的脂肪沉积存在差异,特别是肌内脂肪,受遗传(品种)、营养和饲养管理等因素影响[1-2]。按功能可将脂肪组织分为白色脂肪(White Adipose Tissue,WAT)、米色脂肪和棕色脂肪(Brown Adipose Tissue,BAT)[3]。其中,WAT 主要用于存储多余的能量,BAT 可燃烧脂肪产生热能,米色脂肪为由WAT 棕色化得到,功能与BAT 类似。在人和小鼠中,BAT、米色脂肪可用于抵御肥胖[4-7];在新生家畜中,BAT 与米色脂肪燃烧产热与新生个体存活率相关[8-12];而在成年家畜中,BAT、米色脂肪燃烧产热即为能量损失,对其育肥不利[13-14]。另外,BAT、米色脂肪与家畜耐寒性能相关[15-16]。人们普遍认为黄牛比水牛耐寒[17],但目前缺乏分子层面的证据。我国水牛历史上以役用为主,脂肪沉积较黄牛差[18],这是由遗传因素或是饲养管理因素决定的,目前还缺乏相关报道。
本研究通过比较3 类脂肪标志基因(BAT 标志基因ZIC1、米色脂肪标志基因UCP1、WAT 标志基因LEP)在育肥水牛、育肥黄牛和未育肥水牛之间的表达模式,评估水牛和黄牛脂肪沉积的差异、WAT 棕色化水平的差异以及育肥因素对水牛不同部位脂肪沉积的影响。本研究将增加对水牛和黄牛不同部位脂肪组织特征的认识,提供水牛与黄牛在耐寒性上存在差异的分子证据。
1 材料与方法
1.1 实验材料与样品采集 实验动物分为3 组,即育肥黄牛、育肥水牛、未育肥水牛,每组3 头牛。育肥黄牛为36 月龄的夏南牛(公牛),来自于河南泌阳夏南牛场;育肥水牛和未育肥水牛为36 月龄的槟榔江水牛(公牛),来自于云南腾冲槟榔江水牛育肥场。24 月龄前,所有牛均按标准饲养管理规范进行饲养;24 月龄开始进行为期一年的育肥,按标准饲喂精料,粗饲料和水自由采食;未育肥水牛组不饲喂精饲料,但粗饲料和水自由采食。36 月龄进行屠宰,屠宰后尽快采集背最长肌、背部皮下脂肪和肾周脂肪组织。采集的样品迅速标记好投入液氮中,带回实验室,于-80℃冰箱保存备用。屠宰时,育肥黄牛和育肥水牛均具有明显的皮下脂肪和内脏脂肪沉积,未育肥水牛皮下脂肪沉积很少,其内脏脂肪沉积量也明显少于育肥组(脂肪含量未进行具体测量)。育肥黄牛、育肥水牛、未育肥水牛屠宰时的平均体重分别为(541.3±49.36)kg、(552.2±54.8)kg、(505.8±36.13)kg。
1.2 总 RNA 提取和 cDNA 合成 利用 TRIzol 法进行总RNA 的提取,核酸浓度检测仪测定总RNA 的浓度,1.5%琼脂糖凝胶电泳检测总RNA 的完整性。使用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)进行cDNA 的合成。
1.3 引物合成 根据NCBI 数据库中水牛和黄牛的基因序列,用NCBI 数据库的Pick Primer 功能(https://www.ncbi.nlm.nih.gov/tools/primer-blast/),将引物设计在水牛和黄牛的保守区域。引物(表1)由南京金斯瑞生物科技有限公司合成。
1.4 实时定量PCR 检测 实时定量PCR(qRT-PCR)检测使用FS Essential DNA Green Master(Roche)。参照说明书,使用10 μL 反应体系:上下游引物各0.15 μL,Taq Polymerase 5.0 μL,cDNA 1.0 μL,ddH2O 3.7 μL。反应程序如下:首先95℃预热600 s;然后进行扩增,扩增包括 95℃预热10 s、60℃退火10 s、72℃延伸15 s三步,设45 个循环;最后测定熔解曲线,包括95℃预热10 s、60℃退火60 s、97℃反应1 s。每个样品设3个复孔。以β-actin基因作为内参,基因相对表达量用2-△△Ct法进行计算。

表1 qRT-PCR 使用到的引物信息
1.5 统计分析 基因相对表达量使用Excel 进行计算,利用SPSS 18.0 单因素方差分析法进行差异显著性分析,数值以平均值±标准差表示,用Origin85 软件作图。P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结 果
2.1 棕色脂肪标志基因ZIC1在水牛和黄牛肌肉和脂肪组织间的表达模式分析 如图1 所示,育肥水牛、育肥黄牛和未育肥水牛的ZIC1基因在肌肉和脂肪组织中的表达模式基本一致,即ZIC1基因主要在肌肉中表达;在水牛中,仅育肥水牛的皮下脂肪有一定量表达,其他脂肪组织几乎不表达。如图2 所示,ZIC1基因在育肥水牛肌肉组织中的表达量显著高于育肥黄牛,在育肥水牛皮下脂肪组织的表达量显著高于育肥黄牛和未育肥水牛。
2.2 米色脂肪标志基因UCP1在水牛和黄牛肌肉和脂肪组织间的表达模式比较 如图3 所示,UCP1基因在水牛和黄牛的肌肉和脂肪组织中均能检测到;在育肥黄牛中,UCP1基因在肌肉、皮下脂肪和内脏脂肪间的表达量无显著差异;在育肥水牛中,UCP1基因在内脏脂肪中的表达量最高(P<0.01),其次是皮脂,肌肉中表达量最低;在未育肥水牛中,UCP1基因在内脏脂肪的表达量高于皮下脂肪(P<0.05)和肌肉组织(P<0.01)。由图4 可知,UCP1基因在3 组牛肌肉组织中的表达量无显著差异,在育肥水牛皮下脂肪及内脏脂肪中的表达量均显著高于育肥黄牛和未育肥水牛。

图1 ZIC1 基因在水牛和黄牛肌肉和脂肪组织中的mRNA 表达模式
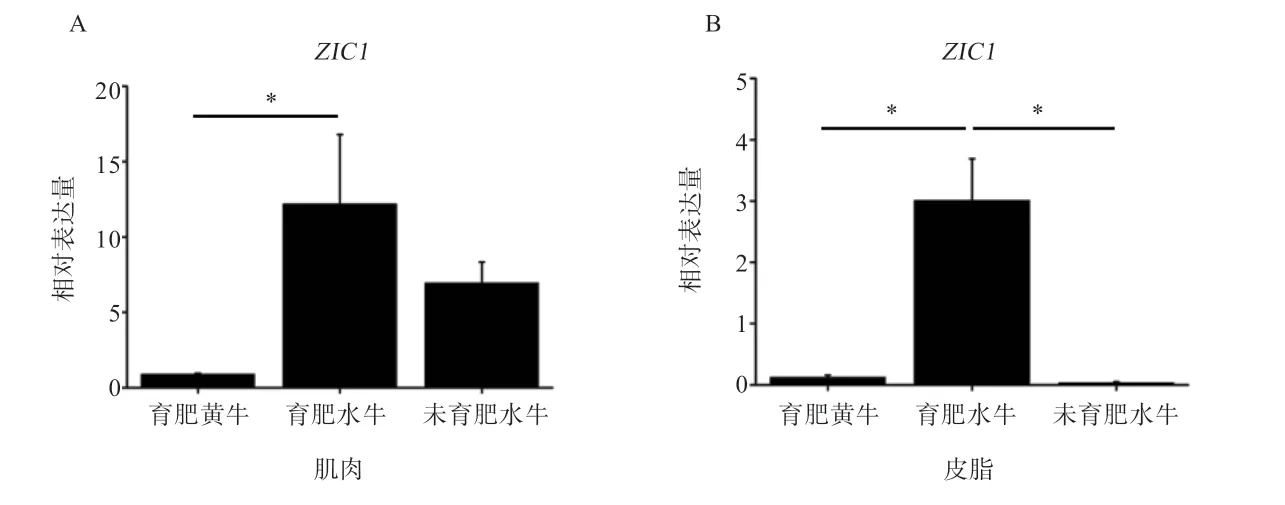
图2 水牛和黄牛肌肉和脂肪组织中ZIC1 基因mRNA 的表达水平
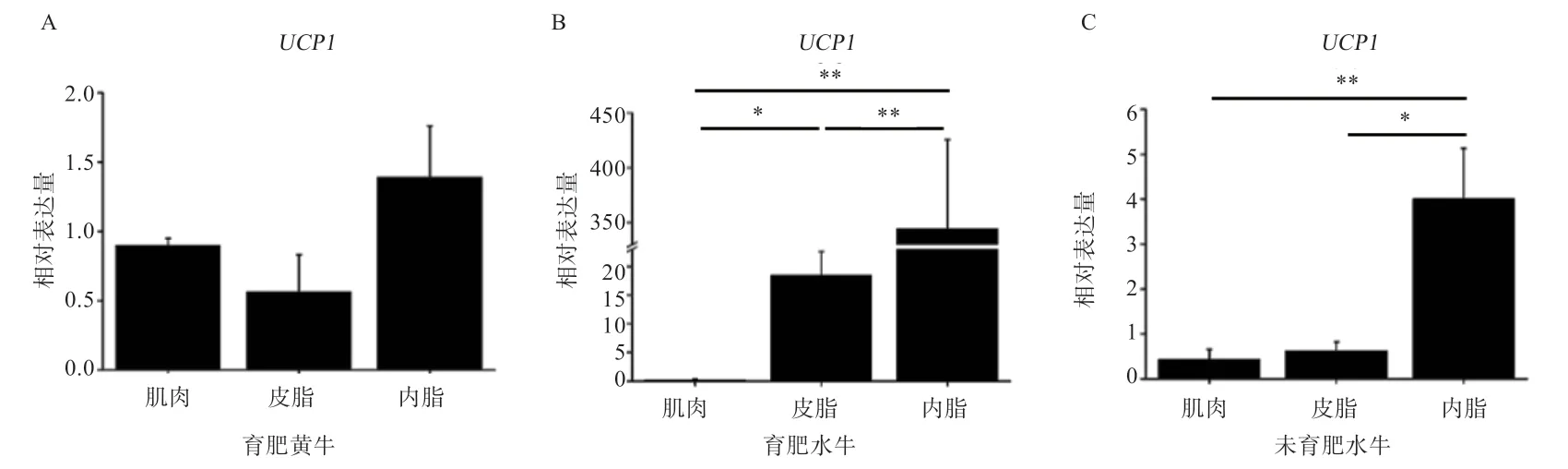
图3 UCP1 基因mRNA 在水牛和黄牛肌肉和脂肪组织中的表达模式
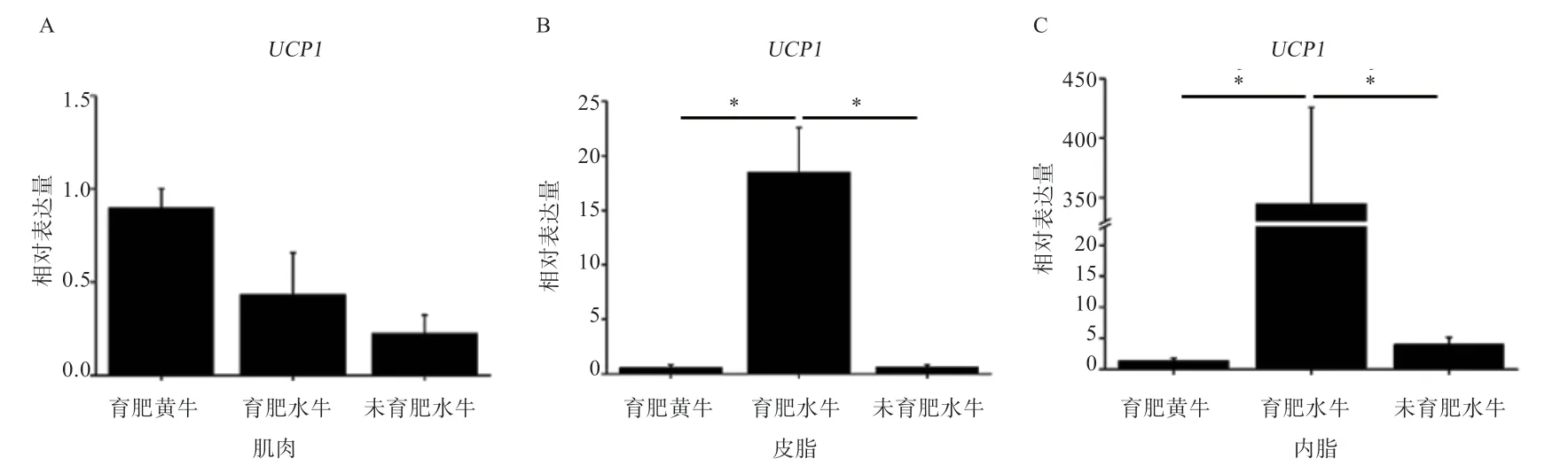
图4 水牛和黄牛肌肉和脂肪组织中UCP1 基因mRNA 的表达水平
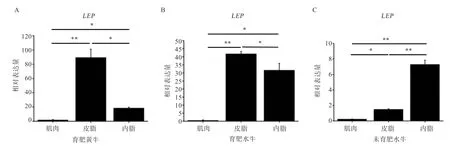
图5 LEP 基因mRNA 在水牛和黄牛肌肉和脂肪组织中的表达模式
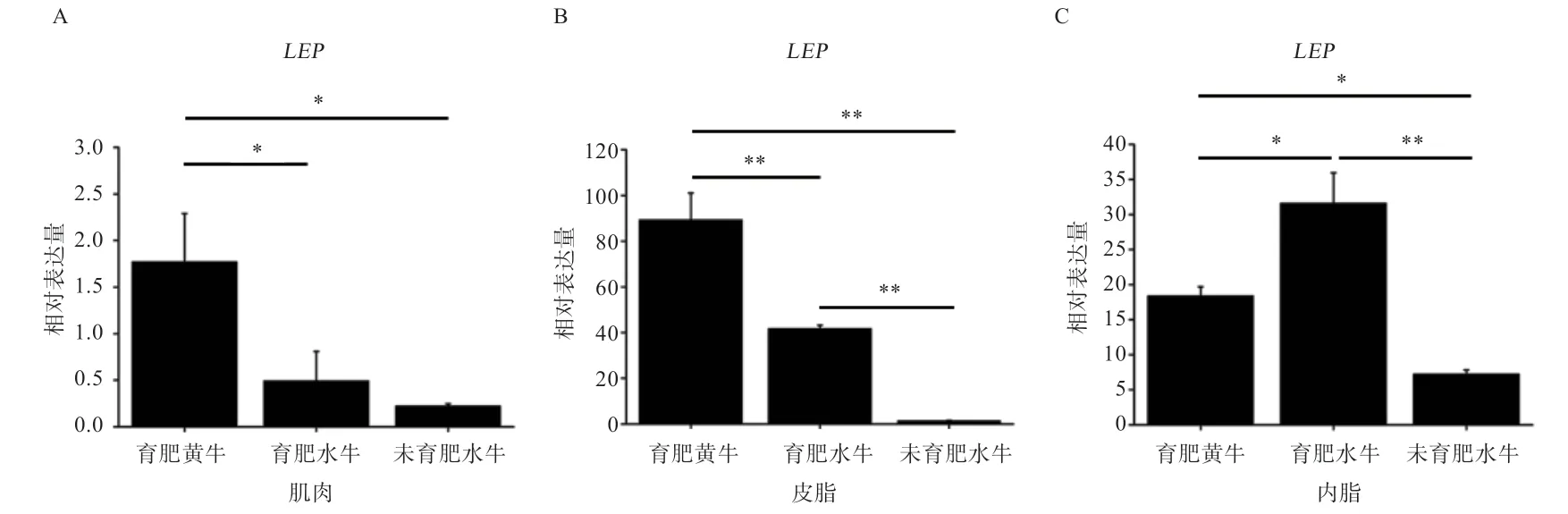
图6 水牛和黄牛肌肉和脂肪组织中LEP 基因mRNA 的表达水平
2.3 白色脂肪标志基因LEP在水牛和黄牛肌肉和脂肪组织间的表达模式分析 如图5 所示,水牛和黄牛的LEP基因主要在脂肪组织中表达;育肥水牛和育肥黄牛的LEP基因在皮下脂肪组织中的表达量最高,其次是内脏脂肪,肌肉中表达量最低;而在未育肥水牛中,LEP基因在内脏组织中的表达量最高,其次是皮下脂肪,在肌肉中表达量最低。如图6 所示,在肌肉组织中,LEP基因在育肥黄牛中的表达量显著高于育肥水牛和未育肥水牛;在皮下脂肪组织中,LEP基因在育肥黄牛中表达量最高,其次是育肥水牛,未育肥水牛最低,三者间差异极显著;在内脏脂肪中,LEP基因在育肥水牛中表达量最高,其次是育肥黄牛,未育肥水牛中表达量最低。
3 讨 论
在成年人和小鼠上均已发现BAT 库[5,19],但在成年家畜身上未发现典型的BAT 库。已有研究表明,成年水牛和黄牛的脂肪组织均为WAT,但存在异质性,以白色脂肪细胞为主,同时存在少量的米色脂肪细胞或棕色脂肪细胞[13-14]。
在人和模式动物上的研究已揭示一批BAT 标志基因,如UCP1、ZIC1、PRDM16 等[5-7]。与其他标志基因相比,ZIC1基因更加特异地表达于BAT 中[5]。因而本研究选择ZIC1基因作为BAT 标志基因。有趣的是,ZIC1基因还是一个肌细胞发育重要调控基因,在肌肉组织中高表达[20-21]。本研究中,ZIC1基因主要在肌肉组织中表达,与其调控肌肉发育的功能相对应[20-21]。本实验结果显示,在肌肉组织中,水牛的ZIC1基因表达量高于黄牛,提示ZIC1基因在水牛肌肉组织较黄牛活跃,这可能与水牛肌纤维较黄牛粗相关[18]。在脂肪组织中,ZIC1基因在皮下脂肪中有少量表达,在内脏脂肪中几乎不表达,提示育肥水牛和育肥黄牛皮下脂肪中可能存在少量的棕色脂肪细胞,这与Komolka 等[14]在黄牛上的研究结果一致。Komolka 等[14]对育肥黄牛进行研究发现,棕色脂肪细胞存在于皮下脂肪组织和肌肉相关的脂肪组织中,不存在于内脏脂肪中,且不同品种的黄牛皮下脂肪组织ZIC1基因表达水平无差异。然而,在本研究中,ZIC1基因在育肥水牛皮下脂肪组织表达水平高于育肥黄牛,提示育肥水牛皮下脂肪组织中存在更丰富的棕色脂肪细胞;育肥水牛皮下脂肪中ZIC1基因表达量显著高于未育肥水牛,提示育肥可能促进水牛皮下脂肪组织中棕色脂肪细胞的发育。
UCP1 是一种线粒体内膜蛋白,可将质子从膜间转运到线粒体基质中,实现将能量从ATP 合成转移到棕色脂肪细胞线粒体的热生成中[22]。最初,UCP1基因被认为是特异表达于BAT 中。后来发现一类新的脂肪细胞—米色脂肪细胞中也存在较高水平的UCP1基因的表达[23-24]。目前认为,米色脂肪细胞由白色脂肪细胞棕色化得到[25-26],UCP1基因在WAT 中表达提示米色脂肪细胞的存在。本研究中,UCP1基因在育肥水牛和育肥黄牛脂肪组织中表达,提示育肥水牛和育肥黄牛脂肪组织中存在WAT 棕色化的现象,这与前人研究结果一致[13-14]。本实验结果表明,UCP1基因在水牛内脏脂肪中的表达量显著高于皮下脂肪,提示水牛的内脏脂肪棕色化水平较皮下脂肪高;而在黄牛中,皮下脂肪和内脏脂肪间无显著差异;另外,无论是在皮下脂肪还是在内脏脂肪中,育肥水牛WAT 棕色化水平均显著高于未育肥水牛,说明育肥可诱导水牛皮下和内脏WAT 棕色化。Asano 等[13]研究发现,育肥可诱导黄牛皮下脂肪中UCP1的表达,与本实验中水牛结果一致,但其发现育肥对内脏脂肪中UCP1的表达无显著影响[13],与本研究在水牛上的结果不同。UCP1 的出现提示WAT 棕色化,即出现了米色脂肪细胞。白色脂肪细胞负责存储脂肪,米色脂肪或棕色脂肪细胞负责燃烧脂肪产生热量[3]。本实验中,育肥诱导的水牛皮下和内脏WAT 棕色化水平均高于黄牛,提示水牛在耐寒方面可能优于黄牛。这与目前认为的黄牛较水牛更耐寒的观点相矛盾[17]。目前黄牛比水牛耐寒的观点主要基于它们在地理分布上的差别。从地理分布上看,黄牛主要分布于纬度较高的地区,如我国北方和欧洲各国;而水牛主要分布于低纬度地区,如我国南方和东南亚部分国家。有考古研究证明,历史上我国北方也有水牛的存在[27]。至于后来为何水牛只分布于南方(主要为稻田区)还没有一个明确的说法。因此,水牛和黄牛究竟谁更耐寒,仍需要进一步分子方面研究理论的支持。
瘦素基因(LEPtin,LEP)又称肥胖基因,是脂肪沉积重要调控因子,其表达具有脂肪组织特异性。LEP被认为是WAT 标志基因,在WAT 中高表达,但在BAT 中也有少量表达[6,28]。本研究中,LEP基因主要在脂肪组织中表达,且在育肥水牛和育肥黄牛中,皮下脂肪的表达量均高于内脏脂肪,这与前人研究结果一致[29]。在未育肥水牛上,趋势则相反,提示育肥可诱导水牛皮下脂肪组织中LEP基因的表达。在肌肉组织中,LEP基因在育肥黄牛中的表达量高于育肥水牛,提示育肥后黄牛肌内脂肪水平高于水牛,黄牛肌内脂肪沉积能力优于水牛,这与前人研究结果[18]一致;而育肥水牛和未育肥的水牛之间无明显差异,提示育肥可能对水牛肌内脂肪沉积无显著影响。在皮下脂肪组织中,LEP基因在育肥黄牛中表达量显著高于育肥的水牛,提示育肥可能对黄牛皮下脂肪沉积效果更佳;同时,育肥可使水牛皮下脂肪表达量显著高于未育肥的水牛,说明育肥可显著诱导水牛皮下脂肪的沉积;在内脏脂肪中,育肥水牛LEP基因的表达量显著高于育肥黄牛和未育肥水牛。这些研究结果提示,育肥后黄牛的脂肪可能更容易沉积于皮下和肌内,而水牛的脂肪则可能更倾向于沉积在内脏周围。当然,这些仍需要相关屠宰测量数据的支持。
4 结 论
本研究获得了棕色脂肪标志基因ZIC1、米色脂肪标志基因UCP1和白色脂肪标志基因LEP在育肥水牛、育肥黄牛以及未育肥水牛的肌肉和脂肪组织中的表达模式,研究结果进一步支持育肥牛皮下脂肪组织中存在少量棕色脂肪细胞、皮下和内脏脂肪组织均存在白色脂肪细胞棕色化的观点,初步揭示育肥水牛脂肪组织中,白色脂肪细胞棕色化水平高于育肥黄牛,水牛可能比黄牛更具抗寒潜力,黄牛肌内脂肪和皮下脂肪沉积能力可能高于水牛。
