海南西海岸四种真红树根系土壤放线菌物种多样性及其延缓衰老活性初筛
2020-04-20候师师李蜜姜舒韩敏敏刘永宏易湘茜
候师师 李蜜 姜舒 韩敏敏 刘永宏 易湘茜

摘 要:為更好地开发利用海洋微生物资源积累丰富的放线菌菌种,该文以海南西海岸潮间带区域四种真红树根系土壤为研究对象,分析了红树林根系放线菌物种多样性组成及其代谢产物活性。该研究以9种不同培养基为分离介质,采用纯培养方法和三区划线法分离纯化菌株,结合放线菌形态学特征及其16S rRNA基因序列结果开展多样性分析。放线菌发酵液经乙酸乙酯萃取,利用秀丽隐杆线虫(Caenorhabditis elegans)测试其延缓衰老活性。结果表明:(1)共分离获得22株放线菌,隶属于4目7科9属,其中链霉菌属(Streptomyces)为优势菌群,并初步确认IMDGX 6012、IMDGX 6028、IMDGX 6118、IMDGX 6326、IMDGX 6119 5株放线菌可能为潜在的新物种。(2)发酵产物延缓衰老研究结果表明,8株放线菌的代谢产物可显著延长线虫寿命(P<0.05);其中,IMDGX 6028和IMDGX 6118作为拟无枝酸菌属(Amycolatopsis)和短小杆菌属(Curtobacterium)的潜在新物种,具有极显著延缓衰老活性(P<0.01),与空白组比较,可分别延长线虫寿命的22.2%和26.6%。综上结果表明海南西海岸真红树根系土壤具有丰富的可培养放线菌资源,具有发现放线菌新物种和延缓衰老活性菌株的潜力。
关键词:红树林,根系放线菌,菌种多样性,延缓衰老活性
Abstract:Four true mangrove rhizosphere soils in the intertidal zone of the west coast of Hainan were studied to analyze the species diversity composition and metabolite activity of mangrove rhizosphere actinomycetes,in order to accumulate abundant actinomycetes for better exploitation and utilization of marine microbial resources. In this study,seven samples of true mangrove rhizosphere soil were selected as research objects and nine different media were used as the isolation media. Pure culture method and three-zone scribing method were used to isolate and purify the strains. The species diversity composition was analyzed by combinating with the morphological characteristics of actinomycetes and the 16S rRNA gene sequence results. The actinomycete fermentation broth was extracted with ethyl acetate,and its anti-aging activity was tested using Caenorhabditis elegans model. The results were as follows:(1) A total of 22 strains of actinomycetes were isolated,belonging to four orders,seven families and nine genera consist of Amycolatopsis,Curtobacterium,Demequina,Isoptericola,Lysinimicrobium,Microbacterium,Rhodococcus,Sinomonas,Streptomyces,and Streptomyces was the dominant flora of this study with eleven strains isolated,and five strains of IMDGX 6012,IMDGX 6028,IMDGX 6118,IMDGX 6326,IMDGX 6119 were identified as potential new species actinobacteria. The highest similarities among the strains and the effective published strains Amycolatopsis lexingtonensis,A. niigatensis,Curtobacterium albidum,C. cit-reum,Demequina salsinemoris were 97.75%,98.15%,98.32%,98.44%,98.45%,respectively. The above five rhizosphere actinobacteria belong to rare actinobacteria and were preliminarily identified as potential new species. (2) The results of anti-aging of fermentation products showed that the metabolites of eight strains of actinobacteria could signifi-cantly prolong the lifespan of nematodes (P<0.05),including one strains of Curtobacterium,one strains of Demequina,one strain of Sinomonas and five of which were from Streptomyces,indicating that Streptomyces had potential to produce anti-aging active substances. IMDGX 6028 and IMDGX 6118,as potential new species of Amycolatopsis and Curtobacte-rium,had extremely significant anti-aging activity (P<0.01). When the crude metabolite concentration was 500 μg·mL1,the survival time of C. elegans was increased by 22.2% and 26.6%,respectively,compared with the blank group. The results indicate that there are abundant resources of culturable actinobacteria and the potential to discover new species and anti-aging activity strains in the true mangrove rhizosphere soils in the west coast of Hainan.
Key words:mangrove plants,rhizosphere actinobacteria,species diversity,anti-aging activity
放线菌是挖掘新型次生代谢产物的重要菌种资源。红树林处于海岸潮间带,独特的理化环境和丰富的腐殖质为创造微生物多样性提供了有利条件(Sangkanu et al.,2017),已经被公认为分离放线菌的理想环境(Sweetline et al.,2012)。因此,红树林放线菌一直是国内外科研人员争相研究的对象。Lee et al.(2014)从马来西亚热带红树林沉积物中分离获得 87株放线菌,其中5株被认为是新种。洪葵研究组从中国8个红树林站点采集的112份土壤和99个植物样品中分离出2 041株放线菌,归于8亚目11科25属,部分菌株次生代谢产物具有抗菌、抗肿瘤、治疗神经退行性疾病和糖尿病多种药理活性(Hong et al.,2009)。我国红树物种资源丰富,海南岛是我国红树植物聚集地之一,共有红树植物38种(辛欣等,2016)。其中,位于东部海岸的东寨港和清澜港红树林保护区作为海南最大的红树林分布区,成为热点研究地区,已分离出具有抗菌、抗肿瘤及杀线虫活性的多种菌株(雷湘兰,2006;黄惠琴等,2013;李静等,2016)。海南西海岸红树林主要分布于临高、儋州等地,与东海岸相比,西海岸红树林面积小,群落类型相对简单,目前对于该区域红树根系放线菌的研究鲜有报道。加上近年来人类活动对红树林资源造成了实际威胁,及时对该区域红树林根系放线菌实现高值化开发利用,并以此为契机进一步推动西海岸红树林生态系统建设,对于我国发展海洋生态文明具有重要意义。同时对红树林根系放线菌种类多样性的研究,对于我国海洋微生物资源现状的整体评价也具有一定参考价值。
近年来我国人口呈负增长趋势,老龄化形势日益严峻,预计到 21 世纪中叶,老龄人口将高达 4.5 亿,占总人口的 1/3(曾尔亢等,2012),解决人口老龄化问题刻不容缓。目前临床用于抗衰老的药物大多是合成药物(Messing et al.,2013),存在安全和功效的不确定性,从微生物中挖掘新化合物一直以来受到各国科学家的青睐。放线菌被认为是最适合挖掘新化合物的微生物之一,从放线菌挖掘获得的新化合物包括生物碱、类固醇、萜类化合物、聚酮等,这些化合物在人类疾病治疗和病虫害防治均有报道(Singh et al.,2017),然而这些已鉴定化合物对于人体健康保健方面如延缓衰老活性则鲜有报道。本研究对红树根系土壤放线菌多样性进行分析,并通过初步筛选获得具有延缓衰老表型的放线菌菌株,为后期挖掘具有延缓衰老活性的新化合物提供重要的菌种资源。
1 材料与方法
1.1 材料
1.1.1 红树林根系土壤样品 2017年7月从海南西海岸共采集四种真红树林植物根系土壤样品7份,样品信息如表1所示。用灭菌铲沿每种红树根围挖取深度为5 cm的土壤样品,同一种红树植物样品的取样地点距离均大于100 m,土壤样品保存于采样冰盒中并于24 h内送回实验室进行菌株的分离实验。
1.1.2 线虫样品 OP50大肠杆菌(OP50 Escherichia coli)和野生型秀丽隐杆线虫(Caenorhabditis elegans)均由广西科学院汪斌博士惠赠。
1.1.3 实验试剂 Chelex-100树脂,2×Easy Taq Supermix购于BioRad公司(美国);16S rRNA基因扩增引物对27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)购于全式金生物技术有限公司(中国,北京);5%次氯酸钠购于朗索医用消毒剂有限公司(中国,杭州);其他试剂均为国产分析纯。
1.2 红树根系土壤放线菌多样性实验
1.2.1 培养基配方 分离用固体培养基:参考李家怡等(2017)方法采用AGG、M4、M5、M7、M9、M10、M11、ISP7和ISP3共9种分离培养基,培养基详细配方见参考文献。
纯化及保藏培养基:改良ISP2固体培养基,包括酵母提取物2.0 g,麦芽提取物2.0 g,葡萄糖2.0 g,琼脂20.0 g和海水1 000 mL。
发酵培养基:改良ISP2液体培养基。
1.2.2 红树根系土壤样品的处理方法 参考李菲等(2018)的方法,挑除根系土壤样品表面的杂质,取红树植物根须表面附着的土壤2.0 g装于含有石英砂和20 mL无菌水的锥形瓶中,于摇床中充分摇匀,制成102、103稀释液。取两种稀释液各0.2 mL,分别涂布于9种分离培养基上,置于恒温培养箱28 ℃下倒置培养2~8周;从涂布培养基中挑选单一菌落,采用三区划线法于ISP2培养基上进行分离纯化,得到单一纯净的菌落,编号并记录菌落的形态特征及菌落数。将纯化好的菌株保藏于20%(V/V)无菌甘油管,-80 ℃冰箱保存备用。
1.2.3 16S rRNA基因序列的系统发育学分析 放线菌基因组提取采用Chelex-100法(周双清等,2010)通过梯度PCR扩增得到16S rRNA基因序列(Walsh et al.,1991),利用琼脂糖凝胶电泳初步评价目的条带大小及扩增质量,切胶回收目的条带并委托上海美吉生物医药技术有限公司广州分公司进行测序分析。
测序结果利用DNA Star软件处理,所得到16S rRNA基因序列通过数据库EzBioCloud(https://www.ezbiocloud.net/)(Yoon et al.,2017)進行相似性搜索和在线比对,获得相似性最高且有效发表的典型菌株,并以此作为参比对象。
1.3 红树根系土壤放线菌活性实验
1.3.1 红树根系土壤放线菌粗提物的制备 参考覃媚等(2016)的方法,将根系放线菌于改良ISP2固体培养基进行活化培养,在其对数生长期接种到4瓶200 mL改良ISP2液体培养基中,于28 ℃、180 r·min1摇床发酵培养7 d。发酵液用等体积乙酸乙酯萃取三次,萃取液减压浓缩置于干燥器中低温保存备用。
1.3.2 红树根系土壤放线菌抗衰老活性测试方法
以秀丽隐杆线虫为模型对红树林根系土壤放线菌发酵产物进行活性筛选,记录线虫的寿命数据(Lakowski & Hekimi,1998),所有数据采用SPSS Statistics 17.0进行统计分析,并用Excel 2013软件做表、绘图,评价放线菌发酵产物延缓衰老的生物活性。
用 M9缓冲液将虫体洗净,离心弃去上清液;以1∶3的比例将裂解液(1 mL 5 mol·L1的NaOH和0.5 mL 5%的 NaClO混匀使用)加入虫体中,震荡离心后。分别将20 μL大肠杆菌发酵液、30 μL线虫pellet、150 μL M9 Buffer加入96孔板的各个孔中,设置阴性对照。置于20 ℃ 生化培养箱中培养48 h后可得L4期线虫。
粗提物样品用1%的DMSO溶液超声溶解成浓度为500 μg·mL1药液,将培养好的L4期线虫挑至加有50 μL药液的NGM培养基(Brenner,1974),置于20 ℃ 生化培养箱中进行培养,每组2个平板,每个平板20条L4期线虫,此时培养天数记为0 d。此后,隔天对培养的线虫进行计数,观察并记录线虫生存、死亡及剔除的数量,将线虫转移至新的培养皿,直至线虫全部死亡。
2 结果与分析
2.1 红树植物根系放线菌多样性分析
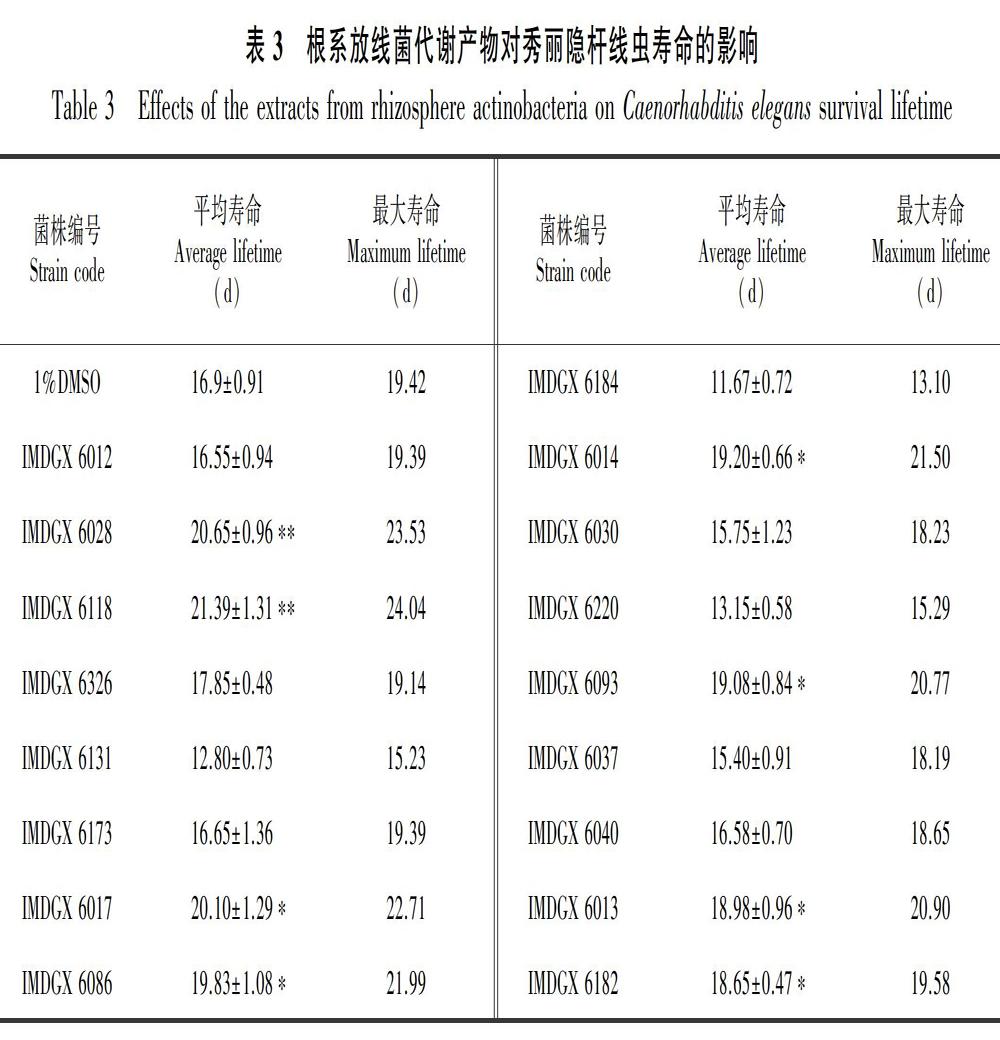
根据菌落形态特征及16S rRNA基因序列分析结果,本研究从7份红树林根系土壤中共分离鉴定得到22株放线菌,由9个属组成,隶属于4目7科,链霉菌属(Streptomyces)分离出11株菌为优势菌群,详细物种信息如表2所示。菌株IMDGX 6012、IMDGX 6028、IMDGX 6118、 IMDGX 6326、IMDGX 6119分别与有效发表菌株Amycolatopsis lexingtonensis、A. niigatensis、Curtobacterium albidum、C. citreum、Demequina salsinemoris的最高相似率为97.75%、98.15%、98.32%、98.44%、98.45%。根据放线菌16S rRNA基因序列相似性小于98.65%的菌株属于潜在新物种的归类原则(Kim et al,2014),以上五株根系放线菌可能为潜在的新物种。IMDGX 6119分离于白骨壤根系土壤(2-2),其余四株潜在新菌株均来自于红海榄根系土壤(1-14)。
2.2 22株放线菌在不同红树土壤样品、培养基中的分布
22株根系细菌在7份不同植物根系土壤样品分布情况如图1。从1-14土壤样品分离获得10株菌株隶属于4个属,包括拟无枝酸菌属(Amycolatopsis)、短小杆菌属(Curtobacterium)、Sinomona、链霉菌属(Streptomyces),分离菌株数量最多且菌属最为丰富。其次是从2-2土壤样品分离得到4株菌株隶属于3个属,包括Demequina、Lysinimicrobium和链霉菌属(Streptomyces)。而2-1土壤样品未分离得到放线菌。
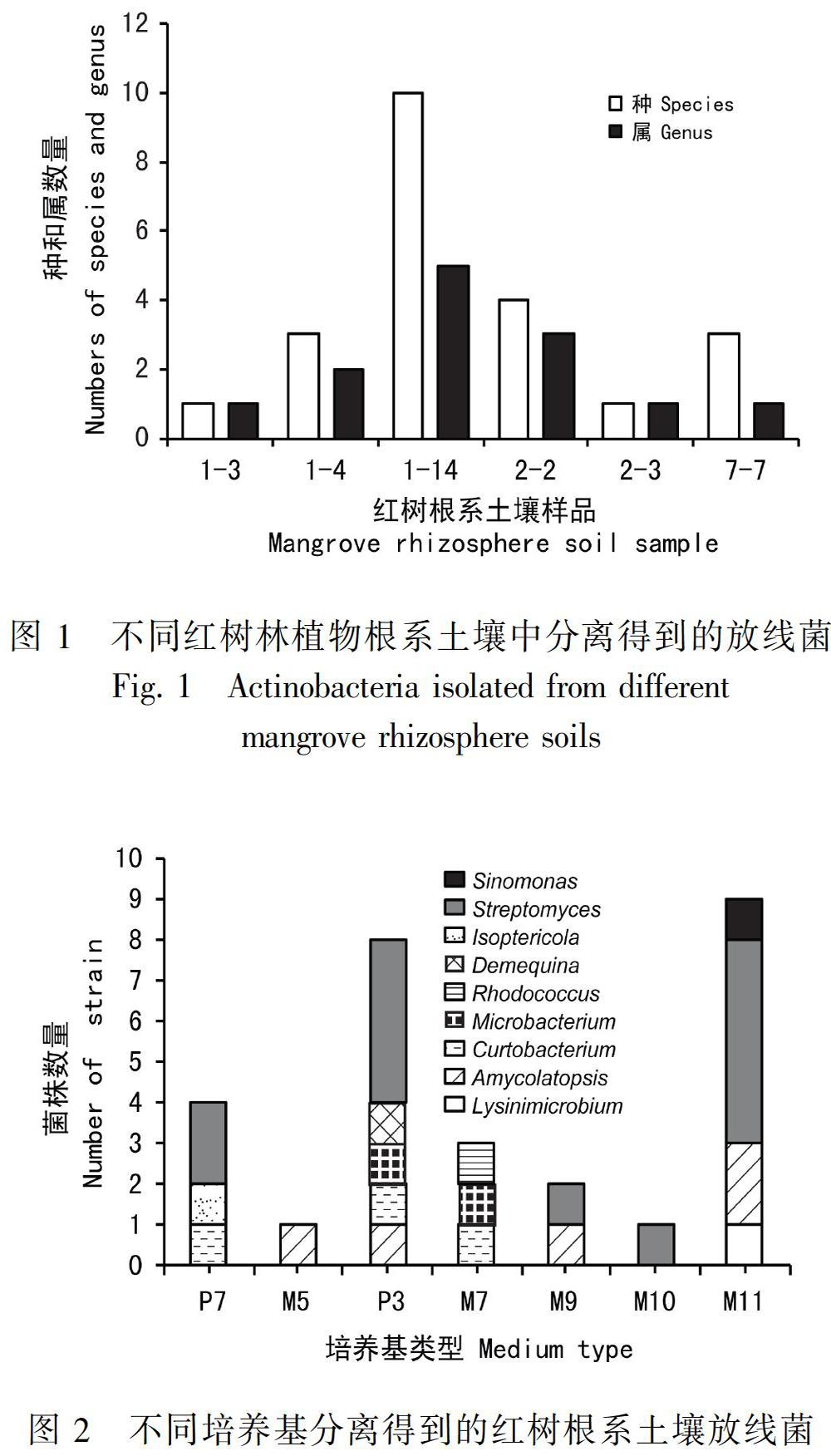
7種分离培养基对红树根系土壤放线菌分离效果见图2。研究结果表明M11和P3培养基更适合于海洋放线菌分选,其中从M11培养基共分离获得1株Lysinimicrobium、2株Amycolatopsis、5株Streptomyces和1株Sinomonas。从P3培养基共分离获得1株Amycolatopsis、1株Curtobacterium、1株Microbacterium、1株Demequina和4株Streptomyces。其中Amycolatopsis、Lysinimicrobium、Amycolatopsis、Curtobacterium、Microbacterium和Demequina均为稀有放线菌属。因此无论从分选获得的菌株数量或多样性而言,M11和P3两种培养基在分离红树根系放线菌方面均具有较明显的优势。此外,拟无枝酸菌属(Amycolatopsis)在M5、P3、M9、M11培养基上都能生长,P7、P3、M7培养基均能分离得到短小杆菌(Curtobacterium)。
2.3 红树植物根系放线菌发酵产物活性分析
秀丽隐杆线虫具有遗传背景清晰、生命周期短、同期化后个体差异小、易于培养和观察等特点,可进行大规模筛选,且与人类基因存在60%~80%的同源性,是寿命实验的优质模型生物(Takuma,2016;Park et al.,2017)。本实验以秀丽隐杆线虫为模型,对分离获得的22株放线菌的发酵产物粗提物进行延缓衰老活性分析。
以放线菌发酵粗提物处理L4期线虫,分析各菌株发酵粗提物对线虫生存寿命的影响(表 3)。研究结果显示,本研究分离得到的22株放线菌中有8株具有延缓衰老活性,其中IMDGX 6017、IMDGX 6086、IMDGX 6014、IMDGX 6093、IMDGX 6013 和IMDGX 6182 这6株红树根系放线菌均能显著延缓线虫衰老,而且以链霉菌属表现最为突出,共有活性菌株5株,提示链霉菌具有产生延缓衰老活性物质的极大潜力。IMDGX 6028和IMDGX 6118均来源于红海榄土壤,作为拟无枝酸菌属(Amycolatopsis)和短小杆菌属(Curtobacterium)的潜在新物种对线虫寿命延长作用最为显著,均可延长L4期线虫20%以上的寿命。
3 讨论与结论
随着陆地资源的大量开发,使得从其中发现新的菌种尤其是具有独特生物活性的菌种越来越困难,未充分开发的海洋生境是丰富和新的放线菌来源(Manivasagana et al.,2014)。红树林独特的生态系统决定微生物必须从遗传水平上进行调整,使其适应周围苛刻的生长环境。海洋微生物适应其周围苛刻环境的机制之一是激活部分沉默基因,合成具有特殊生物活性的次生代谢产物,从而保证细胞在高盐、低温等环境中正常的生理活性(Wilson & Brimble,2009)。因此,鉴于特殊的生态系统,红树林也是新型生物活性代谢物的主产区(Jiang et al.,2015)。自2007年以来,已从红树林环境中分离和鉴定了8个新属66个新种,发现了大量由放线菌产生的新的生物活性化合物(Jiang et al.,2018)。
20世纪以来已有大量新型化合物被发现,大量已知化合物的干扰使得此后新化合物的发现概率大大降低(Subramani & Aalbersberg,2013)。为了获得新的活性代谢物,针对特定生境的微生物多样性进行研究是必要的,而对于稀有微生物理应获得更多重视(Tiwari & Gupta,2012)。Subramani &Aalbersberg(2013)同样提出新的放线菌种属和稀有放线菌应成为挖掘新型化合物的研究重点。而稀有放线菌不仅包括自然界稀有的放线菌,也包括不易被培养的放线菌(Stach,2010)。因此,选择合适的分离介质就显得极为关键。本研究通过不同土壤样品和不同培养条件对海南西海岸红树林采集根系土壤开展放线菌多样性研究,共分离得到22株放线菌,其中11株为稀有菌株,覆盖8属,其中5株潜在新物种均属于稀有放线菌,包括2株拟无枝酸杆菌属、2株短小杆菌属和1株Demequina。据报道,拟无枝酸杆菌属含有20多个次级代谢基因簇,这些基因簇可在不同的环境条件下被激活,合成特定的次生代谢产物从而使细胞表现出多种生物活性,如免疫抑制、抗癌等(Peano et al.,2014;Kumari et al.,2016)。本研究中发现的部分放线菌株的发酵粗提物能够显著延长线虫寿命,尤其两株新型稀有放线菌,当其代谢粗产物浓度为500 μg·mL1时可使线虫寿命延长20%。通过本次研究,进一步说明了新型菌株尤其是稀有菌株在挖掘新化合物领域的重要性。前期文献报道放线菌的次生代谢物的生物活性主要集中在抑菌、抗癌、大分子抑制剂等,而对于延缓衰老活性则鲜有报道,说明这些菌株的代谢产物中可能包含了新化合物,从而赋予菌株延缓衰老活性。但是对于菌株能够延缓秀丽隐杆线虫衰老的有效物质和机制仍不清楚,需要我们在今后的工作中进一步开展大量工作进行验证,包括单体的分离鉴定、单体的生物活性分析、开展秀丽隐杆线虫组学研究等等。
参考文献:
BRENNER S,1974. The genetics of Caenorhabditis elegans [J]. Genetics,77(1):71.
HONG K,GAO AH,XIE QY,et al.,2009. Actinomycetes for marine drug discovery isolated from mangrove soils and plants in China [J]. Mar Drugs,7(1):24-44.
HUANG HQ,YUAN WD,WANG Y,et al.,2013. Isolation & identification of a new Actinomycetes sp. with root knot nematode antagonism [J]. J Microbiol,33(5):37-41. [黃惠琴,袁维道,王英,2013. 1株根结线虫拮抗放线菌新种的分离与鉴定 [J]. 微生物学杂志,33(5):37-41.]
JIANG Z,TUO L,HUANG D,et al.,2018. Diversity,novelty,and antimicrobial activity of endophytic actinobacteria from mangrove plants in Beilun Estuary National Nature Reserve of Guangxi,China [J]. Front Microbiol,9:868-879.
JIANG ZK,GUO L,CHEN C,et al.,2015. Xiakemycin A,a novel pyranonaphthoquinone antibiotic,produced by the Streptomyces sp. CC8-201 from the soil of a karst cave [J]. J Antibiot,68(12):771-774.
KIM M,OH HS,PARK SC,et al.,2014. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes [J]. Int J Syst Evol Microbiol,64:346-351.
KUMARI R,SINGH P,LAL R,2016. Genetics and genomics of the genus Amycolatopsis [J]. Ind J Microbiol,56(3):233-246.
LAKOWSKI B,HEKIMI S,1998. The genetics of caloric restriction in Caenorhabditis elegans [J]. Proc Natl Acad Sci USA,95(22):13091-13096.
LEI XL,2006.Isolate rare actinomycetes from environment of torrid zone,taxanomy and bioactivity screening [D]. Hainan:South China University Tropical Agricultural:1-105. [雷湘兰,2006. 热带不同生态环境稀有放线菌分离、分类和活性初步测定 [D]. 海南:华南热带农业大学:1-105.]
LEE LH,ZAINA N,AZMAN AS,et al.,2014. Diversity and antimicrobial activities of actinobacteria isolated from tropical mangrove sediments in Malaysia [J]. Sci World J,(6):698178.
LI F,GAO CH,YU L,et al.,2018. Diversity and antifungal activity of endophytic and rhizospheric bacteria isolated from Ruppia maritima [J]. Guihaia,38( 7) :924-933. [李菲,高程海,余炼,等,2018. 川蔓藻内生及根系细菌多样性与抑菌活性研究 [J]. 广西植物,38( 7):924-933.]
LI J,DAI SJ,TUO L,et al.,2016. Diversity and antimicrobial activity of endophytic actinobacteria isolated from mangroves collected in Dongzhaigang of Hainan Province [J]. Microbiol Chin,43(8):1753-1765. [李静,戴素娟,庹利,等,2016. 海南东寨港真红树植物内生放线菌多样性及其抗菌活性 [J]. 微生物学通报,43(8):1753-1765.]
LI JY,ZHOU WH,LI F,et al.,2017. Diversity of cultivated marine bacteria and antibacterial activity of endophytic bacterial in Rhizophora stylosa [J]. Guihaia,37(3):308-314. [李家怡,周文红,李菲,等,2017. 红海榄内生细菌多样性及其抑制鱼类致病菌活性研究 [J]. 广西植物,37(3):308-314.]
MANIVASAGANA P,KANGA KH,SIVAKUMARB K,et al.,2014. Marine actinobacteria:An important source of bioactive natural products [J]. Environ Toxicol Pharmacol,38(1):172-188.
MESSING JA,HEUBERGER R,SCHISA JA,2013. Effect of vitamin D3 on lifespan in Caenorhabditis elegans [J]. Curr Aging Sci,6(3):220-224.
PARK HH,JUNG Y,LEE SV,2017. Survival assays using Caenorhabibditis elegans [J]. Mol Cells,40(2):90-99.
PEANO C,DAMIANO F,FORCATA M,et al.,2014. Comparative genomics revealed key molecular targets to rapidly convert a reference rifamycin-producing bacterial strain into an overproducer by genetic engineerings [J]. Metabol Eng,26:1-16.
QIN M,YU QW,ZHU LB,et al.,2016. Diversity of epiphytic bacteria of three species of Gracilaria and their bacteriostatic activities [J]. J S Agric,47(11):1966-1973. [覃媚,于清武,竺利波,等,2016. 三種江蓠共附生细菌多样性及抑菌活性分析 [J]. 南方农业学报,47(11):1966-1973.]
SANGKANU S,RUKACHAISIRIKUL V,SURIYACHADKUM C,et al.,2017. Evaluation of antibacterial potential of mangrove sediment-derived actinomycetes [J]. Microb Pathog,112:303-312.
SINGH M ,KUMAR A ,SINGH R ,et al.,2017. Endophytic bacteria:A new source of bioactive compounds [J]. Biotechniques,7(5):315.
STACH J,2010. Antimicrobials:treasures from the oceans [J]. Microbiol Today,105:1-3.
SUBRAMANI R,AALBERSBERG W,2013. Culturable rare actinomycetes:diversity,isolation and marine natural product discovery [J]. Appl Microbiol Biotechnol,97(21):9291-9321.
SWEETLINE C,USHA R,PALANISWAMY M,2012. Antibacterial activity of actinomycetes from Pichavaram mangrove of Tamil Nadu [J]. Appl J Hyg,1(2) :15-18.
TAKUMA S,2016. Genome editing in C. elegans and other nematode sepecies [J]. Int J Mor Sci,17(3):295.
TIWARI K,GUPTA RK,2012. Diversity and isolation of rare actinomycetes:An overview [J]. Crit Rev Microbiol,39:256-294.
WALSH PS,METZGER DA,HIGUCHI R,1991. Chelex 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material [J]. Biotechniques,10(4):506-513.
WILSON ZE,BRIMBLE MA,2009. Molecules derived from the extremes of life [J]. Nat Prod Rep,26(1):44-71.
XIN X ,SONG XQ,LEI JR,et al.,2016. Mangrove plants resources and its conservation strategies on Hainan [J]. J Trop Biol,7(4):477-483. [辛欣,宋希强,雷金睿,等,2016.海南红树林植物资源现状及其保护策略 [J]. 热带生物学报,7(4):477-483.]
YOON SH,HA SM,KWON S,et al.,2017. Introducing ezbiocloud:A taxonomically united database of 16S rRNA and whole genome assemblies [J]. Int J Syst Evol Microbiol,67(5): 1613-1617.
ZENG EK,SUN YH,DUAN L,et al.,2012. Aging of Chinese population and science of aging [J]. Chin J Soc Med,29(6):388-389. [曾爾亢,孙煜昊,段凌,等,2012. 我国人口老龄化与衰老科学 [J]. 中国社会医学杂志,29(6):388-389.]
ZHOU SQ,HUANG XL,HUANG DY,et al.,2010. A rapid method for extracting DNA from actinomycetes by Chelex-100 [J]. Biotechnol Bull,26(2):123-125. [周双清,黄小龙,黄东益,等,2010. Chelex-100快速提取放线菌DNA作为PCR扩增模板 [J]. 生物技术通报,26(2):123-125.]
(责任编辑 李 莉)
