棉花色素腺体发育相关基因GhNAC201的克隆与表达分析
2020-04-16钱玉源王广恩宋世佳李晓飞米换房崔淑芳李俊兰
张 曦,钱玉源,刘 祎,王广恩,宋世佳,李晓飞,米换房,崔淑芳,李俊兰
(1.河北省农林科学院 棉花研究所,农业部黄淮海半干旱区棉花生物学与遗传育种重点实验室,国家棉花改良中心河北分中心,河北 石家庄 050051;2.河北省农林科学院,河北 石家庄 050051;3.河北工程大学,河北 邯郸 056038;4.邯郸市农业科学院,河北 邯郸 056001)
棉花色素腺体(Pigment gland)又称棉酚腺体,通常呈褐色或黑褐色点状,是积累棉酚及其衍生物质的溶生腔隙,分布于棉属(Gossypium)植物各主要器官[1-2]。棉花种子富含蛋白质、优质脂肪、碳水化合物、维生素、矿物质等,具有巨大的食用、保健、饲用和工业应用潜力。但由于棉酚对单胃动物和人类有毒害作用,严重限制了棉籽的综合利用[3-4]。棉酚含量通常与腺体数量正相关[5]。研究棉花色素腺体发育和棉酚代谢的调控机制,发掘和利用关键基因开展低酚棉分子育种,具有重要理论意义和应用价值。

NAC(NAM/ATAF/CUC)转录因子属于植物特有的基因超家族,参与植物生长发育、物质代谢、胁迫应答、信号转导等生命过程[11-12]。通常NAC蛋白具有N端的DNA结合域和C端的转录调控区2个功能域,一些NAC蛋白的C端还含有跨膜基序[13]。Sun等[13]鉴定了4个棉种的NAC转录因子,分别为陆地棉(G.hirsutum)283个、海岛棉(G.barbadense)267个、亚洲棉(G.arboreum)147个和雷蒙德氏棉(G.raimondii)149个。一些NAC转录因子已证实在棉花生长发育、胁迫应答等方面发挥重要作用。陆地棉GhXND1基因负调控植物木质部形成,在拟南芥(Arabidopsis)中超表达GhXND1后,木质部导管细胞减少,维管束间细胞的细胞壁变薄[14]。GhNAC12自棉花子叶开始衰老时(子叶展开后35 d)显著上调表达,超表达GhNAC12引起拟南芥早衰[15]。陆地棉GhFSN1能够正调控次生壁加厚和负调控纤维伸长[16]。棉花中超表达水稻SNAC1基因,可以促进根系生长和降低呼吸速率,从而增强植株耐盐、耐旱性[17]。海岛棉GbNAC1基因正调控拟南芥黄萎病抗性并参与多种非生物胁迫应答[18]。草棉GhNAC2基因在非胁迫条件下可以促进拟南芥和棉花生长。甘露醇和NaCl胁迫下,GhNAC2仍能促进拟南芥根系发育;水分胁迫下可减少转基因棉花叶片的萎蔫和脱落[19]。GhNAC79超表达植株的抗旱性得到了提高[20]。棉花中超表达GhATAF1可以增强耐盐性,但也提高了棉花对黄萎病和灰霉病病菌的敏感性[21]。
河北省农林科学院棉花研究所品种资源研究室对有腺体陆地棉品种中棉所12(以下简称中12)和其显性无腺体近等基因系中棉所12显性无腺体(以下简称中12显无)幼胚进行转录组测序,筛选到1个在两材料间显著差异表达的NAC转录因子Gh-D06G2096。Gh-D06G2096在中12显无幼胚发育过程中几乎不表达,但在中12幼胚发育至花后35 d(腺体发育后期)时显著上调表达,表明其可能与腺体形成密切相关[22]。本研究利用RT-PCR技术克隆了Gh-D06G2096编码区(Coding sequence,CDS)序列,命名为GhNAC201,并对其进行了基因序列和时空表达模式分析,为NAC转录因子在棉花腺体发育中的功能研究和低酚棉育种提供理论基础和可利用的基因资源。
1 材料和方法
1.1 植物材料与处理
本研究的试验材料有腺体棉花品种中12和显性无腺体材料中12显无由国家棉花种质资源中期库和国家棉花种质资源平台提供,隐性无腺体品种邯无198由邯郸市农业科学院提供。对3个棉花材料于种子萌发期、苗期、开花期和花后26 d分别取样,每个样品取2份,1份液氮速冻用于基因时空表达模式分析,1份用于观察和计数腺体数量。种子萌发期:种子胚根伸长1 cm左右时剥壳。苗期:参照Zhang等[23]的方法种植水培苗,第2片真叶完全展开时分别取根、茎、叶、子叶。开花期:田间种植的植株取倒四叶、当天上午盛开的花和1 cm左右的幼蕾。花后26 d:田间种植的植株取倒四叶和花后26 d幼胚。激素处理:光照培养室中种植的中12幼苗第2片真叶完全展开时分别喷施脱落酸(Abscisic acid,ABA,100 μmol/L)、茉莉酸甲酯(Methyl jasmonate,MeJA,400 μmol/L)、赤霉素(Gibberellin,GA3,150 μmol/L)和油菜素内脂(Brassinosteroid,BR,1 μmol/L),于处理后0,3,6 h分别取叶片,用于基因激素应答分析。
1.2 棉花RNA提取和cDNA合成
使用RNAprep Pure Plant Kit(DP441,天根生化科技(北京)有限公司)提取样品总RNA,并检测其质量。参照FastQuant cDNA第一链合成试剂盒(KR106,天根生化科技(北京)有限公司)说明书合成cDNA,然后置于-20 ℃保存备用。
1.3 基因时空表达分析
用Primer Premier 5软件设计GhNAC201的荧光定量PCR引物(表1),以Histone3为内参基因[2]。qRT-PCR使用SuperReal荧光定量试剂盒(FP205,天根生化科技(北京)有限公司),反应体系为20 μL:2×SuperReal PreMix Plus 10 μL,正向和反向引物(10 μmol/L)各0.6 μL,cDNA模板1 μL,RNase-free ddH2O 7.8 μL。采用Bio-rad荧光定量PCR仪,反应参数参照试剂盒说明书:95 ℃ 15 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,40个循环,最后进行溶解曲线分析。每个样品3次重复,采用2-ΔΔCT法计算基因的相对表达量。

表1 试验中所使用的引物
1.4 基因克隆和序列分析
根据公布的TM-1(NAU-NBI_v1.1)Gh-D06G2096侧翼序列,使用Primer Premier 5软件设计基因克隆引物。以中12 cDNA为模板进行PCR扩增。PCR产物TA克隆后转化大肠杆菌DH5α菌株,经菌液PCR鉴定的单克隆送苏州金唯智生物科技有限公司测序。利用BlastX进行基因的同源性比对,用Mega 7.0进行序列比对和构建进化树。利用ProtParam(http://www.expasy.org/tools/protparam.html)分析蛋白的理化性质;SMART(http://smart.embl-heidelberg.de/)预测蛋白功能域;TargetP 1.1(http://www.cbs.dtu.dk/services/TargetP/)预测蛋白的亚细胞定位;NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白磷酸化位点;SOMPA和Phyre分别预测蛋白的二级和三级结构;MEME(http://meme-suite.org)预测蛋白氨基酸序列的保守motif,并用TBtools重新绘制motif图。
1.5 棉花色素腺体数量的统计与分析
体视显微镜(LEICA DFC550)观察和计数不同组织样品腺体数量,并换算成腺体密度(个/cm2),分析棉花色素腺体的时空分布规律。
2 结果与分析
2.1 GhNAC201基因克隆及序列分析
利用RT-PCR技术克隆了中12中Gh-D06G2096的CDS序列(图1),经测序验证,与TM-1中参考序列(https://www.ncbi.nlm.nih.gov/)完全一致,参考Sun等[13]对陆地棉NAC基因的编号,命名为GhNAC201(GenBank登录号:MN232001)。GhNAC201CDS区为948 bp,编码315 aa。GhNAC201蛋白的分子量为36.8 ku,理论pI 5.97。SOPMA预测GhNAC201的二级结构包括27.94%的α-螺旋,18.10%的延伸链,5.40%的β-转角和48.57%的无规则卷曲。三维结构预测表明,GhNAC201 26-190 aa序列与水稻(OryzasativaL. ssp.japonica)stress-responsive NAC1(SNAC1)蛋白序列高度匹配(100%置信度)。根据SNAC1晶体结构预测GhNAC201的三维结构(图2)。GhNAC201蛋白在30-163 aa存在1个NAM结构域。用NetPhos 3.1预测潜在磷酸化位点,表明GhNAC201有16个丝氨酸、9个苏氨酸和5个酪氨酸潜在修饰位点。其中第66,85,111,137,145 aa处的苏氨酸磷酸化位点,第106,109,110,130,139,161 aa处的丝氨酸磷酸化位点和第118,127,152,157 aa处的酪氨酸磷酸化位点位于NAM结构域内(图3)。用TargetP 1.1工具对GhNAC201的亚细胞定位进行预测(表2),表明GhNAC201定位于分泌通路(0.536)和其他亚细胞结构(0.721)的概率较高。
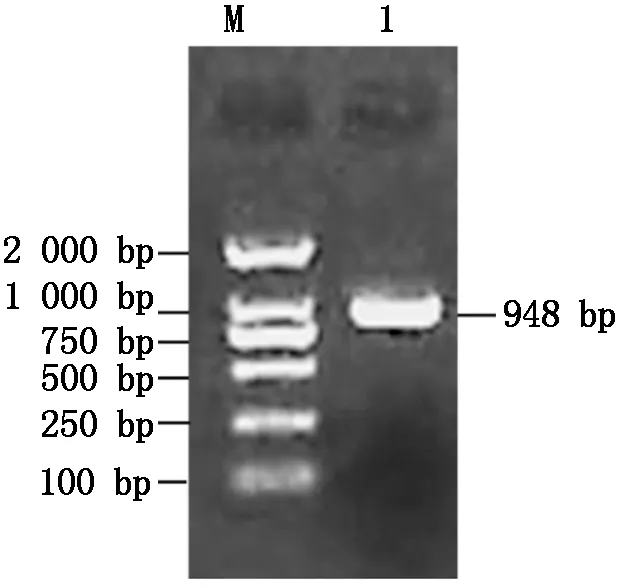
M.DL2000 DNA Marker;1.GhNAC201编码区。

彩色箭头方向为N→C末端。模型维度(Å):X.55.229;Y.36.150;Z.46.112。

图3 GhNAC201磷酸化位点预测

表2 GhNAC201亚细胞定位预测
2.2 GhNAC201同源蛋白进化及保守基序分析
将GhNAC201与棉属及其他物种中代表性同源蛋白构建系统进化树,结果表明,棉属不同棉种中的GhNAC201同源序列的相似度很高,且与拟南芥和油菜(Brassicanapus)同源蛋白最为相似。GhNAC201在双子叶植物中的同源性高于单子叶植物(图4-A)。进一步分析GhNAC201及其同源蛋白的保守基序,可以发现基序1、基序2、基序3、基序4和基序7在不同物种中高度保守,GhNAC201与XP 017614396.1(G.arboreum)、XP 012452555.1(G.raimondii)基序组成模式完全一致(图4-B)。
2.3 GhNAC201的时空表达模式与腺体密度的时空分布
GhNAC201在有腺体棉各个组织的表达均极显著高于无腺体棉,且有腺体棉的种子、苗期根、苗期茎、苗期叶和花后26 d幼胚中GhNAC201丰度较高。2个无腺体棉材料中,GhNAC201仅在苗期根中表达量较高,在其他组织部位不表达或表达量很低(图5-A)。在有腺体棉中12中,GhNAC201的时空表达模式与腺体密度时空分布规律趋于一致(图5-B),且受ABA、BR、GA和MeJA诱导极显著上调表达(图5-C)。
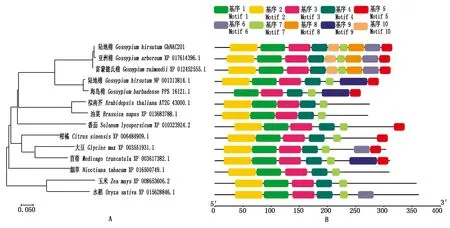
图4 GhNAC201同源蛋白的进化(A)及保守基序(B)分析

A.3个棉花材料不同组织中GhNAC201的表达模式;B.中棉所12中GhNAC201表达模式与腺体密度的关联;C.中棉所12中GhNAC201受激素诱导的表达模式。不同大写字母表示1%水平差异显著(P<0.01)。
A.Expression patterns ofGhNAC201in different tissues of 3 cotton germplasms; B.Correlationship between gland density and expression pattern ofGhNAC201in Zhongmiansuo 12;C.Expression patterns ofGhNAC201under hormone treatment in Zhongmiansuo 12.Different capital letters are significantly different at the 1% level(P<0.01).
图5GhNAC201的时空表达模式及与腺体密度的关联
Fig.5 Expression patterns ofGhNAC201and its correlationship with gland density
3 结论与讨论
棉酚对人畜的毒害作用限制了棉株和棉籽的综合利用[4]。棉花色素腺体发育与棉酚的合成与代谢密切相关[2,5],研究腺体发育及其对棉酚合成的调控机制,开展低酚棉分子育种,对于增加棉花产业附加值具有重要意义。
本研究克隆的GhNAC201基因在有腺体棉中的表达极显著高于无腺体棉,且在有腺体棉中的时空表达模式与腺体密度的时空分布规律趋于一致,表明其与腺体形成存在较高相关性。棉花色素腺体是棉属植物体内储藏棉酚的囊状内分泌结构[24],一般认为,棉酚及其衍生物由根尖合成,之后向植株地上部分输送并贮藏于色素腺体内[25]。低酚棉全株无色素腺体,但在各器官中仍能检测到少量游离棉酚[5]。本研究克隆的GhNAC201基因,通过生物信息学手段预测其可能定位于分泌通路,且其在无腺体棉中,仅在苗期根中的表达较高,在其他组织中几乎不表达,推测其可能直接或间接调控棉酚代谢。
NAC转录因子广泛参与植物生长发育、胁迫应答等生命过程[13]。对不同腺体类型材料进行转录组测序,可以检测到NAC基因差异表达[2,26-27]。本研究室中12和中12显无幼胚转录组测序结果表明,差异表达转录因子中,NAC数量最多。澳洲野生棉和亚洲棉萌发期种子转录组测序也得到了类似结果,差异表达的转录因子中,NAC数量仅次于MYB/MYB-related基因[26]。上述研究表明,NAC转录因子很可能参与了棉花腺体形成或棉酚代谢。进化树和基序分析表明,GhNAC201及其同源蛋白在不同物种中序列相似性较高,其中有5个基序高度保守。故可以参考其他物种中同源基因的功能研究,分析GhNAC201在腺体发育或棉酚代谢中的作用。GhNAC201在拟南芥中的同源基因AT2G43000.1(又称ANAC042、ATJUB1、NAC042等),可能通过调控P450基因,进而诱导拟南芥植保素的生物合成。但ANAC042是直接还是间接调控这些P450基因尚不明确[28]。P450也是棉酚合成的关键基因[29]。解析NAC转录因子调控P450的机制,为腺体发育及棉酚代谢提供了可参考的研究方向。拟南芥和番茄(Solanumlycopersicum)中,JUB1参与调控GA和BR代谢及信号通路[12,30]。NAC转录因子在依赖于ABA的信号转导通路发挥重要作用[11]。本研究中,GhNAC201受GA、BR和ABA诱导表达,可能参与GA、BR和ABA信号通路。在生物胁迫下,NAC基因通过茉莉酸(Jasmonic acid,JA)通路参与应答[31]。棉花中,控制显性无腺体性状的基因GoPGF可能通过JA通路调控色素腺体形成及棉酚代谢[2]。GhNAC201在中12和中12显无间差异表达,且受MeJA诱导,可能参与GoPGF调控的JA信号通路,影响色素腺体形成及棉酚代谢。综上所述,GhNAC201与棉花色素腺体发育密切相关,可能通过ABA、BR、GA和JA通路调控腺体发育或棉酚代谢。
