ABC转运蛋白及其在合成生物学中的应用
2020-04-15曲俊泽陈天华姚明东王颖肖文海李炳志
曲俊泽,陈天华,姚明东,王颖,肖文海,李炳志
1 天津大学 系统生物工程教育部重点实验室 教育部合成生物学前沿科学中心,天津 300072
2 天津大学 前沿技术研究院,天津 301700
ABC转运蛋白作为最大最古老的膜蛋白家族之一广泛存在于各种生物体中。由于它能够利用ATP水解产生的能量进而将与其结合的诸如烷烃、氨基酸、抗生素等各种物质进行跨膜转运,所以无论在原核生物还是高等动植物中,ABC转运蛋白均发挥着重要的生理作用。早在20世纪70年代,在细菌对营养物质吸收的研究中首次发现了这类转运蛋白[1]。随后,由于其可将外源物质以逆浓度梯度的方式排出细胞外所产生的多药耐药性 (Multidrug resistance,MDR) 而被医学工作者在临床治疗领域进行了更进一步的研究[2]。目前,研究发现的ABC转运蛋白已经超过了100种,并被证实在各个领域 (如生物燃料、生物医药等)中均发挥着重要作用[3]。
1 ABC转运蛋白
1.1 ABC转运蛋白的研究进程
20世纪70年代,ABC转运蛋白首次出现于细菌对营养成分吸收的研究中,研究发现该蛋白依赖于ATP水解直接激发底物与结合蛋白(Substrate-binding protein,SBP) 结合,进而达到转运的目的[1]。20世纪80年代早期,研究人员克隆了几个编码这种转运蛋白的基因,其中包括编码鼠伤寒沙门氏菌Salmonella typhimurium组氨酸渗透酶和大肠杆菌Escherichia coli麦芽糖渗透酶的基因。他们在这些蛋白的氨基酸序列间发现了较强的同源性,并观察到这些蛋白的转运有时也会依赖于结合蛋白与转运底物的结合[4-5]。与此同时,医学研究者也注意到了P-糖蛋白(Permeabilityglycoprotein,P-gp) 在临床治疗上的影响,正是源于它的存在使细胞具有药物抗 性[6]。1985年,研究人员成功克隆了不同来源编码这类蛋白的基因,并通过表征发现了其显著的保守性特征[7]。研究人员利用cDNA揭示了哺乳动物转运蛋白和细菌转运蛋白之间的保守性体现在高度保守的核苷酸结合区域 (Nucleotide-binding domains,NBDs)[8],这也揭示了这些ABC转运蛋白可能具有共同的进化起源 (进化关系如图1所示)。1986年,人们鉴别了这些ATP结合的亚基,并依据这些亚基定义了这一转运蛋白超级家族[9-12]。然而,直到1990年这些蛋白才被正式命名为ABC转运蛋白[13]。其可利用ATP水解产生的能量将与其结合的物质逆浓度地排出胞外的功能赋予了细胞多药耐药性,因此在肿瘤治疗相关领域中受到了研究者的广泛关注[2]。近些年来,随着生物技术的不断发展,关于ABC转运蛋白的研究也逐渐深入,科学家们利用其独特的转运功能将它广泛应用于生物医药、生物燃料、微生物工业生产等领域中[14]。ABC转运蛋白的研究进程时间线见表1。

表1 ABC转运蛋白的研究进程Table 1 The research process of ABC transporters

图1 不同来源不同亚族的ABC转运蛋白系统进化分析Fig.1 Phylogeny of ABC transporters of different subfamilies from different species.Different species:Gc:Grosmannia clavigera;Yl:Yarrowia lipolytica;Pp:Pan paniscus;Pa:Pongo abelii;Nl: Nomascus leucogenys;Gg:Gorilla gorilla;Mm:Macaca mulatta (ABCA7),Mus musculus (ABCB12);Pt:Pan troglodytes;Cj: Callithrix jacchus;Mf:Macaca fascicularis;Xl:Xenopus laevis;Oc:Oryctolagus cuniculus;Lv: Lipotes vexillifer;Po:Paralichthys olivaceus;Tr:Takifugu rubripes;Hs:Homo sapiens;Sm: Selaginella moellendorffii;Sp:Strongylocentrotus purpuratus;Fa:Ficedula albicollis;Ph:Pseudopodoces humilis;At: Arabidopsis thaliana;Rb:Rhinopithecus bieti;Rr:Rhinopithecus roxellana;Sb:Saimiri boliviensis;Mu:Meriones unguiculatus;Oo:Orcinus orca;Ps:Pelodiscus sinensis;Bt:Bos Taurus;Cf:Canis familiaris;Tg:Taeniopygia guttata;Cg:Cricetulus griseus;Tg: Toxoplasma gondii.
1.2 ABC转运蛋白的结构与分类原则
近些年来,研究人员通过基因组测序确定了一些编码ABC转运蛋白的基因。并且,随着生物大分子结构解析技术的不断进步,几种ABC转运蛋白的晶体结构也已被成功解析,例如:金黄色葡萄球菌Staphylococcus aureus的Sav1866多药向外转运蛋白、闪烁古生球菌Archaeoglobus fulgidus的ModBC-A MoO4/WO4向内转运蛋白以及大肠杆菌的BtuCD维他命B12向内转运蛋白等[30]。基于这些已被解析清楚的晶体结构,研究者确定了ABC转运蛋白的基础结构,其核心是两个核苷酸结合域和两个跨膜结构域 (Transmembrane domains,TMDs)。此外,一些ABC转运蛋白通常还带有其他的辅助结构域 (图2)。这些结构域在原核生物中表现为单个亚基并通过将这些亚基组装到一起的方式发挥作用;而在真核生物中,它们则被表达为全转运子“full-transporters”(含有两个核苷酸结合域和两个跨膜结构域) 或半转运子“half-transporters”(只含一个核苷酸结合域和一个跨膜结构域)[31]。

图2 ABC转运蛋白经典结构模型Fig.2 Structure model of ABC transporter.*:not all ABC transporters have SBP.
研究发现,ABC转运蛋白的跨膜转运过程依赖于保守的耦联机制[32]。核苷酸结合域作为ABC转运蛋白家族的保守结构域,能够促使跨膜结构域发挥作用。它又包含了两个亚结构域,其中一个是结构类似于RecA的亚结构域,另一个则被称为“螺旋亚结构域”。而在核苷酸结合域中存在的一些保守序列基序具有特定的功能,其中最重要的就是位于类RecA亚结构域的P环 (Walker-A motifs) 和位于螺旋亚结构域的LSGGQ基序 (氨基酸序列)。在整个运输过程中,两个核苷酸结合域组装在一起,使这些保守基序以首尾相接的方式暴露。首尾相接的排列方式会在一个核苷酸结合域的P环和另一个核苷酸结合域间产生两个ATP结合和水解位点。在没有ATP结合的情况下,核苷酸结合域间的接口存在间隙,水能够进入ATP结合位点。ATP结合后,接口关闭,使ATP被夹在核苷酸结合域之间。研究人员通过研究几种ABC转运蛋白转运过程中共有的ATP水解反应发现,一次转运过程会消耗两分子的ATP[33]。
有关ABC转运蛋白的分类原则,目前最常见的是根据真核ABC转运蛋白结构域的同源性和蛋白系统进化关系,将其大致分为7个亚族(A–G)[2],但也有人认为可以分为8个亚族 (A–H,H族为暂无归类的ABC转运蛋白)[14]。亦有报道将这些亚族分别命名为多药耐药性蛋白、多向耐药性蛋白 (Pleiotropic drug resistance,PDR)、多药耐药性相关蛋白 (Multidrug resistance-associated protein,MRP)、肾上腺脑白质营养不良蛋白(Adrenoleukodystrophy protein,ALDp)、延伸因子3(Elongation factor-3,EF-3) 以及RNase L抑制因子 (RNase L inhibitor,RLI) 等[34-35]。其他分类方法包括:根据功能区域和亚基排列方式的不同,将ABC转运蛋白分为由一个或两个“核苷酸结合域-跨膜结构域”形式存在的独立肽链和4个功能区域混合在一起形成的完整肽链两大类;以及根据核苷酸结合域和跨膜结构域数量的不同,将ABC转运蛋白分为全转运子和半转运子[36]。值得注意的是,半转运子只有与另一个半转运子形成同源或异源的二聚体时才能发挥转运作用[21]。
1.3 ABC转运蛋白的转运机制与生理功能
ABC转运蛋白参与生物体中多种重要的转运过程,其转运功能需要核苷酸结合域和跨膜结构域的共同参与。ABC转运蛋白家族的转运功能分为向外和向内两种转运方式。研究人员[37]详细阐述了ABC转运蛋白转运过程中依靠构象改变的转运机制。如图3A所示,在向内转运过程中,首先,ABC转运蛋白处于向内构象(Inwardlyfacing conformation) 的“休息状态”,此时两个核苷酸结合域在跨膜结构域的带动下保持开放状态。当底物进入转运蛋白时,ATP与核苷酸结合域结合,跨膜结构域构象改变以从结合蛋白中接收底物,此时ABC转运蛋白变为向外构象 (Outwardfacing conformation)。随后,ATP水解成ADP和磷酸基团 (Pi),核苷酸结合域二聚体打开,底物被释放到细胞质中,ABC转运蛋白再次回到“休息状态”。
而向外转运过程,如图3B所示,转运首先从底物与ABC转运蛋白的结合开始,此时转运蛋白依然是向内构象的,但核苷酸结合域是打开的。随后ATP与核苷酸结合域结合并使其关闭,转运蛋白变为向外构象使底物暴露并被释放到细胞外。最后,ATP水解,核苷酸结合域再次打开,ABC转运蛋白恢复到初始构象。由此便完成了利用ATP水解产生的能量使底物从膜的一侧向另一侧的转运过程。另外有报道[38]从结构层面更为细致地解析了ABC转运蛋白的转运机制。仅以向外转运蛋白为例,在向外转运的过程中,底物分子由核苷酸结合域传递到跨膜结构域。跨膜结构域中存在一些结构保守的α螺旋,这些α螺旋会像通道一样耦合在一起,进而与核苷酸结合域中两个亚结构域的边界形成凹槽并相互作用。当ATP结合时,核苷酸结合域接口关闭,使耦合螺旋更加紧密,从而导致跨膜结构域从内向外翻转。ABC转运蛋白利用这一机制,将跨膜结构域中的结合和外排位点暴露在膜的另一侧,从而使底物单向移动通过磷脂双分子层。

图3 ABC转运蛋白转运机制示意图Fig.3 Transport mechanism of ABC transporter.(A) Import mechanism.(B) Export mechanism.
ABC转运蛋白能够实现多种物质的跨膜运输,因此无论在原核生物还是真核生物中都发挥着重要的生理功能。一些向内转运蛋白可以促进氨基酸、糖类等营养物质从胞外环境中转运进入胞内基质,从而促进细胞生长。最初科研工作者是在研究细菌对营养物质的吸收中发现了向内转运蛋白[1],并且在此后很长一段时间内,人们普遍认为向内转运蛋白只存在于原核生物中。直到2003年,植物中ABC向内转运蛋白的发现才改变了这一观点[14]。因此,向内转运蛋白不仅存在于原核生物中也存在于真核生物中。而向外转运蛋白同向内转运蛋白一样,共同存在于原核生物和真核生物中,它们具有“排毒”的功能,可将抗生素、脂肪酸等不利于细胞生长的物质排出胞外,有助于在细胞内将非必需的外源物质或次级代谢产物保持在较低的浓度范围,进而减轻了细胞的生长压力,维持了细胞的正常生长,极大地提升了细胞的存活率。ABC转运蛋白其他的生理功能还包括:参与真核生物中的信号转导、蛋白质的分泌以及抗原递呈等[3]。基于这些生理功能,科学家们受到了启发,使得ABC转运蛋白在各个领域中均得到了广泛的应用。
2 ABC转运蛋白在合成生物学中的应用
诸如pH值、温度、渗透压、有毒代谢产物等压力条件会对细胞生长产生不利影响并限制代谢产物的产生。因此,在外界压力条件下维持细胞正常生长和提高目标产物产量是微生物工业生产中最重要的目标。而细胞膜作为将细胞质与外界环境分隔开的细胞保护屏障[39-40],其在压力条件下的稳定性和膜脂质与膜蛋白的相互作用极大地影响了工业菌株的性能[41-43]。虽然由于工业菌株代谢的复杂性,改变膜功能以提高其底物耐受性并不会必然导致目标产物产量的增加[44],但也有一些代谢产物与膜功能之间存在良好的耦合关系[45-46],增强生产这些物质的工业菌株的鲁棒性将会提高目标产物的产量。因此,调节微生物膜功能以维持膜内稳态可能是一种提高微生物在工业生产中生产效率的有效方法。研究表明[47],可以通过增强膜的完整性、调节膜的流动性和调节膜的通透性来维持膜的稳态。依靠合成生物学的概念和技术,并结合基因工程和代谢工程,研究者们开发出了越来越多的策略以达到这一目的。其中,调节膜的通透性是指通过调节离子、营养物质和有毒物质的跨膜运输来调节细胞膜对它们的选择透过性。目前主要有3种调节膜通透性的策略:(1) 调节脂质介导的膜通透性[48];(2)调控膜蛋白功能[49-51];(3) 调控细胞膜内能量系统[52-53]。而ABC转运蛋白,作为一种利用细胞质中ATP水解产生的能量进而调控物质出膜/入膜的膜通道蛋白,能够在膜蛋白功能和细胞膜内能量系统两方面产生影响,因此可以对其进行修饰以调节膜的通透性。研究表明[47],这一策略具有可以同时改善菌株生长、提高底物利用率和菌株生产力的潜力。
2.1 ABC转运蛋白用于改善工业菌株性能
细胞膜的通透性主要体现在离子、营养物质和有毒物质通过膜孔或膜蛋白进入或离开细胞。据有关膜蛋白和膜通透性的研究指出,可以通过调控膜蛋白功能来调节膜的通透性[49-51]。而膜蛋白ABC转运蛋白可以像“泵”一样,将物质“泵入”或“泵出”细胞,是实现这一策略较优的研究对象。工程化的ABC转运蛋白可在微生物工业生产中用于改善工业菌株的性能,增强菌株耐受性并提高目标产物产量。
利用微生物合成游离的脂肪酸使得将可再生糖转化为油脂化学品具有良好的应用前景。然而,大肠杆菌作为这一途径的主要宿主,游离脂肪酸的产生会对其细胞膜的完整性和细胞生长产生负面影响。在类似于抗生素等生长选择性压力条件下,合成游离脂肪酸的大肠杆菌会在传代过程中被淘汰,以此来抵抗游离脂肪酸造成的这种负面影响,这也导致了工业生产中的遗传不稳定性[44]。而大肠杆菌内源的ABC转运蛋白AcrB与周质融合蛋白AcrA和膜通道蛋白TolC协同工作,形成一个跨膜复合物AcrAB-TolC (图4),复合物贯穿细胞膜并跨越周质形成桥,有助于游离脂肪酸的外排[54]。
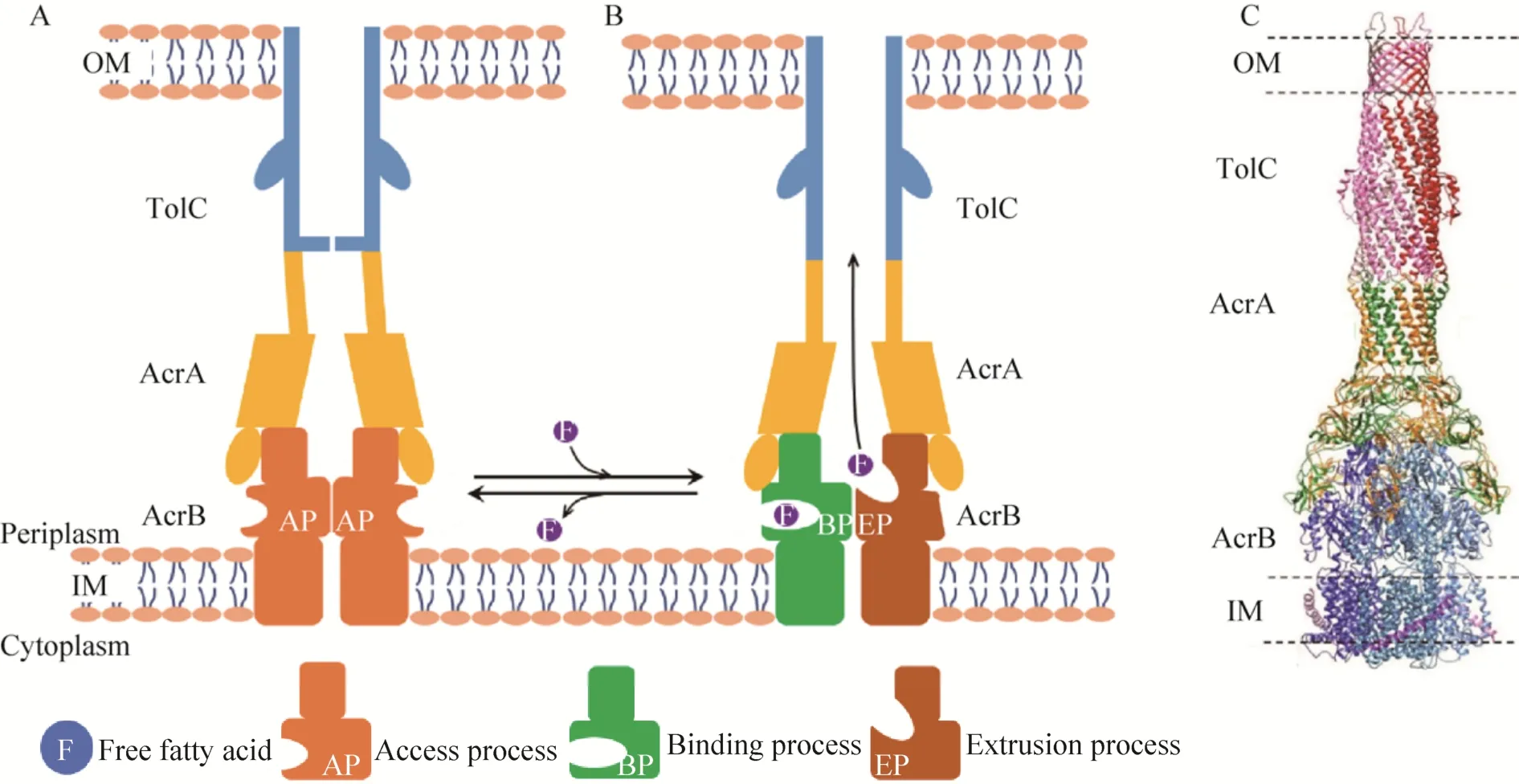
图4 AcrAB-TolC跨膜复合物Fig.4 Intermembrane AcrAB-TolC complex.(A) The resting state.(B) The transport-state.(A+B) Schematic of transport mechanism.(C) Structure of AcrAB-TolC[54].OM:outer membrane;IM:inner membrane.
Dunlop等[25]在大肠杆菌中分别表达了43个异源ABC转运蛋白,并采用一种基于竞争机制的筛选策略,在分别外加7种物质的条件下进行培养。除了两种化合物 (正丁醇和异戊醇) 没有筛选到可以提高耐受的转运蛋白外,其余5种均筛选到了对应的最优转运蛋白。随后,他们又在柠檬烯生产菌株中表达了其中一种筛选出来的泊库岛食烷菌Alcanivorax borkumensis来源的转运蛋白 (这一转运蛋白在当时还没有被表征,后来被证实为ABC转运蛋白AcrB),最终使柠檬烯的耐受性提高了8%,产量提高了近60%。这一结果表明,ABC转运蛋白可以在增强生产菌株耐受性的同时提高目标产物产量。Chen等[55]也通过在酿酒酵母中表达异源的ABC转运蛋白 (解脂耶氏酵母Yarrowia lipolytica来源) 发现,通过把细胞内癸烷和十一烷的浓度维持在较低水平的方式,ABC转运蛋白显著提高了酿酒酵母对于癸烷和十一烷的耐受性。
除了可以通过引入异源ABC转运蛋白来改善工业菌株的性能,过表达内源的ABC转运蛋白也可以达到这一目的。有研究发现,在酿酒酵母中,pdr18基因编码的ABC转运蛋白可以调节细胞质膜的通透性,影响胞内的乙醇浓度。研究人员利用强启动子上调了pdr18的表达,使乙醇产量提高了6%,产率提高了17%[56]。因此,通过在乙醇发酵中增强酿酒酵母的乙醇耐受性和抑制质膜的渗透能力,pdr18基因的过表达能够有效改善工业菌株的发酵性能。Nishida等构建了一株pdr1突变的酿酒酵母KK-211,该酿酒酵母中内源的4个ABC转运蛋白 (Snq2、Yor1、Pdr10、Pdr15)的表达水平被上调。对这4个蛋白的功能进行研究,表明Pdr10和Snq2负责调控疏水性有机溶剂正癸烷和正十一烷的耐受性,而Snq2和Yor1则负责调控酿酒酵母对亲水性有机溶剂的耐受性[57]。后续的应用研究结果显示,相比于野生型酿酒酵母,过表达内源ABC转运蛋白Snq2明显提高了菌株对于外源癸烷的耐受性并促进了菌株生长[58];过表达内源ABC转运蛋白Yor1有助于酿酒酵母抵御多种抗生素[24]。
2.2 基于ABC转运蛋白的负反馈调控系统
任何膜蛋白的过表达通常都会抑制细胞的正常生长,ABC转运蛋白也不例外。因此,为了平衡过表达ABC转运蛋白促进细胞毒素外排的同时又增加了细胞负荷所产生的正负影响,Boyarskiy等[29]在大肠杆菌中开发了一种自动反馈调控系统,调控机理见图5。该系统利用了大肠杆菌本源的应激启动子PgntK来负反馈调控转运蛋白的表达水平。将这一负反馈调控系统导入大肠杆菌DH10B中,该系统可自主调控正丁醇ABC转运蛋白突变体AcrBv2的表达水平,从而减轻了由于ABC转运蛋白过表达所造成的细胞负担,同时也促进了正丁醇的外排。最终,利用这一负反馈调控系统,Boyarskiy等将大肠杆菌的正丁醇耐受性提高了40%,产量提高了35%。因此,自动反馈调控系统在发挥ABC转运蛋白解毒作用的同时又避免了由于其过表达所导致的细胞毒性,为改善菌株的生长和生产提供了一种两全其美的手段。

图5 负反馈调控系统机理Fig.5 Mechanism of negative-feedback system.
2.3 ABC转运蛋白在调节胞内能量系统方面的应用
ATP作为细胞中最重要的能量来源,可通过改变其在细胞中的含量来调节微生物细胞内的能量系统。有报道称[59],ABC转运蛋白能利用ATP水解产生的能量将脂质从质体转移到内质网上,这有助于维持细胞膜脂质含量的稳定。并且通过参与细胞内膜和外膜的脂质翻转,ABC转运蛋白可以调节膜脂质的不对称性,进而调节细胞膜的通透性[60]。此外,物质可以借助ABC转运蛋白将其转运活性与ATP水解耦联,从而完成逆浓度梯度的转运 (应用实例见图6)。因此,通过ABC转运蛋白调控ATP在胞内的含量也被认为是一种调节细胞膜对底物透过性的有效策略。
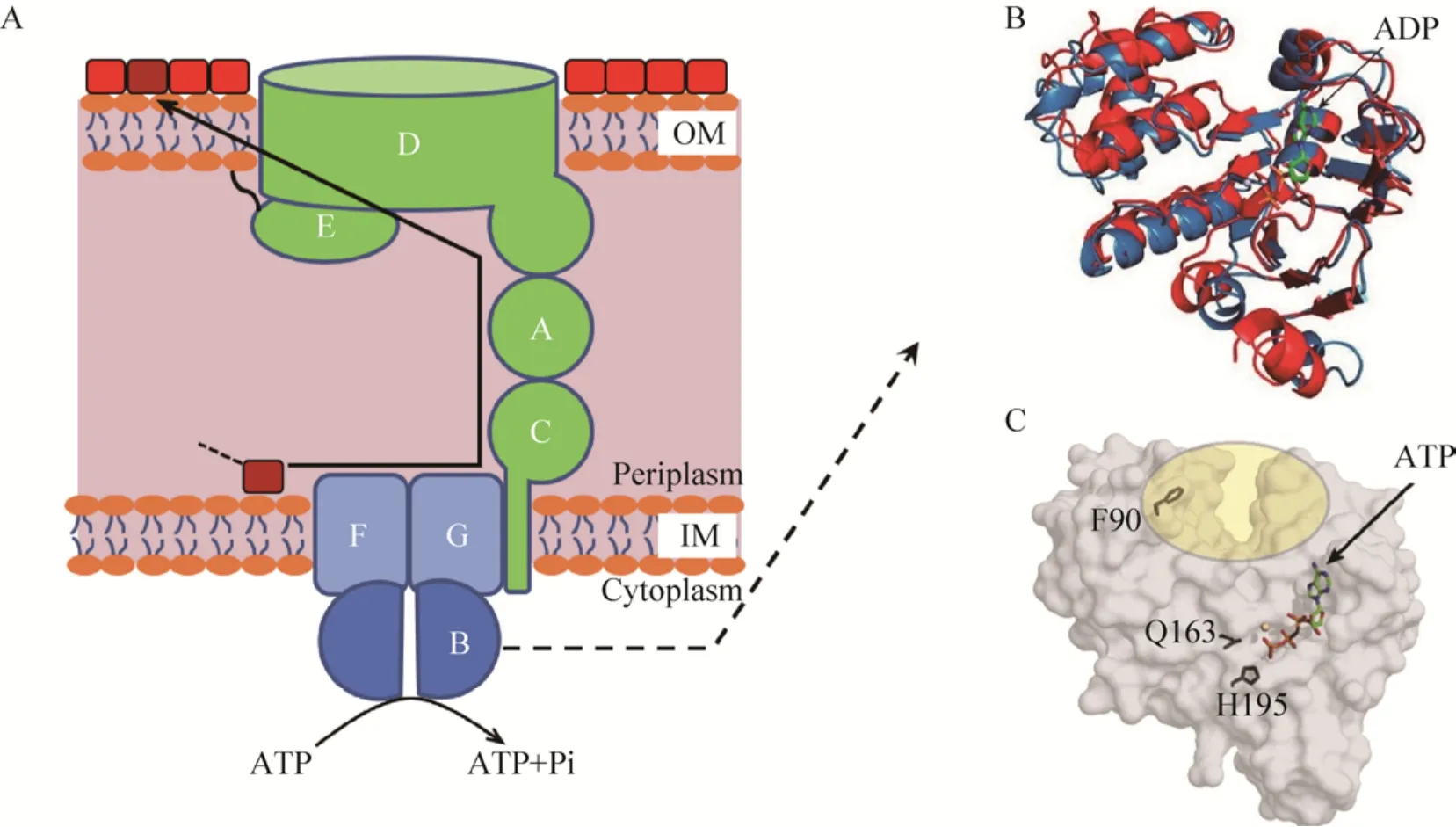
图6 ABC转运蛋白调节胞内能量系统的应用 (以革兰氏阴性菌细胞表面脂多糖的转运为例)Fig.6 Application of ABC transporter in tuning intracellular energy system (The transport of lipopolysaccharides on the cell surface of Gram-negative bacteria as an example).(A) Schematic of transport mechanism.(B) Structural overlay of LptB shows conformational changes upon ATP hydrolysis[26].(C) Structural observation of LptB implicates a key binding site[26].OM:outer membrane;IM:inner membrane;LPS:lipopolysaccharides;A:LptA;B:LptB;C:LptC;D:LptD;E:LptE;F:LptF;G:LptG.
革兰氏阴性菌细胞表面含有脂多糖。脂多糖是一种含有多个脂肪酰基链的大型糖脂类物质,构成细胞膜外侧的疏水区,正是由于它的存在使细胞膜可以作为屏障,阻止大部分抗生素进入细胞中。Sherman等[26]通过使在脂多糖装配过程中负责将其转运的ABC转运蛋白失活,并利用生化实验结合ABC转运蛋白在ATP水解前后的高分辨率晶体结构进行表征,最终发现了在大肠杆菌中相关ABC转运蛋白的失活会减缓ATP水解,从而降低了脂多糖从膜内向膜外的运输效率,使细胞膜对抗生素的抵抗作用减弱。与此类似,May等[52]使用一种对于新生霉素 (Novobiocin) 敏感的细胞膜缺陷型大肠杆菌筛选到一株对新生霉素抗性增强的突变体。对这一突变体进行研究发现,抗性增强是由于细胞内负责脂多糖转运的ATP酶,即ABC转运蛋白发生了改变。共晶体结构、生化和遗传数据表明,新生霉素会与这种ATP酶直接结合,但它并不结合在核苷酸结合域上,而是结合在核苷酸结合域与跨膜结构域之间的接口。这种相互作用增强了负责转运脂多糖的ABC转运蛋白的活性,进而改变了细胞膜的通透性。这一发现有助于人们理解ATP水解与脂多糖转运之间的关系。此外,Causey等[61]发现,在大肠杆菌中同时缺失包括ABC转运蛋白在内的一些与ATP产生相关的膜蛋白和其他与丙酮酸氧化有关的蛋白,导致了细胞膜对于葡萄糖的透过性增加,从而促进了葡萄糖的积累,同时降低了胞内ATP的含量,减弱了丙酮酸到乙酸的代谢,最终使丙酮酸的产量增加了2.1倍。这些实例证实了,ABC转运蛋白具有通过调节细胞内能量系统来改善菌株性能的前景。
2.4 其他
除上述应用外,ABC转运蛋白还因其可将肿瘤治疗药物从肿瘤细胞中排出胞外,而被作为多药耐药性抑制靶点被应用在肿瘤临床治疗中[2];在新能源开发方面,工程化的ABC转运蛋白可增强微生物对于生物燃料的耐受性,对于提高生物燃料的产量具有良好的应用前景[62];ABC转运蛋白还可以提高植物和真菌的重金属耐性,因此在环境保护和改善环境方面也得到了相应的应用[36,63]。此外,ABC转运蛋白还被应用于植物栽培、药理研究以及农药研发等的工作中[3,64],在此不再一一赘述。
3 总结与展望
近些年来,随着ABC转运蛋白的相关研究逐渐增多,其结构信息和作用机制也越来越清晰,这大大加深了研究者们对ABC转运蛋白构效关系的认知,丰富了ABC转运蛋白在各个领域中的应用潜力。如今,ABC转运蛋白不再只是作为降低恶性肿瘤耐药性的靶点而被应用在生物医学和毒理学领域的研究中。在微生物工业生产中,如何利用工程化的ABC转运蛋白,来提高工业菌株的特定性能,进而提升目标产物产量等的研究也受到研究者们越来越广泛的关注。但相比于ABC转运蛋白的庞大家族,目前的研究还是远远不够的。有关ABC转运蛋白底物的研究有待补充,比如一种转运蛋白是否具有底物特异性,是否可以同时转运多种不同的底物。此外,有关ABC转运蛋白的人工设计改造也相对较少。如何通过一些技术手段改造ABC转运蛋白以提高它的转运效率,如何增强它的底物转运特异性从而实现ABC转运蛋白的“定制化”还有待相关科研工作者们的进一步努力。随着生物技术的快速发展和合成生物学的兴起,将会有越来越多新的策略和新的技术用来研究ABC转运蛋白和扩展其应用。ABC转运蛋白也将在合成生物学领域发挥越来越重要的作用。
