山慈菇通过PI3K/Akt信号通路影响乳腺癌MDA-MB-231细胞的增殖和凋亡①
2020-04-13徐志峰宋易华
兴 伟 刘 远 徐 曌 徐志峰 宋易华
(河北省中医院外一科,石家庄 050000)
乳腺癌是女性较为常见的恶性肿瘤之一,对女性患者的生命健康造成严重危害。中医在我国治疗恶性肿瘤方面积累了丰富的临床经验,多种中药成分具有抗肿瘤作用。山慈菇药性甘、微辛,具有解毒消肿、化痰散结的功效,在抑制新生血管生成和抗肿瘤方面也具有重要作用[1]。研究发现山慈菇在胃癌、大肠癌、食管癌、肺癌等多种恶性肿瘤的治疗中具有抗肿瘤作用,对乳腺癌细胞的生长也有抑制作用[2]。但山慈菇抑制乳腺癌细胞生长的机制尚不清楚。磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路在多种恶性肿瘤的生长、耐药、转移等方面具有重要作用,在乳腺癌细胞的增殖、凋亡、迁移和侵袭方面也发挥重要作用[3,4]。本文对山慈菇对乳腺癌MDA-MB-231细胞的增殖、凋亡及PI3K/Akt信号通路的影响进行研究,探讨山慈菇是否通过PI3K/Akt信号通路影响乳腺癌细胞的增殖和凋亡,现报告如下。
1 材料与方法
1.1材料 药物:山慈菇(北京同仁堂药店),乳腺癌MDA-MB-231细胞(中科院上海生命科学研究院细胞库),胰岛素生长因子1(IGF-1)、二甲基亚砜、噻唑蓝(MTT)、膜联蛋白-异硫氰酸荧光素(Aneexin V-FITC)/碘化丙啶(PI)细胞凋亡试剂盒、二奎啉甲酸(BCA)蛋白检测试剂盒(美国Sigma公司),RPMI 1640培养基、胎牛血清、RIPA裂解液、化学发光(ECL)显色液(美国Gibco公司),兔抗人活化的半胱天冬3(Cleaved-Caspase-3)多克隆抗体、兔抗人Bcl-2相关X蛋白(Bax)多克隆抗体、兔抗人B-细胞淋巴瘤因子(Bcl-2)多克隆抗体、兔抗人PI3K多克隆抗体、兔抗人磷酸化-PI3K(p-PI3K)多克隆抗体、兔抗人Akt多克隆抗体、兔抗人p-Akt多克隆抗体、β-actin、羊抗兔二抗(美国Abclonal公司)等。
1.2方法
1.2.1山慈菇提取液制备 将山慈菇粉碎,用去离子水浸泡2 h,水煎法制备山慈菇提取液,提取液用旋转蒸发仪进行浓缩,制备山慈菇提取液浓度为1 g/ml,高压灭菌后保存备用。
1.2.2MTT法测定MDA-MB-231细胞增殖 将山慈菇提取液用培养基分别稀释为0 mg/ml(只含培养基,不加山慈菇提取液)、5 mg/ml、10 mg/ml、 20 mg/ml、40 mg/ml、80 mg/ml。将MDA-MB-231细胞接种到6孔板上(浓度为1×105ml-1),每孔接种100 μl,置培养箱中培养24 h,加入上述各浓度的山慈菇提取液,每种浓度设7个复孔,培养24 h后加入MTT(5 mg/ml)15 μl继续培养4 h,弃去上清液,加入二甲基亚砜孵育10 min,酶标仪测定波长490 nm处吸光度值(OD),计算细胞抑制率,细胞抑制率=(1-观察组OD值/空白对照组OD值)×100%。计算山慈菇提取液的半数抑制浓度(IC50)为10.32 mg/ml,故取山慈菇提取液浓度为10 mg/ml进行后续实验。按上述实验方法测定加入10 mg/ml山慈菇培养0 h、24 h、72 h时MDA-MB-231细胞的增殖抑制率。
1.2.3细胞分组和处理 将生长良好的MDA-MB-231细胞分为对照组(C组)、山慈菇组(CAM组)、胰岛素生长因子1组(IGF-1组)、山慈菇+胰岛素生长因子1组(CAM+IGF-1组)。C组不加药物处理,CAM组加入10 mg/ml山慈菇处理,IGF-1组加入100 μg/L IGF-1处理,CAM+IGF-1组加入10 mg/ml山慈菇和100 μg/L IGF-1共处理。
1.2.4MTT法测定各组细胞增殖 取上述各组生长良好的MDA-MB-231细胞,采用MTT法测定细胞OD值(方法同上),每组设7个复孔。
1.2.5流式细胞仪测定细胞凋亡 取各组生长良好的MDA-MB-231细胞接种到6孔板中(浓度为1×105ml-1)培养,每孔2 ml,第2天细胞贴壁生长后加入各组相应的药物处理,每组设7个复孔,培养24 h后收集各组细胞,移至离心管中,加入胰蛋白酶消化,显微镜下见细胞间隙变大、胞质回缩、胞体变圆时快速吸除胰蛋白酶,加入培养液,离心(1 000 r/min)5 min,加入PBS液重悬细胞,离心(1 000 r/min)5 min,加入Annexin V-FITC液重悬细胞。对照组3管依次不加染料、单加Annexin V-FITC、单加碘化丙啶染色液;药物组一次加入Annexin V-FITC,再加入PI染色液孵育20 min,采用流式细胞仪检测各组MDA-MB-231细胞凋亡情况。
1.2.6Hoechst 33258染色 在6孔板中加入细胞爬片盖玻片,用RPMI1640培养基浸润孔底,取各组对数生长的MDA-MB-231细胞接种到6孔板中(浓度为1×105ml-1),每孔2 ml,每组设7个复孔,待细胞下沉到孔底后放入培养箱中培养,显微镜下观察细胞贴壁后吸除培养液,每组加入对应的药物处理,放入培养箱中继续培养,48 h后吸除培养液,加入固定液固定30 min,加入Hoechst 333258染色液孵育5 min,去除染色液,滴加抗荧光猝灭封片液,荧光显微镜下拍照并观察细胞染色情况。细胞核饱满,被染成均匀蓝色为正常细胞;细胞核透亮固缩为凋亡细胞。
1.2.7Western blot法测定细胞Cleaved-Caspase-3、Bax、Bcl-2蛋白及PI3K、p-PI3K、Akt、p-Akt蛋白水平 将各组MDA-MB-231细胞加入相应药物处理48 h 后,移至EP管中离心13 000 r/min离心1 min,将细胞沉淀中加入RIPA蛋白裂解液裂解30 min,提取总蛋白,采用BCA法测定各组MDA-MB-231细胞蛋白浓度。取25 μg蛋白进行电泳、转膜、封闭后,分别加入一抗:兔抗人Cleaved-Caspase-3多克隆抗体(1∶1 000)、兔抗人Bax多克隆抗体(1∶1 000)、兔抗人Bcl-2多克隆抗体(1∶1 000)、兔抗人PI3K多克隆抗体(1∶1 000)、兔抗人p-PI3K多克隆抗体(1∶1 000)、兔抗人Akt多克隆抗体(1∶1 000)、兔抗人p-Akt多克隆抗体(1∶1 000),以β-actin(1∶1 000)为内参照,过夜孵育,加入羊抗兔二抗(1∶2 000)孵育2 h,加入ECL显影,用ImageQuant LAS 4000曝光成像,采用BandScan图像分析软件分析条带灰度值,目标蛋白水平以目标蛋白条带灰度值/β-actin条带灰度值表示。

2 结果
2.1山慈菇提取液对MDA-MB-231细胞增殖的影响 MTT结果显示,作用24 h时,山慈菇提取液浓度为0 mg/ml、5 mg/ml、10 mg/ml、 20 mg/ml、40 mg/ml、80 mg/ml时MDA-MB-231细胞的增殖抑制率先上升后下降,山慈菇提取液浓度在0~20 mg/ml 时细胞增殖抑制率随浓度增加而增加,浓度在20~80 mg/ml时细胞增殖抑制率随浓度增加而降低;浓度为20 mg/ml时细胞增殖抑制率最高,见图1。经计算山慈菇提取液的半数抑制浓度(IC50)为10.32 mg/ml,故取山慈菇提取液浓度为10 mg/ml进行后续实验。
浓度为10 mg/ml时,山慈菇提取液对MDA-MB-231细胞增殖抑制率的影响随时间增加而增加,见图2。
2.2各组MDA-MB-231细胞增殖比较 各组MDA-MB-231细胞增殖比较差异有统计学意义(F=4.254,P=0.015),与C组(0.38±0.12)比较,CAM组MDA-MB-231细胞OD值(0.21±0.09)降低(P<0.05),与CAM组比较,CAM+IGF-1组MDA-MB-231细胞OD值(0.35±0.11)升高(P<0.05),IGF-1组MDA-MB-231细胞OD值(0.41±0.13)与C组比较差异无统计学意义(P>0.05),见图3。
2.3各组MDA-MB-231细胞凋亡率比较 各组MDA-MB-231细胞凋亡率比较差异有统计学意义(F=190.965,P=0.000), 与C组[(7.26±1.42)%]比较,CAM组MDA-MB-231细胞凋亡率[(21.54±2.31)%]升高(P<0.05),与CAM组比较,CAM+IGF-1组MDA-MB-231细胞凋亡率[(8.32±0.21)%]降低(P<0.05),IGF-1组MDA-MB-231细胞凋亡率[(6.57±0.16)%]与C组比较差异无统计学意义(P>0.05),见图4和图5。

图1 不同浓度山慈菇提取液对MDA-MB-231细胞增殖抑制率的影响Fig.1 Effect of different concentrations of cremastra appendiculata makino on MDA-MB-231 cell proliferation inhibition rate

图2 不同时间山慈菇提取液对MDA-MB-231细胞增殖抑制率的影响Fig.2 Effect of cremastra appendiculata makino on MDA-MB-231 cell proliferation inhibition rate at different times

图3 各组MDA-MB-231细胞OD值Fig.3 OD values of each group of MDA-MB-231 cells
2.4各组MDA-MB-231细胞Hoechst染色比较 C组细胞核饱满,被染成均匀的蓝色;CAM组细胞数量减少,细胞核透亮固缩; IGF-1组和CAM+IGF-1组细胞核染色和对照组差别不大。各组MDA-MB-231细胞凋亡率比较差异有统计学意义(F=66.201,P=0.000),与C组[(12.51±4.47)%]比较,CAM组MDA-MB-231细胞凋亡率[(43.23±5.14)%]升高(P<0.05),与CAM组比较,CAM+IGF-1组MDA-MB-231细胞凋亡率[(14.43±5.48)%]降低(P<0.05),IGF-1组MDA-MB-231细胞凋亡率[(10.26±5.03)%]与C组比较差异无统计学意义(P>0.05),见图6、7。
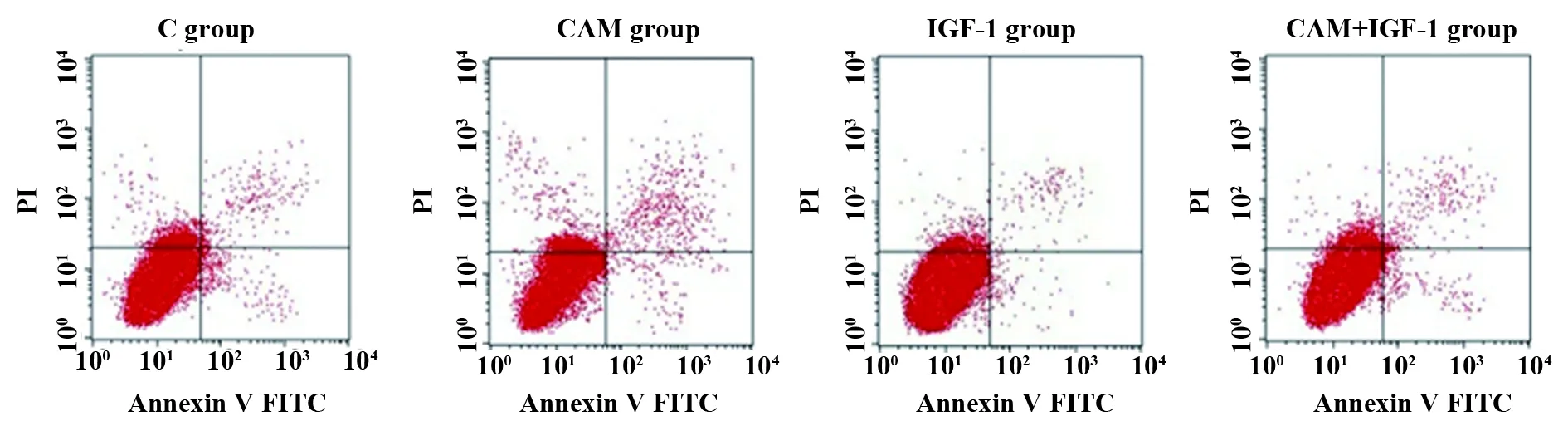
图4 流式细胞仪测定各组MDA-MB-231细胞凋亡Fig.4 Flow cytometry for determination of apoptosis in each group of MDA-MB-231 cells
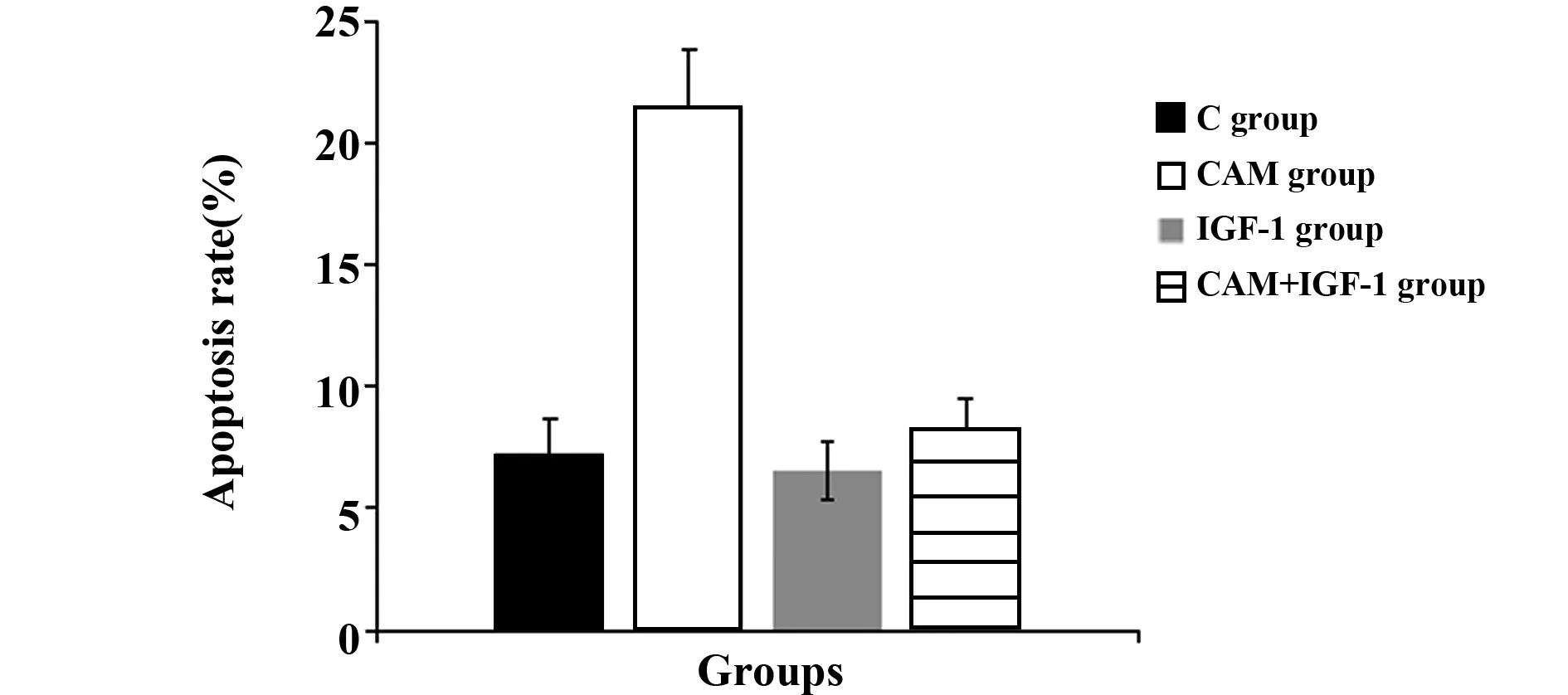
图5 流式细胞仪测定各组MDA-MB-231细胞凋亡率Fig.5 Flow cytometry to determine apoptosis rate of each group of MDA-MB-231 cells
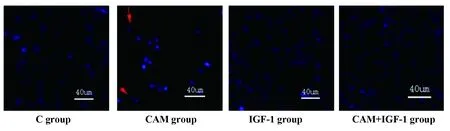
图6 各组MDA-MB-231细胞Hoechst染色(×400)Fig.6 Hoechst staining of each group of MDA-MB-231 cells (×400)
2.5各组细胞Cleaved-Caspase-3、Bax、Bcl-2蛋白水平比较 与C组比较,CAM组MDA-MB-231细胞Cleaved-Caspase-3、Bax蛋白水平升高(P<0.05),Bcl-2蛋白水平降低(P<0.05);与CAM组比较,CAM+IGF-1组MDA-MB-231细胞Cleaved-Caspase-3、Bax蛋白水平降低(P<0.05),Bcl-2蛋白水平升高(P<0.05),见表1和图8。
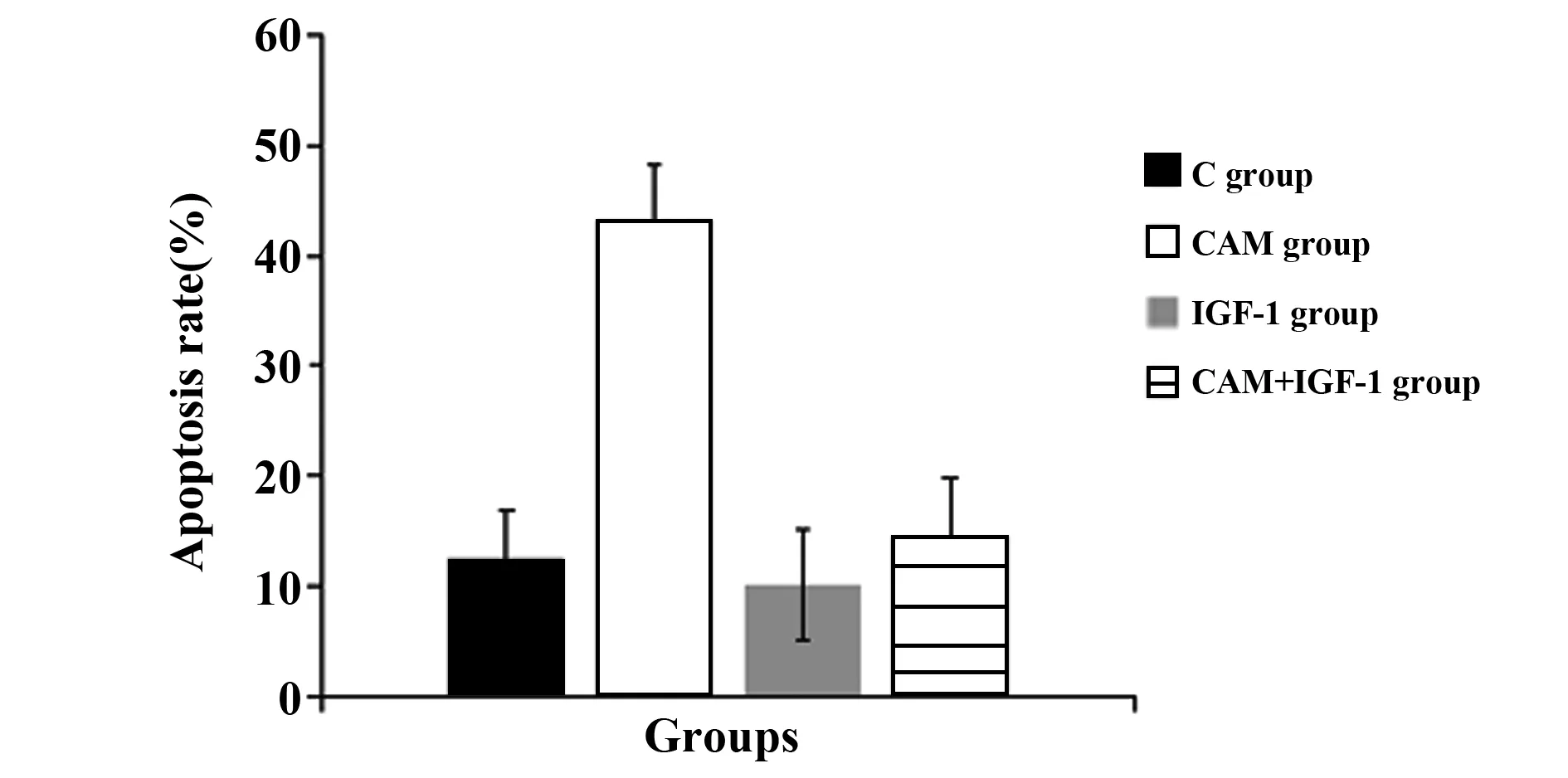
图7 Hoechst染色测定各组MDA-MB-231细胞凋亡率Fig.7 Hoechst staining for determination of apoptotic rate in each group of MDA-MB-231 cells



GroupsCleaved-Caspase-3BaxBcl-2C group0.32±0.070.26±0.050.51±0.08CAM group0.45±0.061)0.42±0.071)0.09±0.041)IGF-1 group0.33±0.080.24±0.050.50±0.09CAM+IGF-1 group0.31±0.072)0.27±0.062)0.47±0.112)F6.06914.15640.668P0.0030.0000.000
Note:Compared with the C group,1)P<0.05;compared with the CAM group,2)P<0.05.

图8 各组细胞Cleaved-Caspase-3、Bax、Bcl-2蛋白Western blot电泳图Fig.8 Western blot analysis of Cleaved-Caspase-3,Bax and Bcl-2 proteins in each group of cellsNote: 1.C group;2.CAM group;3.IGF-1 group;4.CAM+IGF-1 group.


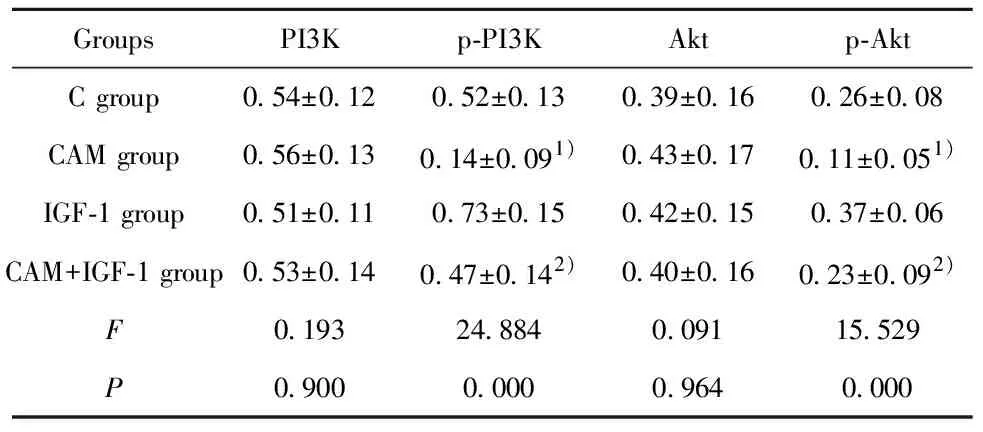
GroupsPI3Kp-PI3KAktp-AktC group0.54±0.120.52±0.130.39±0.160.26±0.08CAM group0.56±0.130.14±0.091)0.43±0.170.11±0.051)IGF-1 group0.51±0.110.73±0.150.42±0.150.37±0.06CAM+IGF-1 group0.53±0.140.47±0.142)0.40±0.160.23±0.092)F0.19324.8840.09115.529P0.9000.0000.9640.000
Note:Compared with the C group,1)P<0.05;compared with the CAM group,2)P<0.05.
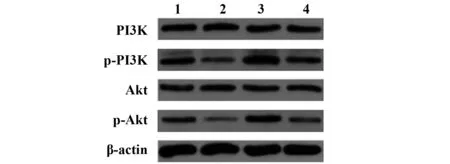
图9 各组细胞PI3K、p-PI3K、Akt、p-Akt蛋白Western blot电泳图Fig.9 Western blot analysis of PI3K,p-PI3K,Akt and p-Akt proteins in each group of cellsNote: 1.C group;2.CAM group;3.IGF-1 group;4.CAM+IGF-1 group.
2.6各组细胞PI3K、p-PI3K、Akt、p-Akt蛋白水平比较 各组MDA-MB-231细胞PI3K、Akt蛋白水平比较差异无统计学意义(P>0.05),各组MDA-MB-231细胞p-PI3K、p-Akt蛋白水平比较差异有统计学意义(P<0.05),其中与C组比较,CAM组p-PI3K、p-Akt蛋白水平降低(P<0.05);与CAM组比较,CAM+IGF-1组p-PI3K、p-Akt蛋白水平升高(P<0.05),见表2和图9。
3 讨论
山慈菇是兰科植物杜鹃兰、独蒜兰、云南独蒜兰的干燥假鳞茎,杜鹃兰是山慈菇的主流品种,在临床抗肿瘤方面具有良好效果[5]。山慈菇抗肿瘤的机制包括:山慈菇的某些化学成分可直接杀伤肿瘤细胞,具有细胞毒作用;山慈菇中含有的多糖成分可改变恶性肿瘤细胞的细胞膜生长特性、抑制恶性肿瘤细胞的生长周期,从而抑制恶性肿瘤细胞的增殖,发挥抗肿瘤作用;山慈菇可通过诱导恶性肿瘤细胞凋亡,发挥抗肿瘤作用;山慈菇可通过降解细胞外基质和基底膜抑制恶性肿瘤细胞侵袭和迁移;山慈菇可通过抑制肿瘤新生血管生成抑制肿瘤生长[6,7]。近年来研究发现山慈菇对乳腺癌细胞的生长具有抑制作用,如牛晓雨等[8]研究发现山慈菇水煎剂可抑制乳腺癌MDA-MB-231细胞的增殖,将细胞周期阻滞在G2期,并可促进乳腺癌细胞凋亡,有效抑制乳腺癌细胞迁移。本文研究发现山慈菇提取液可抑制乳腺癌MDA-MB-231细胞增殖,其对乳腺癌MDA-MB-231细胞增殖的抑制作用随剂量的增加先升高后下降,分析可能为:山慈菇提取液的过量应用,对乳腺癌细胞增殖的抑制作用反而减弱,其具体机制有待进一步研究;而在安全剂量范围内,山慈菇提取液对乳腺癌细胞增殖的抑制作用随剂量增加而增加,具有一定剂量依赖性。根据山慈菇提取液的IC50为10.32 mg/ml,取山慈菇提取液浓度为10 mg/ml 进行研究,发现山慈菇提取液可抑制乳腺癌MDA-MB-231细胞增殖、诱导乳腺癌MDA-MB-231细胞凋亡。
细胞凋亡是一种主动发生的程序性死亡,由基因介导产生;细胞凋亡除了在正常生理过程中发生外,在恶性肿瘤等多种疾病中也存在细胞凋亡现象,细胞凋亡减少而细胞增殖过度则引起恶性肿瘤的发生发展[9]。恶性肿瘤的发生和恶性肿瘤细胞的增殖失控和凋亡减少关系密切,多种抗凋亡细胞因子和促凋亡细胞因子在细胞增殖和凋亡中发挥重要作用;凋亡是由多种基因严格控制的,主要包括癌基因C-myc、抑癌基因P53以及Caspase家族和Bcl-2家族[10]。Caspase家族的凋亡途径包括线粒体介导的内源性途径和死亡受体介导的外源性凋亡途径[11]。Bcl-2家族和线粒体介导的内源性凋亡途径关系密切;在DNA损伤等内部信号刺激下,细胞浆Bcl-2家族成员聚集到线粒体,在抗凋亡因子和促凋亡因子的作用下,调节释放细胞色素C,细胞色素C在胞浆中和凋亡因子结合形成多聚体,引起Caspase-9活化,激活的Caspase激活其下游的Caspase-3,引起细胞凋亡的发生;作为抑制凋亡基因的Bcl-2在生长因子受体的介导中发挥作用,通过抑制细胞凋亡参与恶性肿瘤的发病[12]。Bax则与Bcl-2相反,可促进细胞凋亡;Bcl-2过表达和Bax形成二聚体,抑制细胞凋亡,Bax过表达可形成同源二聚体诱导细胞凋亡[13]。山慈菇可通过影响Caspase-3、Bax、Bcl-2表达发挥抗肿瘤作用,如于林楠等[14]研究发现山慈菇提取物可通过提高Caspase-3、Bax表达以及降低Bcl-2表达抑制结肠癌HT29细胞增殖,诱导结肠癌细胞凋亡,发挥抗结肠癌的作用。
PI3K/Akt信号通路在多种生命发挥中发挥关键性作用,在恶性肿瘤的发生发展中也发挥关键信号通路的作用[15,16];研究发现PI3K/Akt信号通路在恶性肿瘤的发生发展、化疗耐药、侵袭、转移中具有重要作用[17,18]。多种因素可调控PI3K/Akt信号通路的激活,活化的PI3K(即磷酸化的PI3K)可激活其下游的AKT,激活的AKT通过磷酸化可促进其下游的抗凋亡基因Bcl-2的表达,抑制Caspase-3、Bax的表达,从而发挥抗凋亡的作用[19,20]。
多种中药成分可通过PI3K/Akt信号通路影响乳腺癌细胞的生长,如韦立群等[21]研究发现金雀异黄酮可通过抑制PI3K/Akt信号通路下调Bcl-2的表达,促进Caspase-3和Bax的表达抑制三阴乳腺癌MDA-MB-231细胞生长并诱导其凋亡;刘楠等[22]研究发现红花多糖通过阻断PI3K/Akt通路诱导乳腺癌细胞MDA-MB-435的凋亡。介于上述研究,推测山慈菇可能通过抑制PI3K/Akt信号通路抑制乳腺癌细胞生长,本文对该推测进行研究,发现山慈菇可升高乳腺癌MDA-MB-231细胞中Cleaved-Caspase-3、Bax蛋白水平,降低Bcl-2、p-PI3K、p-Akt蛋白水平。IGF-1可以通过PI3K磷酸化而被激活,激活的PI3K引起其下游的AKT磷酸化而被活化,因此IGF-1为常用的PI3K/Akt信号通路激动剂。本文采用IGF-1和山慈菇共同作用于乳腺癌MDA-MB-435细胞,发现IGF-1可抵消山慈菇对乳腺癌MDA-MB-435细胞增殖、凋亡及Cleaved-Caspase-3、Bax、Bcl-2、p-PI3K、p-Akt蛋白水平的影响。由此表明山慈菇可能通过抑制PI3K/Akt信号通路影响其下游抑癌基因Bax和促癌基因Bcl-2、Caspase-3的表达,从而促进乳腺癌细胞增殖,诱导其凋亡。
综上所述,山慈菇可能通过PI3K/Akt信号通路影响其下游的促凋亡及抗凋亡基因的表达促进乳腺癌细胞增殖、抑制乳腺癌细胞凋亡。
