食管鳞癌患者唾液菌群的研究
2020-04-11位俊敏李锐锋杨冬阳赖晓嵘刘婉薇蔡先彬贲晓松李子俊
位俊敏,李锐锋,杨冬阳,赖晓嵘,刘婉薇,蔡先彬,贲晓松,李子俊,1
(1.南方医科大学第二临床医学院,广东广州510515,2.广东省人民医院//广东省医学科学院,广东广州510080,3.汕头大学医学院第一附属医院,广东汕头 515041)
食管癌是全球第九大常见癌症,也是世界上第六大癌症死亡原因,2018 年估计有572 034 个新发病例和508 585 人死亡[1]。食管鳞癌约占食管癌总发病率的90%,中国约占全球食管癌总发病率的50%[2]。食管鳞癌的病因尚未清楚,既往认为与饮酒、吸烟、热饮等生活习惯有关。随着分子生物学高通量测序技术的发展应用,微生态成为目前研究热点之一。已有研究证明食管鳞状细胞癌患者癌组织及癌旁正常组织发现牙龈卟啉单胞菌的感染,而健康对照组食管黏膜无感染,提示该菌可能在食管鳞癌中的致病作用,且该菌的存在与食管鳞癌的严重程度(即癌细胞分化和转移)呈正相关,临床预后差[3]。但有关口腔唾液菌群与食管癌的关系却未见报道。而已有来自中国、印度、伊朗等几个食管癌高发地区及包括拉丁美洲和日本在内的多个地区的研究表明口腔卫生不良指标与食管鳞癌之间存在关联[4-7]。众所周知,口腔微生物群在维持正常口腔生理环境中起着至关重要的作用。口腔微生物可能通过直接代谢化学致癌物[8-9]和全身炎症作用[10]在癌症和其他慢性病中发挥重要作用。并且已有研究报道牙齿脱落和口腔卫生不良与上消化道癌密切相关,表明口腔微生物在上消化道癌症发生发展中的可能作用[11-12]。因此,基于以上研究,我们使用16s rDNA测序方法研究食管鳞癌患者唾液中的口腔微生物菌群,期望在食管鳞癌患者唾液中筛查出特异性表达的细菌,为食管鳞癌的早期筛查提供快速简单的方法。
1 材料与方法
1.1 研究对象
于2018 年1-12 月在广东省人民医院(广东省医学科学院)伟伦内镜中心分别收集初诊食管鳞癌(ESCC 组)成人患者唾液50 例和正常对照组(HC 组)成年健康志愿者唾液40 例。所有食管癌患者均经病理活检证实为食管鳞状细胞癌,且无伴发其他器质性、系统性疾病,如无肝炎、糖尿病等。健康对照者为无器质性疾病、系统性疾病、口腔疾病、肿瘤家族史的健康人。具有以下任意一项则为排除对象:①既往有食管癌放化疗及手术史;②合并其他部位肿瘤、器质性疾病、急性口腔感染、HBV、HCV 疾病;③采集唾液前4 周内有腹泻病史或感染性疾病史;④采集唾液前4 周内使用抗生素或PPI 或其他抑酸药物;⑤采集唾液前4 周内服用激素、调节肠道菌群相关药物,如培菲康、金双歧、适怡等微生态制剂;⑥妊娠哺乳期。两组在年龄、性别比例以及民族3 项指标匹配。纳入的研究对象均已签署知情同意书。
1.2 研究方法
1.2.1 样本收集 收集前需禁食、禁饮、禁烟和禁止口腔清洁2 h 以上。收集唾液时间每日固定为上午8:00~11:00,先使用10 mL 生理盐水漱口,共漱口3 次,唾液收集量需达5 mL 以上,收集管使用50 mL 无菌无酶离心管。收集的唾液30 min 内用冰盒运送至-80 ℃冰箱保存以便后续使用。
1.2.2 DNA 提取及储存 用UltraClean®Microbial DNA Isolation Kit(美国,MOBI公司)提取细菌DNA,DNA 提取方法按照试剂盒说明书进行。收集滤液,保存在-20 ℃冰箱。要求DNA 总量≥150 ng;DNA 浓度≥5 ng/μL;有明显主带,无降解、无RNA和蛋白质等杂质污染。
1.2.3 16s RNA 测序及数据预处理 对合格的DNA 样品取适量置于离心管中,根据V4 区使用带Barcode 的引物515F 和806R,进行PCR,PCR 在缓冲液中进行,另外加入2×Premix Taq 引物酶及dNTP,然后进行热循环,在94 ℃条件下变性5 min,再进行30 个循环包括94 ℃变性30 s,52 ℃退火30 s 及72 ℃延伸30 s,再于72 ℃充分延伸10 min。最后置于4 ℃保存。用1%琼脂糖凝胶电泳检测PCR 产物的片段长度和浓度,主带长度在正常范围内的样品可用于进一步的研究。利用GeneTools Analysis Software 对PCR 产物进行浓度对比后,按照等质量原则计算各样品所需体积,将各PCR 产物进行混合。使用E.Z.N.A.Gel Extraction Kit 凝胶回收试剂盒回收PCR 混合产物,TE 缓冲液洗脱回收目标DNA 片段。按照NEBNextUltraDNA Library Prep Kit for Illumina®标准流程进行建库操作。使用Illumina Hiseq2500 平台对构建的扩增子文库进行PE250测序。利用Trimmomatic软件对测序数据进行Paired-end raw Reads 过滤,利用FLASH 对每对PE reads 进行拼接,利用Mothur软件进行Raw Tags 序列质量过滤,最终得到有效的拼接片段(Clean Tags)。
1.2.4 生物信息学分析 利用usearch 软件(V10)对所有样品的全部Clean Tags 进行聚类,默认以97%的一致性将序列聚类成为OTU(operational taxonomic units),对OTU 的具有代表性的序列进行物种注释,并进行Alpha 多样性分析、Beta 多样性分析及LEfSe 分析等。
1.3 统计学方法
采用SPSS 22.0 软件进行统计分析,P<0.05 认为有统计学意义。性别间差异采用卡方检验,组间菌群相对丰度的差异采用Mann-Whitney 检验,年龄间差异、OTU 数量及alpha 多样性指数差异采用两独立样本t检验。LEfSe 分析首先使用多组比较的秩和检验即Kruskal-WallisH检验检测不同分组间丰度差异显著的物种,有统计学意义时进行两两比较,最后用线性判别分析(LDA)来实现降维和评估差异显著物种的影响大小(LDA Score)。
2 结果
2.1 一般情况
本研究纳入了ESCC 患者50 例,健康对照者40 例。均为汉族,其中ESCC 组男性44 例,女性6 例,健康对照组男性23 例,女性17 例。ESCC 年龄为(60.46±7.99)岁,健康对照组年龄(44.05±13.49)岁,两组在年龄、性别组间比较均有统计学差异(P<0.05)。
2.2 OTU 构建及物种分析
通过对所有样品序列进行拼接,质控过滤掉低质量序列后,ESCC 组和健康对照组的唾液样本共获得8 028 349条序列,平均每个样本为89 204条。ESCC 组获得序列平均为93 289 条,健康对照组获得序列平均为84 098 条。以97%的一致性将序列聚类为OUT,获得平均OTU 分别为:ESCC 组633±264 和HC 组681±246。
我们对全部EffectiveTags 按照97%的序列相似性进行OTU 聚类,在phylum(门)和genus(属)水平统计分析各样本的群落组成。物种分析表明,经门水平物种分析发现,两组相对丰度≥1%的优势菌门的均为拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria),虽然两组的物种组成差异不大,但丰度比例却不相同。ESCC 组与HC 组相比,厚壁菌门及梭杆菌门丰度比例升高,而拟杆菌门及变形菌门比例明显降低(图1)。
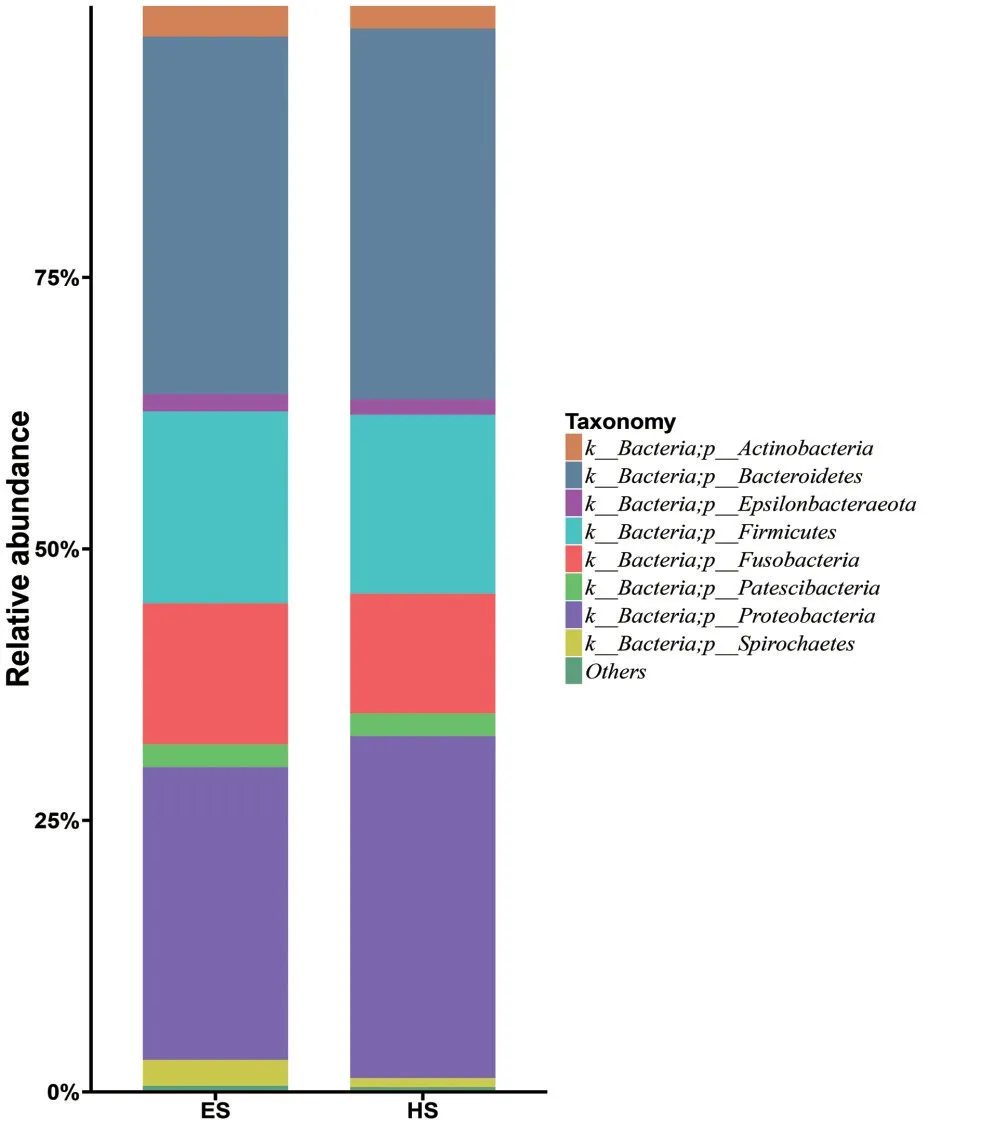
图1 ESCC 组和HC 组在门水平的相对丰度柱形图Fig.1 Bar charts of relative abundance of groups in phylum level between ESCC and HC
ESCC 组和HC 组相对丰度≥1%的优势菌属相对丰度柱形图见图2。在属水平,ESCC 组以奈瑟菌属(Neisseria)、梭杆菌属(Fusobacterium)、嗜血杆菌属(Haemophilus)、普式菌属(Prevotella)、卟啉单胞菌属(Porphyromonas)为主,健康对照组以奈瑟菌属(Neisseria)、嗜血杆菌属(Haemophilus)、普式菌属(Prevotella)、梭杆菌属(Fusobacterium)、韦荣氏球菌属(Veillonella)为主。
2.3 多样性分析
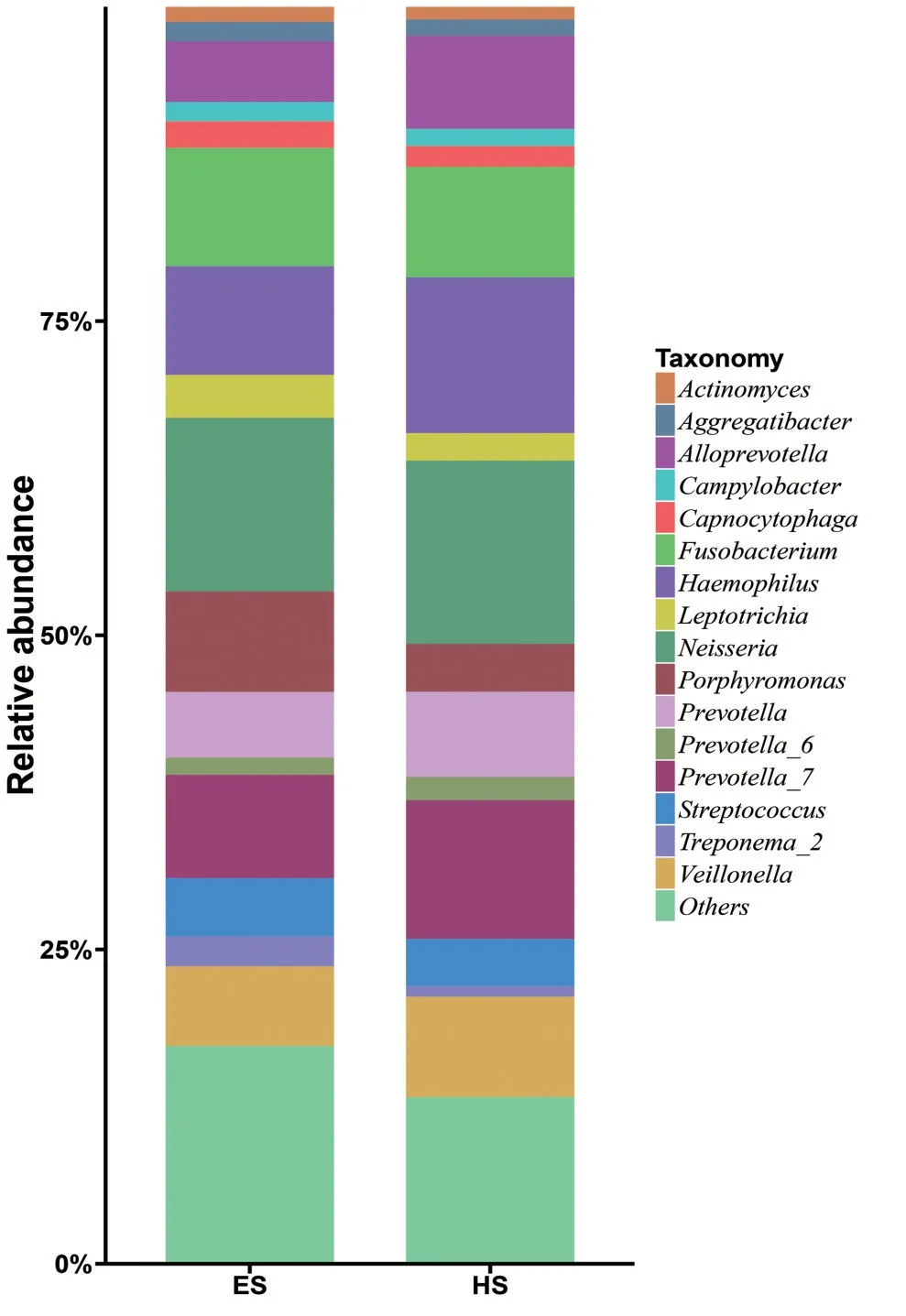
图2 ESCC 组和HC 组在属水平的相对丰度柱形图Fig.2 Bar charts of relative abundance of groups in genus level between ESCC and HC
Alpha 多样性(Alpha diversity)是对单个样品中物种多样性的分析,通常计算的参数包括Observed_species 指数(观测到的物种数)、Chao1指数、Shannon 指数、Simpson 指数以及PD whole tree 等。Chao1 和Observed_species 数值表示所测样品中群落的丰富度,其值越高,则物种丰度越高,经统计学分析两组物种丰度差异无统计学意义(P>0.05)。Shannon 指数、simpson 指数以及PD_whole_tree 值代表群落多样性程度,其值越高,则多样性越高,差异均无统计学意义(表1)。
Beta 多样性(Beta Diversity)即样品间的生物多样性的比较,是对不同样品间的微生物群落构成进行比较。统计所有OTU 在不同样品中的相对丰度,之后利用Bray-Curtis 距离公式计算不同样品间的间相异系数矩阵,对矩阵进行层级聚类及样本距离heatmap 图,颜色越红表明样本间距离越远,说明两组细菌群落构成存在差异(图3)。
2.4 LEfSe 分析
LEfSe 是一种用于发现高维生物标识和揭示基因组特征的软件分析,能够在组与组之间寻找具有统计学差异的物种。LEfSe 分析得出两组间有差异菌群共有25 种,其中普雷沃氏菌科、变形菌门、变形菌纲、嗜血杆菌属等12 种菌在HC 组中富集(P<0.05),另外包括卟啉单胞菌属、紫单胞菌科、滨珊瑚属、螺旋体属等在内的13 种菌在ESCC 组中显著增高(P<0.05;图4)。
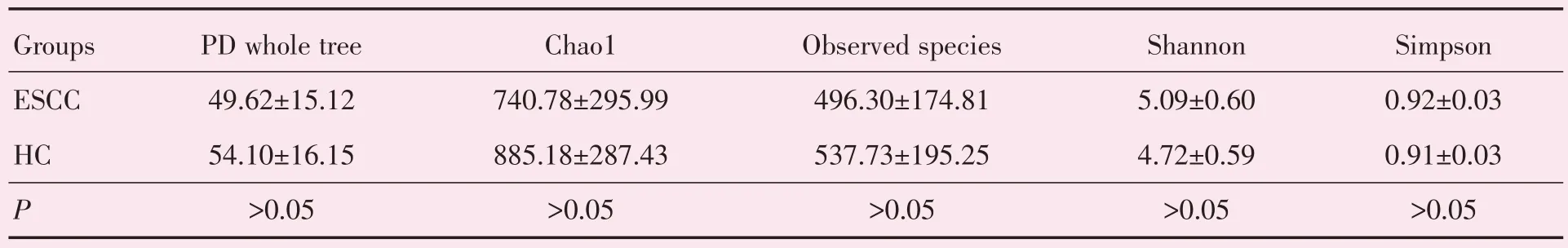
表1 ESCC 组和HC 组样本α多样性参数比较Table 1 Comparison of alpha diversity parameters between ESCC group and HC group
3 讨论
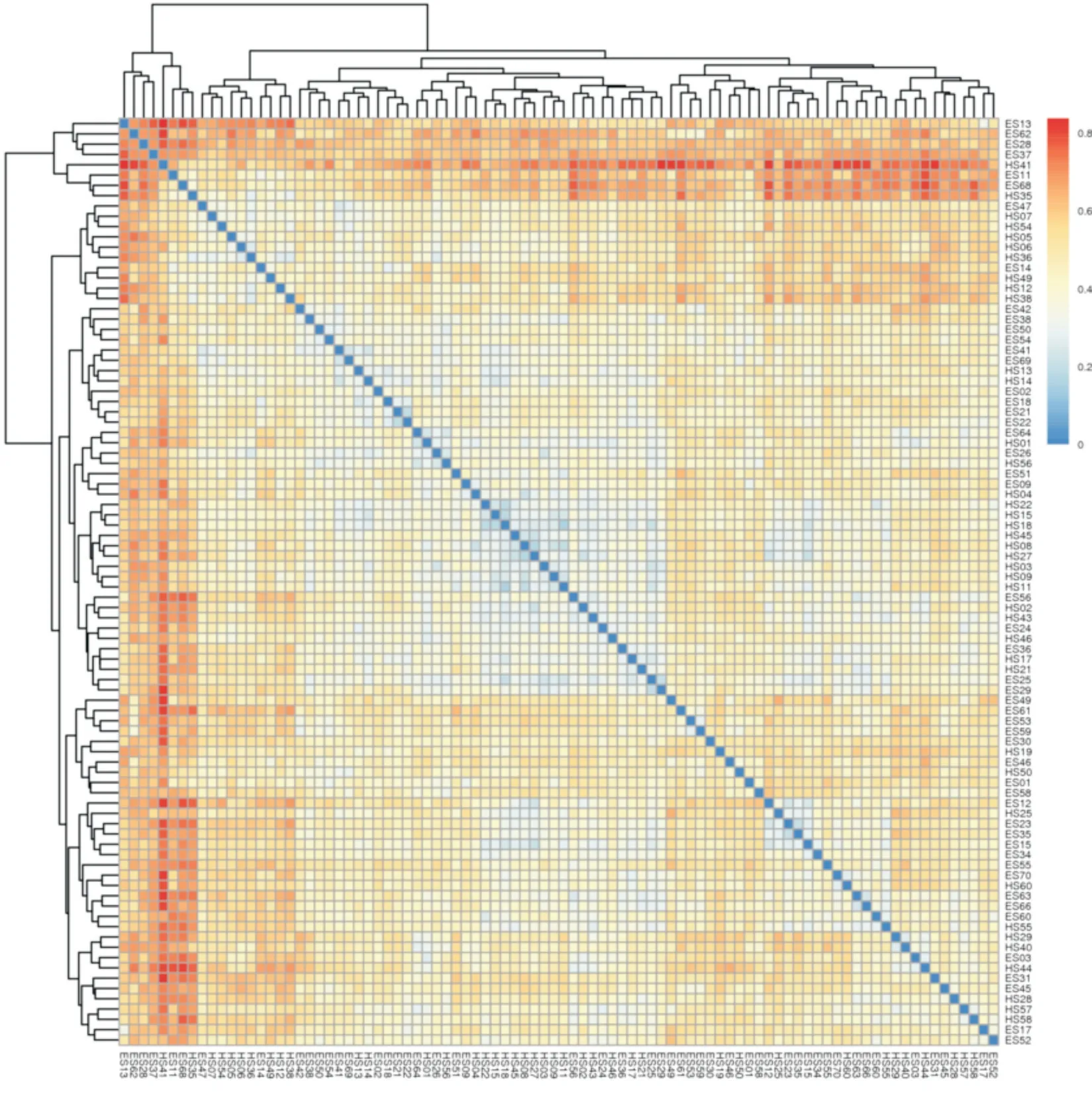
图3 样本距离heatmap 图Fig.3 The Heatmap between ECSS group and HC group
我国是世界上食管鳞癌高发国家,其中山西、广东(潮汕)、河北、江苏、四川、河南为6 个高发区[13]。早期食管癌根治术后预后良好,然而事实上食管癌病人就诊时多处于中晚期,相当多的病人已失去手术机会。因此提高食管癌早期诊断率和针对食管癌病因学的预防研究十分重要。目前,食管癌确切病因机制尚未清楚。而近年来有关微生态学即细菌在肿瘤发病中的作用已成为研究的热点。2013 年Kostic 等[14]利用肠肿瘤形成小鼠模型和人类结肠癌细胞,使用具核梭杆菌对肠肿瘤有遗传易感性的小鼠进行干预,发现比对照组形成了更多数量且更具侵袭性的肿瘤,证实具核梭杆菌诱导了促炎症反应和致癌活动,在具核梭杆菌与肿瘤微环境的相互作用上,鉴别出了能够诱导炎症和肿瘤发生的细菌特异细胞表面的FadA 元件,结合结直肠癌细胞的E-cadherin,激活了细胞内的β-catenin 信号,差异性调节了炎症和致癌反应,有利于结直肠癌的发展,促进结直肠癌生长。2012 年Farrell等[15]研究通过对胰腺癌患者和健康者的唾液微生物菌群比较,发现唾液菌群在胰腺癌中存在着显著变化,表明唾液细菌学改变具有对胰腺癌预测诊断价值,2009 年Yang等[16]人研究发现不同疾病状态下食管微生物菌群不同,以链球菌为主的正常食管和以革兰氏阴性厌氧菌为主的食管炎和Barrett(BE)食管,而关于食管癌特别是鳞癌的特征性靶细菌学发现及该靶细菌的致癌机制尚未见。而在口腔中,无数的细菌形成一个复杂且稳定的细菌群落,在口腔和全身疾病中起着重要作用[17-24]。口腔微生物随着唾液通过吞咽定植在消化道,由于食管细菌多来源于口腔,受唾液细菌影响较大,推测口腔细菌与食管癌发病也具有相关性。但有关唾液中细菌在食管癌预测中的价值及在食管癌发病中的作用和临床意义研究至今国内外未见报道。因此,我们使用16s rDNA 测序方法研究食管鳞癌患者唾液中的口腔微生物菌群,期望在食管鳞癌患者唾液中筛查出特异性表达的细菌,为食管鳞癌的早期筛查提供快速简单的方法。
在本研究中,α多样性参数比较发现ESCC组和HC 组的Chao1 值和Ace 值没有统计学差异,说明ESCC 患者唾液菌群的整体含量并未发生明显改变。Shannon 指数、simpson 指数以及PD_whole_tree 值差异无统计学意义,显示两组的菌群多样性方面差异较小。Beta 多样性样本距离heatmap 图提示两组细菌群落构成存在差异。物种分析表明与健康对照组相比,ESCC 组以奈瑟菌属(Neisseria)、梭杆菌属(Fusobacterium)、嗜血杆菌属(Haemophilus)、普式菌属(Prevotella)、卟啉单胞菌属(Porphyromonas)为主,而LEfSe 分析表明ESCC 组卟啉单胞菌属表达升高,且具有统计学差异(P>0.05)。
本研究发现ESCC 患者的唾液菌群结构与健康人不同,有其特征性的细菌组成,ESCC 组卟啉单胞菌属相对于同组其他菌属来讲表达明显升高,且具有统计学差异。而卟啉单胞菌属中牙龈卟啉单胞菌研究最热。牙龈卟啉单胞菌(Porphyromonasgingivalis)认为是牙周炎的致病菌[25-32]。既往多项研究表明牙龈卟啉单胞菌与食管癌的发生发展密切相关。Gao 等[3]研究证明食管鳞状细胞癌患者癌组织及癌旁正常组织发现牙龈卟啉单胞菌的感染,而健康对照组食管黏膜无感染;Peters 等[33]人使用16S rRNA 基因测序对两组漱口水样本进行研究,结果表明牙龈卟啉单胞菌丰富者易患食管鳞癌,而福赛斯坦纳菌与食管腺癌的高风险相关,且牙龈卟啉单胞菌与食管鳞癌淋巴结转移及短生存期有关。我们在进一步研究中已经发现部分食管癌组织内牙龈卟啉单胞菌也升高,数据还在完善整理中,有关牙龈卟啉单胞菌的致癌机制也是下一步深入研究的课题。总之发现食管鳞癌口腔内特异性的细菌,并研究它们的致癌机制,有可能为下一步食管鳞癌的预测诊断和预防发现到新的生物标志物。
