芹菜素影响非小细胞肺癌A549细胞顺铂敏感性的RAD51基因调控机制研究
2020-04-08莫琳刘馨杨慧敏何欣蓉王小林唐春红
莫琳 刘馨 杨慧敏 何欣蓉 王小林 唐春红


摘 要 目的:從RAD51基因途径研究芹菜素对非小细胞肺癌(NSCLC)A549细胞顺铂敏感性的影响及其机制。方法:取人肺癌顺铂耐药细胞A549/DDP,分为对照组(空白培养基)、顺铂组(5 g/L)和芹菜素低、高剂量组(10、20 μmol/L),采用MTT法检测A549/DDP细胞生长,采用Annexin Ⅴ/PI双染色法结合流式细胞术检测其凋亡情况。取A549/DDP细胞,分为顺铂单用组(1、2、4、8、16 μg/mL)和芹菜素联用组(10 μmol/L,在顺铂基础上加用),采用MTT法测定并计算细胞增殖抑制率;采用回归分析模型计算药物的半数抑制浓度(IC50),并以此计算芹菜素的逆转指数。将18只裸鼠随机分为对照组、顺铂单用组和芹菜素联用组,每组6只,接种A549/DDP细胞使形成移植瘤后,分别腹腔注射生理盐水、顺铂(2 mg/kg,隔天给药1次)、顺铂(剂量、用法同前)+芹菜素药液(30 mg/kg,每天给药1次),连续给药18 d,测量小鼠的体质量和移植瘤质量并计算抑瘤率。取人肺癌细胞A549和A549/DDP,分为正常组(A549细胞)、对照组(A549/DDP细胞)、顺铂组(5 g/L,A549/DDP细胞)和芹菜素低、高剂量组(10、20 μmol/L,A549/DDP细胞),分别采用实时荧光定量聚合酶链反应和Western blotting法检测细胞中RAD51的mRNA及其蛋白表达情况。结果:与对照组比较,芹菜素低、高剂量组细胞增长数均显著降低,凋亡率均显著升高且显著高于顺铂组(P<0.05或P<0.01)。联用芹菜素后,A549/DDP细胞的增殖抑制率均较相应质量浓度的顺铂单用组显著升高(P<0.05);芹菜素联用组的 IC50为(5.81±0.47)μg/mL,显著低于顺铂单用组的IC50(14.44±0.52)μg/mL(P<0.05);逆转指数为2.49。裸鼠抑瘤实验结果显示,联用芹菜素后,A549/DDP荷瘤裸鼠抑瘤率为68.72%,显著低于顺铂单用组的33.82%(P<0.05)。与正常组A549细胞比较,对照组A549/DDP 细胞中RAD51 mRNA及其蛋白的相对表达量均显著升高(P<0.05);与对照组A549/DDP 细胞比较,芹菜素低、高剂量组A549/DDP 细胞中RAD51 mRNA及其蛋白的相对表达量均显著降低(P<0.05);与顺铂组A549/DDP 细胞比较,芹菜素低、高剂量组A549/DDP 细胞中RAD51 mRNA及其蛋白的相对表达量均显著降低(P<0.05)。结论:芹菜素能够有效逆转人肺癌顺铂耐药细胞A549/DDP的耐药性,其机制可能与下调RAD51基因转录及其蛋白表达有关。
关键词 芹菜素;RAD51;非小细胞肺癌;顺铂;耐药;敏感性
ABSTRACT OBJECTIVE: To study the effects and mechanism of apigenin on cisplatin sensitivity of NSCLC A549 cells by regulating RAD51 gene. METHODS: Human lung cancer cisplatin-resistant cells A549/DDP were selected and divided into control group (blank culture medium), cisplatin group (5 g/L), apigenin low-dose and high-dose groups (10, 20 μmol/L). MTT assay was used to detect the growth of A549/DDP cells, while the Annexin Ⅴ/PI double staining combined with flow cytometry were used to detect the apoptosis. A549/DDP cells were collected and divided into cisplatin alone group (1, 2, 4, 8, 16 μg/mL), apigenin combination group (10 μmol/L, based on cisplatin). MTT method was used to determine and calculate inhibitory rate of cell proliferation. IC50 values of drugs were calculated by regression model, and reversion index of apigenin was calculated. 18 nude mice were randomly divided into control group, cisplatin alone group and apigenin combination group, with 6 mice in each group. After A549/DDP cells were inoculated to form the transplanted tumor, normal saline, cisplatin (2 mg/kg, once every other day), cisplatin (the same dosage and usage)+apigenin solution (30 mg/kg, once a day) were injected intraperitoneally respectively. After 18 days of continuous administration, the body weight of mice and the mass of the transplanted tumor were detected and the tumor inhibition rate was calculated. Human lung cancer cells A549 and A549/DDP were collected and divided into normal group (A549 cells), control group (A549/DDP cells), cisplatin group (5 g/L, A549/DDP cells) and apigenin low-dose and high-dose groups (10, 20 μmol/L, A549/DDP cells), respectively. mRNA and protein expression of RAD51 were detected by real-time fluorescence quantitative PCR and Western blotting assay. RESULTS: Compared with control group, the cell growth of apigenin low-dose and high-dose groups were decreased significantly, apoptosis rates of them were increased significantly and higher than those of cisplatin group (P<0.05 or P<0.01). After combined with apigenin, proliferation inhibition rate of A549/DDP cells was increased significantly, compared with cisplatin alone group with the same concentration (P<0.05). The IC50 in the apigenin combination group was(5.81±0.47)μg/mL, significantly lower than (14.44±0.52)μg/mL in cisplatin alone group (P<0.05), and reversal index of apigenin was 2.49. The results of nude mice tumor inhibition experiment showed that after combined with apigenin, tumor inhibition rate of A549/DDP bearing nude mice was 68.72%, significantly lower than 33.82% in cisplatin alone group. Compared with A549 cells of normal group, relative expression of RAD51 mRNA and protein were increased significantly in A549/DDP cells of control group (P<0.05). Compared with A549/DDP cells of control group, relative expression of RAD51 mRNA and protein in A549/DDP cells were decreased significantly in apigenin low-dose and high-dose groups (P<0.05). Compared with cisplatin group, relative expression of RAD51 mRNA and protein in A549/DDP cells of apigenin low-dose and high-dose group were decreased significantly (P<0.05). CONCLUSIONS: Apigenin can effectively reverse drug resistance of cisplatin-resistant A549/DDP cells in human lung cancer. The mechanism may be related to the reduction of RAD51 gene transcription and protein expression.
KEYWORDS Apigenin; RAD51; Non-small cell lung cancer; Cisplatin; Drug resistance; Sensitivity
目前,化疗是非小细胞肺癌(NSCLC)的主要治疗手段之一,其标准化疗方案是以铂类为基础的联合化疗,但NSCLC患者在治疗过程中经常会出现对顺铂耐受的现象,这对化疗效果造成了严重影响,导致患者生存率低、预后不良[1]。由于NSCLC细胞对顺铂耐药的机制十分复杂,涉及多个基因和多条通路,因此阐明顺铂耐药机制及寻找逆转顺铂耐药的有效途径已成为临床研究关注的重点。随着分子生物学研究的不断深入和“精准医学”概念的提出,越来越多的研究者开始从基因层面去探讨疾病的发生进展以及潜在的诊疗措施[2]。RAD51是一种新发现的蛋白基因,与细胞的生长密切相关,在细胞的增殖、分化、DNA修复和周期转换中发挥了重要的作用[3]。相关研究报道,在多种肿瘤(如肺癌、食管癌、乳腺癌等)组织中,RAD51蛋白呈异常高表达,提示其异常表达与肿瘤的分化、侵袭和转移密切相关[4]。芹菜素(Apigenin)是一种生物类黄酮化合物,广泛存在于自然界的绿色植物中,能够促进癌细胞凋亡、抑制癌细胞增殖和周期转换,具有较好的抗肿瘤作用,其在乳腺癌细胞中改善顺铂耐药的作用也已经得到证实[5]。基于此,本研究针对芹菜素调控RAD51基因表达途径考察了其对人肺癌A549细胞顺铂敏感性的影响及机制,以期为芹菜素用于NSCLC等癌症的治疗提供实验基础。
1 材料
1.1 仪器
JY2000型精密電子天平(上海精密科学仪器有限公司);680型酶标仪(美国Bio-Rad公司);HERAcell BB15型CO2细胞培养箱(德国Heraeus公司);EPS300型电泳仪(上海天能科技有限公司);UnioⅡ型聚合酶链式反应(PCR)仪(德国Biometra公司);FACSCaliber型流式细胞仪(美国BD公司);GDS8000型凝胶成像仪(英国UVP公司);5804R型台式离心机(德国Eppendorf公司)。
1.2 药品与试剂
顺铂原料药(山东齐鲁制药有限公司,批号:H20183460,纯度:99.8%);芹菜素原料药(美国Sigma公司,批号:180623,纯度:≥98%);胎牛血清、RPMI 1640培养基(上海明丰生物科技有限公司);胰蛋白酶消化液、细胞裂解液(美国R&D Systems公司);RAD51质粒中量抽提试剂盒、RAD51兔单克隆抗体、GAPDH兔单克隆抗体(美国Santa Cruz公司);辣根过氧化物酶标记羊抗兔IgG二抗(英国Abcam公司);青霉素-链霉素双抗、二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)试剂(美国Sigma公司);Annexin Ⅴ-FITC/PI凋亡检测试剂盒、RNA提取Trizol试剂盒、TaqMan miRNA 反转录试剂盒、SYBR Prellix Ex TaqTM实时PCR试剂盒(日本TaKaRa公司);PCR引物(美国Genewiz公司中国总部);TBST缓冲液(北京索莱宝科技有限公司);PVDF膜(美国Bio-Rad公司);ECL试剂盒、BCA蛋白定量试剂盒、台盼蓝试剂盒(上海碧云天生物技术有限公司);0.9%氯化钠注射液(天津百特医疗用品有限公司,作生理盐水使用);pH 7.4磷酸盐缓冲液(PBS)为本实验室自制;其余试剂均为分析纯或实验室常用规格;水为超纯水。
1.3 细胞
人肺癌细胞A549、顺铂耐药细胞A549/DDP均购自中国科学院上海细胞库。
1.4 动物
BALB/c Nude 裸鼠,SPF级,雄性,8~10周龄,体质量20~25 g,购于上海西普尔-必凯实验动物有限公司,生产许可证号:SCXK(沪)2018-0006。裸鼠在SPF级实验动物中心通风饲养,室内温度(21±2)℃,相对湿度40%~50%,空气更换频率15次/h,12 h光照明暗交替,实验场所及相关器材均严格清洗、消毒。裸鼠均适应饲养1周后进行实验,期间统一标准喂食、饮水。
2 方法
2.1 细胞培养
将A549细胞和A549/DDP细胞常规培养于含10%胎牛血清的RPM1640培养基中,于37 ℃、5%CO2条件下培养,然后以胰蛋白酶(1 g/L)消化传代,每3天传代1次。其中,A549/DDP细胞培养液中添加顺铂(2 μg/mL)以稳定耐药细胞株的耐药表型。取对数生长期细胞,以0.1%DMSO的RPMI 1640培养基稀释(下同),制成相应浓度的单细胞悬液并计数后用于后续试验。试验前以台盼蓝染色法测定,细胞存活率均在95%上。
2.2 芹菜素对A549/DDP细胞增殖的影响考察
取“2.1”项下对数生长期A549/DDP细胞,调整细胞浓度为5×104个/mL,按每孔100 μL加至96孔板中,随机分为对照组、顺铂组和芹菜素低、高剂量组。对照组仅加入A549/DDP细胞;顺铂组加入顺铂(终质量浓度为5 μg/mL,剂量参考临床用药量对应的血药浓度设置)+A549/DDP细胞;芹菜素低、高剂量组同法加入不同剂量芹菜素(终浓度为10、20 μmol/L,剂量参考文献[6]设置)+A549/DDP细胞。顺铂原料药以无菌生理盐水制成10 g/L的母液,芹菜素原料药以DMSO溶液制成10 mmol/L的母液,试验时均以RPMI 1640培养基稀释至相应浓度。
采用MTT法检测细胞的增殖能力。各组细胞在37 ℃、5%CO2条件下分别培养24、48、72 h后,每孔加入MTT试剂20 μL继续培养4 h。使用酶标仪在495 nm波长处测定各孔细胞光密度(OD)值,OD值越大则表示细胞增长数越多。试验均重复3次。
2.3 芹菜素对A549/DDP细胞凋亡的影响考察
采用Annexin Ⅴ/PI双染色法结合流式细胞术检测细胞凋亡情况。取对数生长期A549/DDP细胞,按“2.2”项下方法按每孔1×106个加至96孔板中,随机分为对照组、顺铂组和芹菜素低、高剂量组,并同法给药。各组细胞在37 ℃、5%CO2条件下培养48 h后,以RPMI 1640培养基制成1×106个/mL的单细胞悬液,以800 r/min离心5 min,PBS洗涤,加入Annexin Ⅴ-FITC试液5 μL、PI试液10 μL混匀后染色30 min。采用流式细胞仪检测细胞凋亡数并计算凋亡率:细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。试验均重复3次。
2.4 芹菜素联用对A549/DDP细胞顺铂敏感性的影响考察
依据“2.2”项下芹菜素对A549/DDP细胞增殖的影响考察结果,采用MTT法考察芹菜素联用对A549/DDP细胞顺铂敏感性的影响。取对数生长期A549/DDP细胞,按“2.2”项下方法接种至96孔板中,分别加入不同质量浓度的顺铂(1、2、4、8、16 μg/mL,剂量参照文献[6]设置)作为顺铂单用组;另设芹菜素联用组,即在加入上述质量浓度顺铂的基础上同时加入芹菜素(10 μmol/L)。各组细胞在37 ℃、5%CO2条件下培养24 h后,加MTT 试剂20 μL 继续培养4 h。采用酶标仪在495 nm波长处测定各孔细胞OD值并计算细胞增殖抑制率:增殖抑制率(%)=(1-芹菜素联用组OD平均值/相应质量浓度顺铂单用组OD平均值)×100%。采用回归分析模型计算药物的半数抑制浓度(IC50)。以IC50值计算芹菜素的逆转指数:逆转指数=顺铂单用组IC50值/相应质量浓度芹菜素联用组IC50值。试验均重复3次。
2.5 芹菜素联用对顺铂作用后A549/DDP荷瘤裸鼠抑瘤情况的影响考察
将18只裸鼠随机分为对照组、顺铂单用组和芹菜素联用组,每组6只。将含有A549/DDP细胞(1×106个)的PBS溶液200 μL皮下注射至裸鼠腋下区域,1~2周后可见肿瘤组织块生长。每2天用卡尺测量移植瘤长径(A,mm)和短径(B,mm),计算移植瘤体积(V,mm3):V=A×B2×π/6。当移植瘤生长至20~25 mm3时,对照组裸鼠注射等量生理盐水,顺铂单用组裸鼠腹腔注射顺铂药液(2 mg/kg,隔天给药1次,剂量参照文献[7]设置),芹菜素联用组裸鼠在顺铂给药的基础上腹腔注射芹菜素药液(30 mg/kg,每天给药1次,剂量参照前期实验结果设置),均连续给药18 d。顺铂、芹菜素药液均以生理鹽水制成所需浓度,无菌滤器过滤,当天使用。给药期间每天测量并计算移植瘤体积,记录裸鼠的体质量变化。给药结束后,处死裸鼠并剥离移植瘤组织块,称定瘤组织质量并计算抑瘤率:抑瘤率=(对照组移植瘤组织质量-给药组移植瘤组织质量)/对照组移植瘤组织质量×100%。
2.6 不同细胞中RAD51 mRNA表达及芹菜素对其影响考察
取“2.1”项下对数生长期细胞,按“2.2”项下方法以1×106个/孔加入96孔板,随机分为正常组、对照组、顺铂组和芹菜素低、高剂量组。正常组加入A549细胞(以含0.1%DMSO的RPMI 1640培养基稀释,下同);对照组、顺铂组和芹菜素低、高剂量组加入 A549/DDP细胞和相应药物。各组细胞在37 ℃、5%CO2条件下培养24 h后,采用Trizol试剂盒提取细胞总RNA,再采用逆转录试剂盒对其进行逆转录获得cDNA(逆转录反应条件:42 ℃,反应30 min;逆转录酶失活条件:85 ℃,反应15 s)。按照实时PCR试剂盒说明书要求操作,进行逆转录定量PCR检测(引物序列见表1)。PCR扩增反应条件:95 ℃预变性5 min;95 ℃变性20 s,60 ℃退火30 s,40个循环;75 ℃延伸10 min。取PCR产物5 μL,加载样缓冲液1 μL,在20 g/L琼脂糖凝胶上电泳,溴化乙啶染色后,采用凝胶成像仪分析。以GAPDH为内参,采用Image J 1.48软件分析目标基因的蛋白表达产物的相对灰度值,用来表示其mRNA的相对表达量。试验均重复3次。
2.7 不同细胞中RAD51蛋白的表达及芹菜素对其影响考察
采用Western blotting法检测细胞中RAD51蛋白表达水平。按“2.6”项下方法将A549细胞和A549/DDP细胞进行分组、给药,在37 ℃、5%CO2条件下培养24 h。取细胞进行蛋白裂解,并采用BCA法检测蛋白质浓度。使用10%十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,以PVDF膜进行转膜;室温下以5%脱脂牛奶封闭2 h,TBST缓冲液漂洗3次;先后加入RAD51抗体、GAPDH抗体(稀释度均为1 ∶ 500)于4 ℃孵育12 h,再加入二抗(稀释度1 ∶ 5 000)于室温下孵育60 min,然后采用ECL试剂进行化学发光检测。以 GAPDH 作为内参,采用凝胶成像仪分析,并以Quantity One 4.6.6图像处理软件分析目标蛋白条带的相对灰度值,用来表示其相对表达量。试验均重复3次。
2.8 统计学方法
使用SPSS 20.0软件对实验数据进行统计分析。实验数据均以x±s表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,同一指标不同时间点的比较采用重复测量方差分析。P<0.05为差异有统计学意义。
3 结果
3.1 芹菜素对A549/DDP细胞增殖的影响
与对照组比较,在药物作用48、72 h后,各给药组细胞增长数均显著降低(P<0.05),而在作用24 h时各组间细胞增长数差异均无统计学意义(P > 0.05),详见表2。为排除芹菜素本身可能存在的细胞毒性作用而造成对增敏试验结果的干扰,故选择以10 μmol/L芹菜素作用24 h来考察其对A549/DDP细胞顺铂敏感性的影响。
3.2 芹菜素对A549/DDP细胞凋亡的影响
与对照组比较,各给药组A549/DDP细胞凋亡率均显著升高(P<0.05或P<0.01);与顺铂组比较,芹菜素低、高剂量组A549/DDP细胞凋亡率显著升高(P<0.01)。各组细胞凋亡流式细胞图见图1,凋亡率检测结果见表3。
3.3 芹菜素联用对A549/DDP细胞顺铂敏感性的影响
随着顺铂质量浓度增加,顺铂单用组A549/DDP细胞的增殖抑制率逐渐升高;在联用10 μmol/L芹菜素后,A549/DDP细胞的增殖抑制率(除顺铂质量濃度为1 μg/mL时)较相应质量浓度的顺铂单用组显著升高(P<0.05),详见表4。芹菜素联用组的 IC50为(5.81±0.47)μg/mL,较顺铂单用组的IC50(14.44±0.52)μg/mL显著降低(P<0.05);芹菜素的逆转指数为2.49。
3.4 芹菜素联用对顺铂作用后A549/DDP荷瘤裸鼠抑瘤情况的影响
建模结束后,与对照组比较,各给药组裸鼠体质量和移植瘤体积差异均无统计学意义(P>0.05);给药结束后,与对照组比较,各给药组裸鼠体质量、移植瘤体积和瘤组织质量均显著降低,且芹菜素联用组显著低于顺铂单用组(P<0.05);芹菜素联用组的抑瘤率为68.72%,显著高于顺铂单用组的33.82%(P<0.05),详见表5。
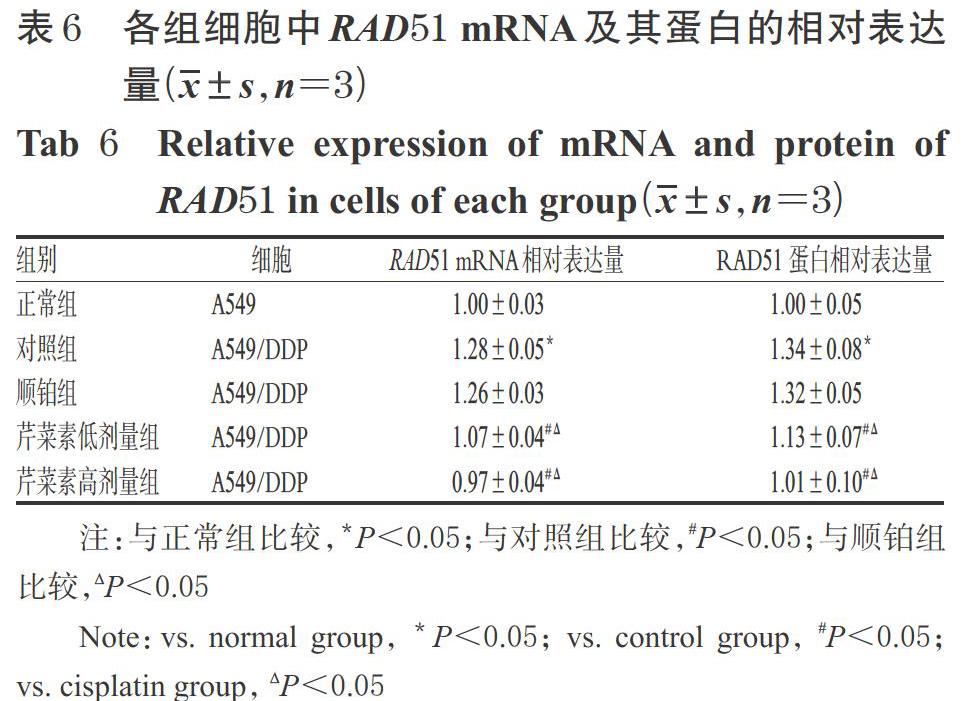
3.5 不同细胞中RAD51 mRNA表达差异及芹菜素对其表达的影响
与正常组A549细胞比较,对照组A549/DDP 细胞中RAD51 mRNA的相对表达量显著升高(P<0.05);与对照组A549/DDP 细胞比较,芹菜素低、高剂量组A549/DDP 细胞中RAD51 mRNA的相对表达量均显著降低(P<0.05);与顺铂组A549/DDP 细胞比较,芹菜素低、高剂量组A549/DDP 细胞中RAD51 mRNA的相对表达量均显著降低(P<0.05)。各组细胞中RAD51 mRNA的相对表达量见表6。
3.6 不同细胞中RAD51蛋白表达差异及芹菜素对其表达的影响
与正常组A549细胞比较,对照组A549/DDP细胞中RAD51蛋白的相对表达量均显著升高(P<0.05);与对照组A549/DDP 细胞比较,芹菜素低、高剂量组A549/DDP 细胞中RAD51蛋白的相对表达量均显著降低(P<0.05);与顺铂组A549/DDP 细胞比较,芹菜素低、高剂量组A549/DDP 细胞中RAD51蛋白的相对表达量均显著降低(P<0.05)。各组细胞中RAD51蛋白的相对表达量见表6。
4 讨论
铂类药物迄今为止仍是临床治疗肺癌应用最广泛的一线化疗药物[1]。但随着治疗时间的推移,铂类药物的耐药问题日益严重,造成患者化疗失败、肿瘤复发。因此,如何减少甚至逆转肿瘤细胞对于铂类药物的耐药性是改善患者预后、提高患者生存率的关键。据既往文献报道,钙通道拮抗剂等能够逆转肿瘤细胞耐药性,但往往由于中毒剂量与逆转耐药性剂量太过接近,限制了其临床应用[8-9]。
芹菜素是一种生物类黄酮化合物,随着对芹菜素应用于抗癌领域的研究不断深入,有学者研究发现,芹菜素对肿瘤细胞具有高度选择性,能够高选择性地诱导肿瘤细胞凋亡,而不损伤正常细胞[5];且芹菜素摄入体内后对多种类型的肿瘤均能产生预防作用[10]。陈况况等[11]指出,芹菜素能促进肿瘤细胞凋亡、抑制肿瘤细胞的增殖、侵袭和转移,同时能够干扰肿瘤细胞的多种信号传导途径等,对肝癌、肺癌、食管癌、乳腺癌、肺癌、肝癌等多种肿瘤细胞具有一定的抑制作用。赵亚新等[12]通过体外实验研究证实,芹菜素能够通过抑制MDR1基因转录和P糖蛋白介导的药物外转运功能进而逆转人乳腺癌阿霉素耐药细胞MCF-7/ADR的多药耐药性。但芹菜素在NSCLC治疗中能否同样逆转肿瘤细胞的耐药性及其具体机制仍无确切定论。近年来,临床上已有研究证实了RAD51基因与NSCLC的顺铂耐药性存在密切关联[13]。有研究指出,抑制范可尼贫血(FA)通路DNA的交联损伤修复功能,能够改善肺癌细胞耐药、增强顺铂的细胞毒性及其介导的促细胞凋亡作用,而RAD51是FA通路中重要的下游基因,敲除RAD51 C等位基因后可增加人肺癌细胞Calu-1对顺铂的敏感性[14]。因此,本研究基于芹菜素对RAD51基因表达的调控途径,以人肺癌细胞A549及其顺铂耐药细胞A549/DDP为对象,通过体内外研究探讨芹菜素对NSCLC肿瘤细胞化疗药物敏感性的影响及其机制。
本研究结果显示,与对照组比较,在药物作用48、72 h后,顺铂组和芹菜素低、高剂量组A549/DDP细胞增长数均显著降低,而作用24 h时各组间细胞增长数比较,差异均无统计学意义,这表明芹菜素对A549/DDP细胞增殖有显著抑制作用,且这一作用有随芹菜素浓度升高和作用时间延长而增强的趋势。细胞凋亡试验结果显示,与顺铂比较,10、20 μmol/L芹菜素作用后能够更显著地促进A549/DDP细胞的凋亡。在此基础上,为排除芹菜素的细胞毒作用的影响,本研究选用10 μmol/L芹菜素联合处理24 h,考察A549/DDP细胞对顺铂的敏感性变化,结果芹菜素联用组的IC50值较相应质量浓度的顺铂单用组显著降低,表明联用芹菜素能使A549/DDP细胞对顺铂的敏感性显著升高;芹菜素具有逆转肿瘤细胞耐药的作用,其逆转指数高达2.49。裸鼠抑瘤实验结果也显示,芹菜素联用组裸鼠的移植瘤组织质量显著低于顺铂单用组,其抑瘤率达到68.72%,显著高于顺铂单用组的33.82%,表明芹菜素能提高顺铂对A549/DDP荷瘤裸鼠的抑瘤作用。体内外试验均提示芹菜素可逆转A549/DDP 细胞的耐药性,增加肿瘤细胞/组织对顺铂的敏感性。
肿瘤细胞耐药涉及多种因素,而铂类药物破坏肿瘤细胞DNA双链结构后的DNA结构损伤修复是造成耐药的重要原因,其中同源重组是DNA双链断裂修复的重要机制之一[15]。而耐药相关基因表达和调控的异常以及遗传机制、表观遗传机制调控的异常等与肿瘤化疗耐药密切相关。RAD51基因可以经由同源重组来修复双链断裂的生物遗传物质DNA[16]。研究证实,RAD51蛋白是DNA双链同源重组修复通路中的重要蛋白,其在肺癌、宫颈癌、胰腺癌和膀胱癌等多种肿瘤组织中均呈异常高表达,且与这些肿瘤的病理分期、分化程度、转移及预后密切相关,是造成肿瘤细胞对铂类药物化疗和放疗耐药的重要因素[17-18]。许多药物可以通过下调或抑制RAD51的表达达到化疗或是放疗增敏的作用,例如奥拉帕尼可以通过间接抑制RAD51介导的双链断裂修复增加对结肠癌细胞的细胞毒性[19],大黄素能够通过26S蛋白酶体降解作用促进吉非替尼诱导RAD51蛋白的不稳定性来增加吉非替尼对肺癌细胞的杀伤作用[20]。本研究检测了A549细胞和A549/DDP细胞中RAD51 mRNA及其蛋白的表达水平以及芹菜素干预的影响,结果显示,对照组A549/DDP细胞中RAD51 mRNA及其蛋白的表达水平明显高于正常组A549细胞,提示RAD51与NSCLC的化疗药耐药存在关联;而采用芹菜素处理后,A549/DDP细胞中RAD51 mRNA及其蛋白表达水平较顺铂组均显著降低,表明芹菜素可下调RAD51基因的转录和蛋白表达。这提示,芹菜素可能通过下调RAD51 mRNA及其蛋白表达,引起FA通路功能障碍,从而抑制NSCLC肿瘤细胞的DNA修复,逆转耐药肿瘤细胞对铂类药物的耐药性,进而诱导肿瘤细胞凋亡并抑制其增殖,有望开发为新型的抗肿瘤药物和化疗增敏剂。
综上所述,芹菜素能够有效逆转人肺癌顺铂耐药细胞A549/DDP的耐药性,其机制可能与下调RAD51基因转录及其蛋白表达有关。
参考文献
[ 1 ] CAO L,CHEN J,OU B,et al. GAS5 knockdown reduces the chemo-sensitivity of non-small cell lung cancer(NSCLC)cell to cisplatin(DDP)through regulating miR-21/PTEN axis[J]. Biomed Pharmacother,2017. DOI:10.1016/j.biopha.2017.06.089.
[ 2 ] CHENG R,LU C,ZHANG G,et al. Overexpression of miR- 203 increases the sensitivity of NSCLC A549/H460 cell lines to cisplatin by targeting Dickkopf-1[J]. Oncol Rep,2017,37(4):2129-2136.
[ 3 ] WU Z,JING S,LI Y,et al. The effects of SAHA on radiosensitivity in pancreatic cancer cells by inducing apoptosis and targeting RAD51[J]. Biomed Pharmacother,2017.DOI:10.1016/j.biopha.2017.02.067.
[ 4 ] CHEN Q,CAI D,LI M,et al. The homologous recombination protein RAD51 is a promising therapeutic target for cervical carcinoma[J]. Oncol Rep,2017,38(2):767-774.
[ 5 ] ERDOGAN S,TURKEKUL K,SERTTAS R,et al. The natural flavonoid apigenin sensitizes human CD44+ prostate cancer stem cells to cisplatin therapy[J]. Biomed Pharmacother,2017. DOI:10.1016/j.biopha.2017.01.056.
[ 6 ] 赵亚新,刘洁凡,钱海鑫.芹菜素逆转肺癌A549/DDP细胞耐药及机制[J].南京医科大学学报(自然科学版),2017,37(11):15-18、24.
[ 7 ] 王绩英,曾锦荣,王昌明,等.非诺贝特对人肺癌裸鼠移植瘤生长及PPARα、Bcl-2、NF-кB表达的影响[J].中国老年学杂志,2013,33(20):5035-5037.
[ 8 ] 孙伟红,刘淑娟,唐淑美,等.瑞香狼毒提取液逆转EGFR-TKI耐药肺腺癌H1975细胞的作用及其机制[J].中国肿瘤生物治疗杂志,2017,24(10):1070-1075.
[ 9 ] 王文雪,牟艳玲,姚庆强.葫芦素类化合物的抑瘤作用及其作用机制和联合用药研究进展[J].中国药房,2017,28(19):2712-2717.
[10] SHUKLA S,GUPTA S. Apigenin:a promising molecule for cancer prevention[J]. Pharm Res,2010,27(6):962- 978.
[11] 陈况况,章宏慧,陈健初.芹菜素对癌细胞作用机理的研究进展[J].食品工业科技,2013,34(3):392-395.
[12] 赵亚新,刘洁凡,江明华,等.芹菜素抗乳腺癌多药耐药MCF-7/ADR细胞作用的研究[J].中國癌症杂志,2017,27(8):648-654.
[13] 何林,毕娟娟,郭倩,等.大黄素下调ERCC1和RAD51对非小细胞肺癌增殖的影响及分子机制[J].第三军医大学学报,2011,33(22):2370-2375.
[14] AMEZIANE N,MAY P,HAITJEMA A,et al. A novel Fanconi anaemia subtype associated with a dominant-negative mutation in RAD51[J]. Nat Commun,2015. DOI:10.1038/ncomms9829.
[15] WANG D,DU R,LIU S. RAD51 inhibition sensitizes breast cancer stem cells to PARP inhibitor in triple-negative breast cancer[J]. Chin J Cancer,2017. DOI:10.1186/s40880-017-0204-9.
[16] PARVIN S,ISLAM MS,AL-MAMUN MM,et al. Association of BRCA1,BRCA2,RAD51,and HER2 gene polymorphisms with the breast cancer risk in the Bangladeshi population[J]. Breast Cancer,2017,24(2):229-237.
[17] LIAO SG,LIU L,WANG YJ. Effect of RAD51C expression on the chemosensitivity of Eμ-Mycp19Arf-/- cells and its clinical significance in breast cancer[J]. Oncol Lett,2018,15(5):6107-6114.
[18] 姜桔红,刘静,李智,等.肿瘤BRCA1亚细胞定位对细胞放射线及PARP抑制剂敏感性的影响[J].临床与实验病理学杂志,2017,33(3):253-257.
[19] TAHARA M,INOUE T,SATO F,et al. The use of Olaparib(AZD2281) potentiates SN-38 cytotoxicity in colon cancer cells by indirect inhibition of RAD51-mediated repair of DNA double-strand breaks[J]. Mole Cancer Ther,2014,13(5):1170-1180.
[20] KO JC,SU YJ,LIN ST,et al. Suppression of ERCC1 and RAD51 expression through ERK1/2 inactivation is essential in emodin-mediated cytotoxicity in human non-small cell lung cancer cells.[J]. Biochem Pharmacol,2010,79(4):655-664.
(收稿日期:2019-06-30 修回日期:2020-02-13)
(编辑:段思怡)
