9种通络祛风中药提取物对黄嘌呤氧化酶的体外抑制活性研究
2020-04-08李芮马良会王栋张春雷周孟廖尚高
李芮 马良会 王栋 张春雷 周孟 廖尚高

摘 要 目的:研究9種通络祛风中药的提取物对黄嘌呤氧化酶(XO)的体外抑制活性,以筛选活性突出的中药提取物。方法:以黄嘌呤为底物、XO为反应酶,以别嘌醇为阳性对照,以三角风、石胡椒、山莓、金雀花根、紫藤根、牛迭肚根、梓木皮、凌霄花根、爬岩香等药材的水提物和甲醇提取物(以下简称“醇提物”)以及活性提取物的石油醚、二氯甲烷、乙酸乙酯、正丁醇、水等萃取部位为对象,采用紫外分光光度法检测各样品对XO的抑制率,采用Graphpad prism 6.0软件计算半数抑制浓度(IC50)以筛选活性提取物/部位;采用双倒数法判断药材的酶抑制作用的类型。结果:9种中药共18个提取物中,500 μg/mL各中药提取物(除石胡椒醇提物外),250 μg/mL三角风、石胡椒、山莓、爬岩香的水提物和醇提物,250 μg/mL梓木皮水提物,250 μg/mL金雀花根、牛迭肚根、凌霄花根醇提物,125 μg/mL金雀花根、牛迭肚根醇提物以及62.5 μg/mL金雀花根醇提物对XO的抑制率均超过了50%;其中,金雀花根醇提物的IC50值为43.43 μg/mL,低于其他药材的提取物,为活性提取物。金雀花根醇提物石油醚、二氯甲烷、乙酸乙酯、正丁醇、水等萃取部位的IC50值分别为>200、193.35、7.67、14.80、>200 μg/mL,其中乙酸乙酯提取部位的IC50值与阳性对照(5.11 μg/mL)接近。金雀花根醇提物对XO的抑制类型为竞争-非竞争性抑制,不同于阳性对照的竞争性抑制。结论:金雀花根、牛迭肚根、石胡椒、山莓、爬岩香、三角风等醇提物及三角风、石胡椒、梓木皮等水提物对XO均具有一定的体外抑制活性,以金雀花根醇提物最强,且该提取物的乙酸乙酯萃取部位的抑制活性与别嘌醇相当,但抑制类型有所差异。
关键词 黄嘌呤氧化酶抑制活性;痛风;中药;提取物;金雀花根;体外
ABSTRACT OBJECTIVE: To study in vitro inhibitory activities of 9 kinds of TCM for dredging collaterals and dispelling wind on xanthine oxidase (XO), and to screen TCM with outstanding activity. METHODS: Using xanthine as substrate and xanthinase as reaction enzyme, allopurinol as positive control, with water extract and methanol extract (hereinafter referred to as “ethanol extract”) from the stem and leaves of Hedera nepalensis, the whole plant of Piper wallichii, the fruits of Rubus corchorifolius, the root of Caragana sinica, the root of Wisteria sinensis, the root of Rubus crataegifolius, the bark of Catalpa ovata, the root of Campsis grandiflora, the stem of P. hancei (hereinafter referred to by plant name) and petroleum ether, dichloromethane, ethyl acetate, n-butanol and water fraction of active extract as the objects, inhibition rate of each sample to XO was detected by spectrophotometry; IC50 values were calculated with Graphpad prism 6.0 software to screen active extract/fraction. Double reciprocal method was used to determine the type of enzyme inhibition. RESULTS: Among 9 kinds of TCM and 18 kinds of the extracts, the inhibitory rates to XO of 500 μg/mL extracts from each TCM (except for ethanol extract of P. wallichii), 250 μg/mL water extract and ethanol extract of H. nepalensis, P. wallichii, R. corchorifolius and P. hancei, 250 μg/mL water extract of C. ovata,250 μg/mL ethanol extract of C. sinica,R. crataegifolius and C. grandiflora,125 μg/mL ethanol extract of C. sinica and R. crataegifolius, 62.5 μg/mL ethanol extract of C. sinica were more than 50%. The IC50 value of the ethanol extract from C. sinica was 43.43 μg/mL, which was lower than the extracts of other TCM, and which was the active extract. The IC50 values of petroleum ether, dichloromethane, ethyl acetate, n-butanol and water fraction of ethanol extract from C. sinica were >200, 193.35, 7.67, 14.80 and >200 μg/mL, respectively. The IC50 value of ethyl acetate extract was close to that of positive control (5.11 μg/mL). Inhibitory type of ethanol extract from C. sinica to XO was competitive-noncompetitive inhibition, which was different from competitive inhibition of positive control. CONCLUSIONS: The ethanol extracts of C. sinica, R. crataegifolius,P. wallichii,R. corchorifolius,P. hancei,H. nepalensis and the water extracts of H. nepalensis, P. wallichii, C. ovata show certain inhibitory activity in vitro to XO, especially ethanol extract of C. sinica. The ethyl acetate fraction of the ethanol extract of C. sinica has similar inhibitory activity to allopurinol but their inhibition types are different.
2.3.2 酶溶液 称取XO适量,用水1 mL溶解,得浓度为100 U/mL的XO贮备液;将上述贮备液以每管50 μL分装至10 mL EPP管中,于-80 ℃冰箱中保存。取上述贮备液适量,用PBS稀释,制得浓度为0.2 U/mL的XO溶液。溶液配制完毕后,立即置于0 ℃冰箱中保存。
2.3.3 对照溶液 精密称取别嘌醇适量,用DMSO溶解,加PBS适量稀释,制得质量浓度为500 μg/mL的别嘌醇母液,待用。采用二倍稀释法,以含DMSO的PBS为溶剂将上述母液逐级稀释,制得质量浓度分别为500、250、125、62.5、31.3、15.63、7.82、3.91 μg/mL的对照溶液,DMSO含量为1%。
2.3.4 样品溶液 ①9种中药提取物样品溶液:分别称取“2.1”项下各中药提取物的干燥浸膏适量,研碎,精密称定,用DMSO溶解,再用PBS稀释,制得质量浓度均为2 000 μg/mL(以干燥浸膏质量计,下同)的提取物样品母液。采用二倍稀释法,以含DMSO的PBS为溶剂将上述母液逐级稀释,制得质量浓度分别均为2 000、1 000、500、250、125、62.5、31.3 μg/mL的样品溶液,DMSO含量为1%。②活性提取物各萃取部位样品溶液:分别称取“2.2”项下各活性提取物萃取部位浸膏适量,研碎,精密称定,用DMSO溶解,再用PBS稀释,制得质量浓度为1 000 μg/mL的萃取部位样品母液。采用二倍稀释法,以含DMSO的PBS为溶剂将上述母液逐级稀释,制得质量浓度分别均为1 000、500、250、125、62.5、31.3、15.6 μg/mL的样品溶液,DMSO含量为1%。
2.4 XO抑制活性的检测
在适宜条件下,黄嘌呤会被XO催化生成尿酸,尿酸在290 nm波长处有特征吸收峰[16]。基于此,本研究采用Vikrama Chakravarthi P等[16]报道的紫外分光光度法进行XO抑制活性的检测。反应体系总体积为200 μL,将“2.3.4”项下的样品溶液(或“2.3.3”项下的对照溶液,反应终浓度均较原样品稀释4倍)50 μL和酶溶液(反应终浓度为0.05 U/mL)50 μL混合后,于25 ℃预温育15 min,加入底物溶液(反应终浓度为150 μmol/L)50 μL以启动反应,于25 ℃温育20 min后,加入1 mol/L HCl溶液50 μL以终止反应。取上述反应液适量,使用全波长扫描式多功能读数仪于290 nm波长处检测各反应液的光密度(OD)值,取该值与温育0 min时OD值的差值作为检测结果。每样品平行操作3次,试验重复2次。同法检测空白样品(即不含受试提取物,以含1%DMSO的PBS替代样品溶液,以测定酶的最大反应活性)的OD值,并计算抑制率,抑制率(%)=(1-试验样品平均OD值/空白样品平均OD值)×100%[17]。
2.5 IC50的计算
采用Graphpad prism 6.0软件进行数据分析。以提取物(或别嘌醇)的(质量)浓度(c)的对数为横坐标、其相对应的OD值为纵坐标进行线性拟合,计算半数XO被抑制时的药物浓度,即IC50。
2.6 抑制类型判断
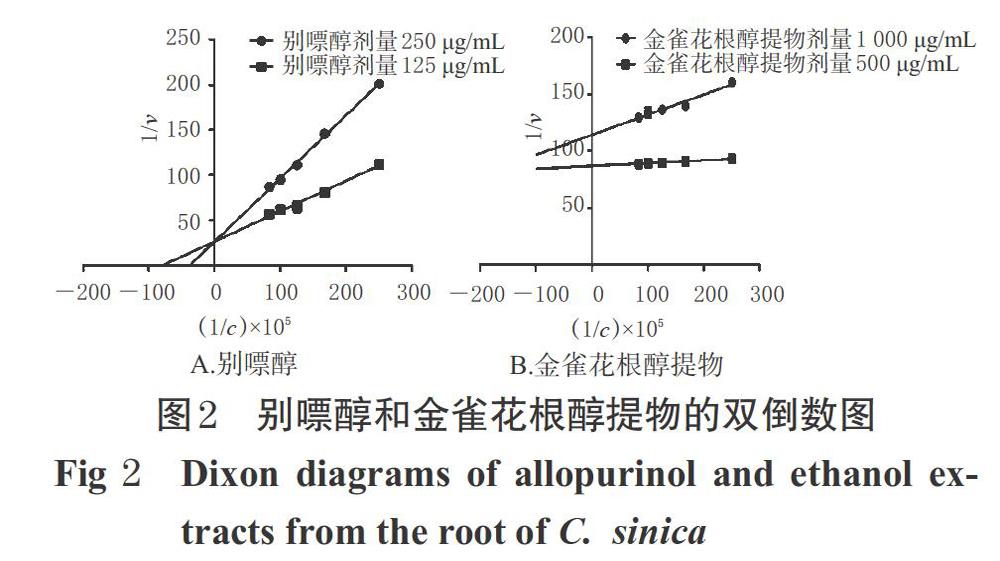
采用Graphpad prism 6.0软件、使用双倒数法绘图以进行酶抑制类型的判断[18]。在5个剂量黄嘌呤底物(1 200、1 000、800、600、400 μmol/L,反应终浓度分别为300、250、200、150、100 μmol/L)以及2个剂量别嘌醇(250、125 μmol/L,反应终浓度分别为62.5、31.25 μmol/L)、活性提取物(1 000、500 μmol/L,反应终浓度分别为250、125 μmol/L)的分别作用下,按“2.4”项下方法检测。以OD值20 min内变化速率[即(OD20 min-OD0 min)/20]的倒数(1/v)为因变量、黄嘌呤底物浓度倒数的105倍[(1/c)×105]为自变量绘制双倒数方程曲线,观察不同抑制剂浓度下两条曲线的交叉情况。若两条曲线相交于纵轴,为竞争性抑制;若相交于横轴,为非竞争性抑制;若相互平行无交叉,为反竞争性抑制;若相交于第2象限,为竞争-非竞争性抑制;若相交于第3象限,为非竞争-反竞争性抑制[18]。
3 结果
3.1 9种中药提取物XO抑制活性的初筛结果
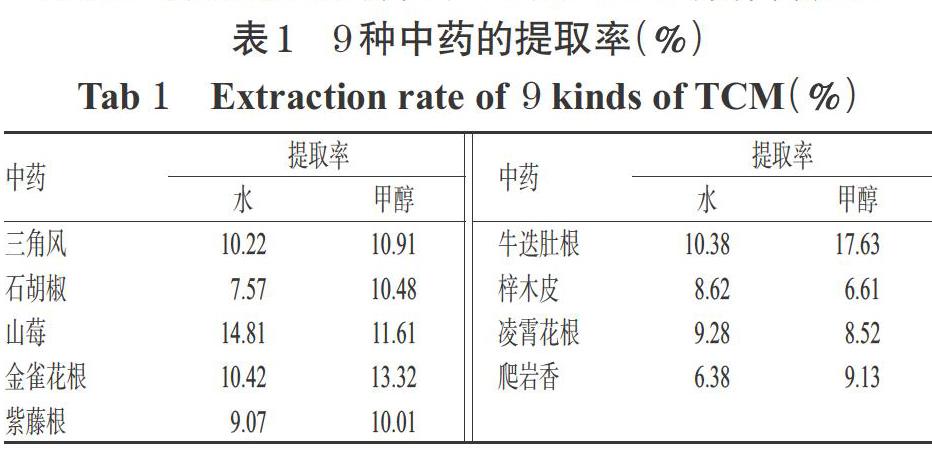
在相同终浓度条件下,9种中药共18个提取物对XO的抑制率及IC50值见表2。由表2可见,各中药提取物对XO的抑制率均有随剂量降低而下降的趋势,其中500 μg/mL各中药提取物(除石胡椒醇提物超出限度外),250 μg/mL三角风、石胡椒、山莓、爬岩香的水提物和醇提物,250 μg/mL梓木皮水提物,250 μg/mL金雀花根、牛迭肚根、凌霄花根醇提物,125 μg/mL金雀花根、牛迭肚根醇提物以及62.5 μg/mL金雀花根醇提物对XO的抑制率均超过了50%。当提取物剂量为62.5 μg/mL时,超半数提取物对XO的抑制率低于或接近10%,且爬岩香水提物的抑制率低至1.0%;当提取物剂量≤31.25 μg/mL时,除金雀花根醇提物(31.25 μg/mL)对XO的抑制率为48.3%外,其余提取物对XO的抑制率均已降至10%以下。在18个提取物中,金雀花根醇提物的IC50(43.43 μg/mL)雖高于阳性对照别嘌醇(5.11 μg/mL),但明显低于其余药材的提取物,表明金雀花根醇提物活性相对较强,故以其为活性提取物进行后续试验。
3.2 金雀花根醇提物XO抑制活性萃取部位的筛选结果
活性提取物金雀花根醇提物不同萃取部位对XO的体外抑制活性检测结果见图1、表3。由图1、表3可见,EA、NB、DCM部位对XO的抑制率有随剂量增加而降低的趋势。其中,EA部位的IC50值为7.67 μg/mL,接近于别嘌醇的5.11 μg/mL,活性最强;NB部位的IC50值为14.80 μg/mL,活性次之;DCM部位的IC50值为193.35 μg/mL,活性相对较弱;而W、PE部位的IC50值均大于200 μg/mL,无活性。
3.3 金雀花根醇提物酶抑制类型分析
在不同抑制剂浓度下,别嘌醇的两条曲线相交于纵轴,属于竞争性抑制;而金雀花根醇提物的两条曲线相交于第2象限,属于竞争-非竞争性抑制,详见图2。
4 讨论
XO是一种多功能的钼羟化酶,广泛分布于肝脏、肾脏、胃肠道、肺、心脏和血管内皮中,是嘌呤代谢途径中的关键酶,能催化次黄嘌呤和黄嘌呤反应,产生尿酸和过氧化物自由基,从而导致痛风等疾病的发生[19-20]。XODI可通过抑制XO活性,阻止尿酸和过氧化物的生成,现已被广泛应用于高尿酸血症、痛风等症的临床治疗[21]。鉴于此,本研究基于文献方法[16]进行设计,在体外模拟XO诱导黄嘌呤生成尿酸的反应体系,拟通过考察药物对酶催化尿酸生成的影响,初步评价药物对XO的抑制活性。结果显示,阳性对照别嘌醇的IC50值为5.11 μg/mL,与文献[16]数据[(6.16±0.10)μg/mL]差异不大,提示方法可行。同时,为了尽量消除中药提取物溶解度及颜色对检测结果所造成的干扰,并综合仪器限度等多方面因素,本研究最终确定活性初筛试验中各受试药材样品溶液的最高反应终浓度为500 μg/mL。但需要说明的是,在实际操作中,500 μg/mL石胡椒醇提物样品溶液的OD值仍超出了仪器的检测限度,仅为个例,故笔者并未对其进行分析。
本研究共纳入了9种通络祛风中药,均收载于《中华本草》中,且明确记载可用于治疗痛风等相关疾病。这9种中药包含冷僻药及民族常用药。其中,瑶药三角风可用于临床治疗风湿、关节肿痛、跌打损伤、疮黄肿毒等症[15]。苗药石胡椒和爬岩香,前者舒络通经,多用于治疗风湿性关节炎等症,并可与雷公藤、三七、怀牛膝和莱菔子等组方成石藤胶囊[22-23],该胶囊与爬岩香均可用于治疗风湿骨痛、手足麻痹[24]。冷僻药山莓和牛迭肚根均主治痛风[25]。金雀花根与紫藤根皆属豆科,前者民间用以治疗风湿骨痛、痛风等症[26-27];后者与枸骨根、菝葜根水煎后,以米酒兑服,可治关节炎[28]。凌霄花根与梓木皮皆属紫葳科,凌霄花根具活血、散瘀、解毒和消肿等作用,可治疗风湿性筋骨痛、急性肠胃炎等多种疾病[29]。梓木皮被收录于《握灵本草》中,可“治霍乱不吐不泻,煎汤治手足痛风”[30]。基于此,本研究以上述9种中药为对象,对其XO抑制活性进行了初步评价。
作为活性物质挖掘的重要环节之一,本研究初步评价了9种中药共18个提取物对XO的体外抑制活性。为保证整个体外反应体系的可行性,综合考虑样品溶解性、最低有效浓度以及仪器限度等多方面因素,并参考已有文献[11,16,31],设置了“2.3”“2.4”“2.6”项下各提取物/萃取部位的反应浓度。结果显示,18个中药提取物对XO的抑制活性均有随剂量降低而减弱的趋势。其中,紫藤根、凌霄花根等中药提取物对XO抑制活性较弱或无XO抑制活性,提示其对痛风类疾病的治疗作用可能与XO抑制无关;金雀花根、三角风、石胡椒等中药提取物的XO抑制活性较为突出,提示XO抑制可能是這类中药抗痛风的主要机制,但均有待相关基础研究予以确认。9种中药的提取物中,金雀花根醇提物的IC50值为43.36 μg/mL,低于其余中药,提示其可作为XODI的重要药材来源。
本研究进一步对金雀花根醇提物的不同萃取部位进行了研究。结果显示,EA、NB、DCM部位对XO的抑制率均有随剂量增加而降低的趋势,其IC50值分别为7.67、14.80、193.35 μg/mL,提示中、高极性部位可能是金雀花根发挥XO抑制作用的主要有效部位,有进行深入挖掘的价值。此外,抑制类型研究结果显示,别嘌醇对XO的抑制类型为竞争性,与已有文献[32]结果基本一致;而金雀花根醇提物对XO的抑制类型为竞争-非竞争性,提示该提取物中可能含有具竞争-非竞争性抑制作用的单体抑制剂,亦有可能含有不同抑制类型的多个单体抑制剂,但有待通过成分分析和相应基础研究予以证实。本研究结果为进一步研究金雀花根的作用机制以及从金雀花根中寻找XODI奠定了基础。
综上所述,金雀花根、牛迭肚根、石胡椒、山莓、爬岩香、三角风等醇提物及三角风、石胡椒、梓木皮等水提物均表现出了较强的XO抑制活性,这些中药的抗痛风作用可能与其XO抑制活性有关。此外,金雀花根醇提物中抗XO活性较强的EA和NB萃取部位也有待进一步研究与开发。
参考文献
[ 1 ] PASCART T,RICHETTE P. Current and future therapies for gout[J]. Expert Opin Pharmacother,2017,18(12):1201-1211.
[ 2 ] 马新路.痛风的药物治疗新进展[J].继续医学教育,2017(9):151-152.
[ 3 ] 郭润竹,王雄,邹吉利,等.痛风治疗药物的研究进展[J].医学综述,2017,23(16):3265-3269.
[ 4 ] KHANNA D,FITZGERALD JD,KHANNA PP,et al. 2012 American college of rheumatology guidelines for management of gout: part 1:systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia[J]. Arthritis Care Res:Hoboken,2012,64(10):1431-1446.
[ 5 ] ABHISHEK A,RODDY E,DOHERTY M. Gout:a guide for the general and acute physicians[J]. Clin Med:Lond,2017,17(1):54-59.
[ 6 ] SOSKIND R,ABAZIA DT,BRIDGEMAN MB. Updates on the treatment of gout,including a review of updated treatment guidelines and use of small molecule therapies for difficult-to-treat gout and gout flares[J]. Expert Opin Pharmacother,2017,18(11):1115-1125.
[ 7 ] KUMAR A,AZMI W. Phytomedicine:a novel alternative for treatment of gout[J]. Ann Phytomed,2014,3(1):80- 88.
[ 8 ] 李磊,姜红江,孙佳星,等.抗痛风中药及其作用机制研究进展[J/CD].创伤与急诊电子杂志,2016,4(2):110-113.
[ 9 ] 陈旅翼,黄亚敏,罗维,等.抗痛风民族药物研究进展[J].中南民族大学学报(自然科学版),2016,35(4):52-56.
[10] MEHMOOD A,ISHAQ M,ZHAO L,et al. Natural compounds with xanthine oxidase inhibitory activity:a review[J]. Chem Biol Drug Des,2019,93(4):387-418.
[11] KONG LD,CAI Y,HUANG WW,et al. Inhibition of xanthine oxidase by some Chinese medicinal plants used to treat gout[J]. J Ethnopharmacol,2000,73(1/2):199-207.
[12] 王亮.粉刺锦鸡儿抗类风湿性关节炎及化学成分研究[D].上海:第二军医大学,2015.
[13] 张燕,石妍.蒙药小叶锦鸡儿的化学成分、药理作用研究进展[J].包头医学院学报,2015,31(8):150-152.
[14] 杜庆波,蔡红.锦鸡儿属植物化学成分及药理活性研究新进展[J].宿州学院学报,2012,27(11):26-28.
[15] 唐宇龙,刘湘新,唐小武,等.三角风化学成分分析与抗菌效果研究[J].中国兽医杂志,2007,43(2):51-52.
[16] VIKRAMA CHAKRAVARTHI P,MURUGESAN S,ARIVUCHELVAN A,et al. In vitro xanthine oxidase inhibitory activity of Piper betle and Phyllanthus niruri[J]. J Pharmacogn Phytochemistry,2018,7(5):959-961.
[17] NGUYEN MT,AWALE S,TEZUKA Y,et al. Xanthine oxidase inhibitory activity of Vietnamese medicinal plants[J]. Biol Pharm Bull,2004,27(9):1414-1421.
[18] 郭勇,郑穗平.酶学[M].广州:华南理工大学出版社,2000:109-110.
[19] OJHA R,SINGH J,OJHA A,et al. An updated patent review:xanthine oxidase inhibitors for the treatment of hyperuricemia and gout:2011-2015[J]. Expert Opin Ther Pat,2017,27(3):311-345.
[20] CHEN CY,LYU JM,YAO QZ. Hyperuricemia-related diseases and xanthine oxidoreductase (XOR)inhibitors:an overview[J]. Med Sci Monit,2016. DOI:10.12659/MSM. 899852.
[21] KIM SC,SCHNEEWEISS S,CHOUDHRY N,et al. Effects of xanthine oxidase inhibitors on cardiovascular disease in patients with gout:a cohort study[J]. Am J Med,2015,128(6):653.e7-653.e16.
[22] 唐先平,胡蔭奇.“痰瘀相关”与类风湿性关节炎[J].中华中医药杂志,2005,20(3):173-176.
[23] 王振亮.石藤胶囊治疗类风湿性关节炎30例临床观察[J].中华中医药杂志,2011,26(3):528-530.
[24] 简曙光,李玲,张倩媚,等.山蒟(Piper hancei)的生态生物学特征[J].生态环境学报,2009,18(2):608-613.
[25] 国家中医药管理局《中华本草》编委会.中华本草:第4卷[M].上海:上海科学技术出版社,1999:251-254.
[26] CHEN L,WANG J,KANG W. Chemical constituents of Caragana sinica[J]. Chem Nat Comd,2016,52(6):1141- 1142.
[27] 吴中民.新华中医纲要:第2册[M].上海:上海科学技术出版社,1991:109.
[28] 于金平,任全进.解毒驱虫话紫藤[J].园林,2000(5):48.
[29] 党璇,杨文慧,姚默,等.凌霄属药学研究概况[J].安徽农业科学,2011,39(33):20389-20390.
[30] 王翃.握灵本草[M].北京:中国中医药出版社,2012:229.
[31] 许洪波,周瑞,谢培,等. 27种中草药的黄嘌呤氧化酶抑制活性筛选[J].时珍国医国药,2017,28(3):547-548.
[32] TUNG YT,CHANG ST. Inhibition of xanthine oxidase by Acacia confusa extracts and their phytochemicals[J]. J Agr Food Chem,2010,58(2):781-786.
(收稿日期:2019-07-12 修回日期:2020-01-13)
(编辑:张元媛)
