拟南芥AtUNE12基因的耐盐功能初探
2020-04-08李子义贺子航卢惠君王玉成及晓宇
李子义 贺子航 卢惠君 王玉成 及晓宇
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
土壤盐渍化严重限制了植物正常生长,是全球农林业发展的一个重要问题。植物通过信号传导途径调控基因表达来响应盐胁迫[1],随着分子开关控制应激反应基因的表达,转录因子在调节各种非生物胁迫应激反应中起着至关重要的作用。因此,研究转录因子所调控的基因表达网络并筛选出抗逆能力优良的基因,进而培育良种,具有重要的生态、社会意义[2]。
bHLH转录因子是植物第二大类转录因子家族[3],包含N端碱性区域和C端螺旋—环—螺旋区域两个结构域[4~5],其主要通过参与复杂的信号通路来调控下游基因的表达[6],进而调节植物各种生理生化反应及生长发育过程[7]。到目前为止,研究者在水稻(Oryzasativa)、玉米(Zeamays)和小麦(Triticumaestivum)基因组中共鉴定出183,231和571种bHLH转录因子,与拟南芥(Arabidopsisthaliana)的1 154个bHLH转录因子被分为36个亚科[8]。已有部分植物bHLH转录因子的功能被鉴定出来,如烟草(Nicotianatabacum)NtbHLH123、小麦TabHLH1及拟南芥AtbHLH18,AtbHLH34和AtbHLH115等[9~13],而在拟南芥中还有许多bHLH转录因子功能亟待鉴定。
bHLH转录因子家族成员在植物生长发育、生理代谢中起重要作用[6]。例如,在烟草中,NtbHLH93主要在生育期侧根和盛花期子房组织中高表达[14]。在番茄(Solanumlycopersicum)中,SlbHLH22诱导表达细胞壁代谢相关基因(SlEXP1,SlLoxA,SlMAN,SlPE和SlXTH5),过表达SlbHLH22番茄果实较野生型成熟快[3]。PREs(Paclobutrazol Resistances)参与调节植物对赤霉素、油菜素类固醇和生长素(IAA)等几种不同植物激素的反应[15]。bHLH转录因子MYC2是茉莉酸(JA)信号通路的重要调节因子,在苹果(Malusdomestica)中花青素生物合成基因MdDFR,MdUF3GT,MdF3H和MdCHS的转录水平在过表达MdMYC2愈伤组织中显著上调,使过表达的愈伤组织产生更多的花青素[16]。
不仅如此,bHLH转录因子在非生物胁迫响应过程中也起到重要作用[17]。许多研究表明过表达bHLH基因增强了植物对盐、干旱、冷冻及氧化胁迫的耐受性[4,18~20]。过表达AtbHLH104拟南芥增强了其镉(Cd)胁迫耐受性[21],bHLH104转录因子正调节四种重金属解毒相关基因(IREG2,MTP3,HMA3和NAS4),这些基因在Cd螯合和耐受中起作用。在烟草中过表达穇子(Eleusinecoracana)EcbHLH57基因显著提高了其对盐胁迫和干旱胁迫的耐受性。过表达EcbHLH57烟草在干旱胁迫下,表现出较高的光合速率和气孔导度;在盐胁迫下,积累较高的种子重量和荚果数,从而提高了烟草的耐盐抗旱功能[22]。在水稻中,盐胁迫下过表达OsbHLH068降低了水稻H2O2的积累,促进了根系的伸长,保持水分来抵抗胁迫[23];OsbHLH062介导的转录激活调控盐胁迫耐受相关基因的表达,从而发挥转录调控作用,增强水稻的耐盐能力[24]。上述研究表明bHLH转录因子在响应非生物胁迫的过程中起关键作用。
拟南芥bHLH蛋白Ⅺ亚家族共有五个成员,包括bHLH7(AT1G03040)、bHLH82(AT5G58010)、bHLH69(AT4G30980)、bHLH59(AT4G02590)及bHLH66(AT2G24260)[25],本研究中AtUNE12基因(AT4G02590)属于该亚家族。据已有研究,发现bHLH蛋白Ⅺ亚家族中bHLH69基因[26]与bHLH82基因[27]响应非生物胁迫,我们推测该亚家族其他基因也可能具有抗逆功能,因此,本研究拟对AtUNE12基因的耐盐功能进行鉴定,以期为进一步探究bHLH转录因子响应非生物胁迫的调控机制奠定基础。
1 材料与方法
1.1 植物材料
哥伦比亚野生型拟南芥(Arabidopsisthaliana):生态型Columbia(Col-0)其种子由东北林业大学林木遗传育种国家重点实验室保存。
将拟南芥种子播种于蛭石、珍珠岩及黑土(体积比为3∶1∶1)的混合土中,置于温度为22±2℃,相对湿度为65%~75%,光照强度为400 μmol·m-2·s-1,光周期为16 h光照/8 h黑暗的人工培养室培养。
1.2 质粒与菌株
植物表达载体pROKⅡ、大肠杆菌(Escherichiacoli)DH5α及根癌农杆菌(Agrobacteriumtumefaciens)EHA105均由东北林业大学林木遗传育种国家重点实验室保存。
1.3 拟南芥总RNA的提取与cDNA第一链的合成
选取4周苗龄的拟南芥植株,利用TRIzol法[28],进行总RNA的提取。参照PrimeScriptTMRT reagent Kit(TaKaRa)试剂盒说明合成cDNA第一链以备用。
1.4 AtUNE12基因的克隆
根据AtUNE12基因序列,利用Primer Premier 5.0设计克隆引物AtUNE12-F和AtUNE12-R(表1),以合成的拟南芥cDNA为模板,进行聚合酶链式反应(PCR)扩增,将获得的克隆片段与pMD18-T(TaKaRa)载体连接,转化大肠杆菌后测序鉴定。
1.5 多序列比对及系统进化树分析
利用NCBI(https://www.ncbi.nlm.nih.gov/Blast.cgi)网站进行BlastP检索,获得与拟南芥AtUNE12基因同源性较高的12个不同物种的bHLH氨基酸序列,利用BioEdit软件进行多序列比对,并利用MEGA6.0软件,使用邻位归并法(Neighbor-joining)进行系统进化树分析。
1.6 AtUNE12基因植物过表达载体的构建与转基因拟南芥的获得
利用Primer Premier 5.0设计引物pROKⅡ-AtUNE12-F和pROKⅡ-AtUNE12-R(表1),引入SmaⅠ酶切位点,用SmaⅠ(NEB)线性化pROKⅡ载体质粒,将克隆获得的AtUNE12基因与线性化pROKⅡ载体进行同源融合(Infusion),转化大肠杆菌并测序验证,结果与原序列比对正确之后提取重组pROKⅡ-AtUNE12载体质粒,将其转入EHA105农杆菌中,利用浸花法[29]获得转基因拟南芥。对转基因拟南芥进行DNA提取[30],用pROKⅡ载体引物进行PCR,电泳检验,并通过实时荧光定量PCR(qRT-PCR)技术进行检测,利用2-ΔΔCt法进行基因的相对表达量分析[31],最终获得T3代转基因拟南芥。
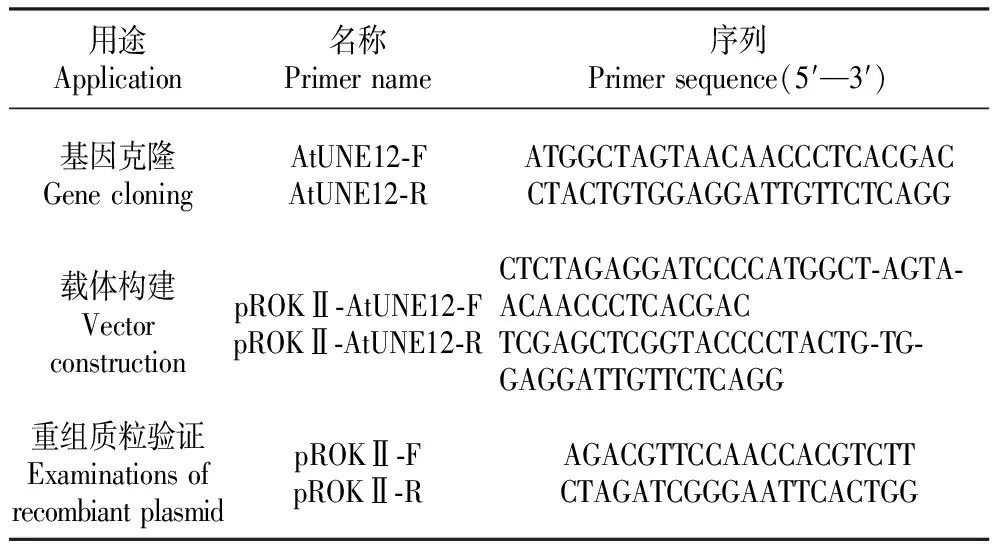
表1 引物序列
1.7 转基因拟南芥的根长、鲜重测定分析
将过表达AtUNE12拟南芥T3代纯合株系与对照拟南芥种子平铺于1/2 MS培养基上,待种子萌发5 d后,分别转移至1/2 MS和含有150 mmol·L-1NaCl的1/2 MS培养基平板上,在人工培养室直立培养7 d后观察各植株的长势,测定其根长及鲜重并拍照,数据使用SPSS18.0进行统计分析。
1.8 拟南芥耐盐生理生化指标测定
将4周苗龄的过表达AtUNE12拟南芥T3代纯合株系与对照拟南芥植株的土培苗用150 mmol·L-1NaCl溶液进行胁迫处理,分别取胁迫处理的过表达AtUNE12与对照拟南芥植株(3次生物学重复),测定植株的过氧化物酶(POD)与超氧化物歧化酶(SOD)活性、过氧化氢(H2O2)含量、电解质渗透率、丙二醛(MDA)含量及失水率(失水率分别在胁迫0.5、1、2、3、4及5 h进行测定),方法参照植物基因工程实验技术指南[32],数据使用SPSS 18.0进行统计分析。
2 结果与分析
2.1 AtUNE12基因多序列比对及系统进化树分析
AtUNE12基因的开放阅读框为933 bp,编码310个氨基酸。在NCBI(https://www.ncbi.nlm.nih.gov/Blast.cgi)网站上对其编码的氨基酸序列进行同源搜索BLAST,发现AtUNE12与枣ZjbHLH和番木瓜CpbHLH的相似性高达99%。通过多序列比对及系统进化树分析其氨基酸序列与其他12个物种的bHLH蛋白的相似性,多序列比对结果显示,AtUNE12具有bHLH家族典型的序列特征(图1A)。系统进化树结果显示,AtUNE12与EsbHLH蛋白的亲缘关系较近,推测二者可能具有相似的功能(图1B)。
2.2 AtUNE12基因的克隆及pROKⅡ-AtUNE12载体验证
以合成的拟南芥cDNA为模板,用克隆引物AtUNE12-F和AtUNE12-R进行PCR,克隆获得AtUNE12基因(图2A)。将AtUNE12基因与pROKⅡ载体连接后,利用pROKⅡ载体引物pROKⅡ-F和pROKⅡ-R(表1)进行PCR检查,电泳结果显示AtUNE12基因已成功构建到pROKⅡ载体中(图2B)。
2.3 转AtUNE12基因拟南芥的检测
提取T3代9个株系转AtUNE12基因拟南芥的DNA[30],用AtUNE12基因克隆引物进行PCR,琼脂糖凝胶电泳检测(图3A);对过表达AtUNE12拟南芥植株进行RNA提取,利用qRT-PCR技术检测9个株系中AtUNE12的相对表达量,结果表明AtUNE12基因已成功转入拟南芥(图3A),并且OE3与OE7株系中AtUNE12基因的表达量较其他株系高(图3B)。因此,选择OE3和OE7过表达株系进行后续的耐盐功能分析。

图1 AtUNE12多序列比对及系统进化树分析 A.多序列比对黑框表示bHLH家族的2个保守结构域;B.系统进化树百分数表示自展值 EsbHLH.山萮菜(XP_006396471.1);CrbHLH.荠菜(XP_023637045.1);CsbHLH.亚麻荠(XP_010456011.1);ThbHLH.醉蝶花(XP_010556765.1);CpbHLH.番木瓜(XP_021898025.1);ZjbHLH.枣(XP_015891470.1);TcbHLH.可可树(XP_017983588.1);RcbHLH.蓖麻(XP_002520976.1);GmbHLH.大豆(XP_003554277.1);SsbHLH.密花豆(TKY62402.1);QsbHLH.欧洲栓皮栎(XP_023886707.1);CcbHLH.木豆(XP_020227636.1)Fig.1 Multiple sequence alignment and phylogenetic tree analysis of AtUNE12 A.Multiple sequence alignment black boxes indicate two conserved domains of the bHLH family;B.Phylogenetic tree percentage indicate bootstrap values EsbHLH.Eutrema salsugineum;CrbHLH.Capsella rubella;CsbHLH.Camelina sativa;ThbHLH.Tarenaya hassleriana;CpbHLH.Carica papaya;ZjbHLH.Ziziphus jujuba;TcbHLH.Theobroma cacao;RcbHLH.Ricinus communis;GmbHLH.Glycine max;SsbHLH.Spatholobus suberectus;QsbHLH.Quercus suber;CcbHLH.Cajanus cajan
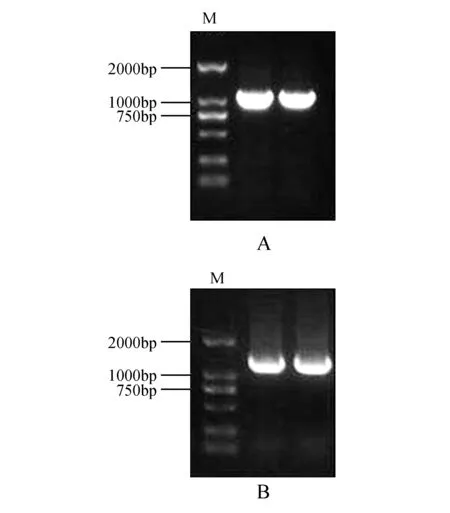
图2 AtUNE12基因克隆及pROKⅡ-AtUNE12载体验证结果 A.基因克隆验证;B.载体构建验证;M.DL2000 MarkerFig.2 The results of AtUNE12 gene cloning and pROKII-AtUNE12 vector verification A.Verification of gene cloning; B.Verification of vector construction; M.DL2000 Marker
2.4 过表达AtUNE12基因与野生型拟南芥的根长、鲜重测定结果
在盐胁迫下,观察过表达AtUNE12与野生型拟南芥植株长势,统计根长及鲜重数据,拍照。结果表明:盐胁迫下,过表达株系(OE3和OE7)的根长及鲜重显著高于野生型(Col-0)植株(图4),说明过表达AtUNE12基因显著提高了拟南芥植株的耐盐能力。
2.5 过表达AtUNE12基因与野生型拟南芥植株的MDA含量、电解质渗透率及失水率分析
MDA是膜脂过氧化最重要的产物之一,通过MDA了解膜脂过氧化的程度,以间接说明膜系统受损程度及植物的抗逆性。分别取盐胁迫处理的过表达AtUNE12基因与对照拟南芥植株叶片进行MDA含量测定(3次重复)。结果表明:在正常生长条件下,过表达AtUNE12基因(OE3和OE7)及野生型(Col-0)拟南芥植株的MDA含量无明显差异;而在盐胁迫条件下,过表达AtUNE12基因拟南芥的MDA含量明显低于野生型拟南芥(图5A)。
电解质渗透率是反应细胞膜受损情况与程度的重要生理指标之一,电解质外渗越多,说明植物受损伤越严重。分别取盐胁迫处理的过表达AtUNE12基因与对照拟南芥植株叶片进行电解质渗透率测定(3次重复)。结果表明:在正常生长条件下,过表达AtUNE12基因及野生型拟南芥植株电解质渗透率无明显差异;而在盐胁迫条件下,过表达AtUNE12基因拟南芥的电解质渗透率明显低于野生型拟南芥(图5B)。
植物离体叶片失水率是研究植物抗逆的重要生理指标之一,一般情况下,植物的抗逆性与离体叶片失水状况成负相关。分别取过表达AtUNE12基因与对照拟南芥植株叶片进行失水率测定(3次重复),结果表明:过表达AtUNE12基因及野生型拟南芥植株0.5 h内失水率没有明显的变化;1~5 h内,过表达AtUNE12基因及野生型拟南芥植株的失水率差距逐渐增大,其中OE3的失水率最低(图5C)。上述结果说明过表达AtUNE12基因显著降低了盐胁迫下拟南芥的电解质渗透率,MDA含量及失水率,保护细胞膜结构的完整性,从而增加拟南芥的耐盐能力。
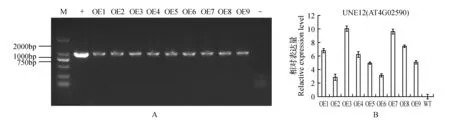
图3 T3代过表达AtUNE12拟南芥的检测结果 M.DL2000 Marker; OE1~OE9.T3代AtUNE12基因过表达株系1~9;+.阳性对照;-.阴性对照Fig.3 Identification of Arabidopsis thaliana with overexpression of AtUNE12 M.DL2000 Marker; OE1-OE9.Overexpression AtUNE12 gene of T3 generation strain 1-9; +.Positive control; -.Negative control
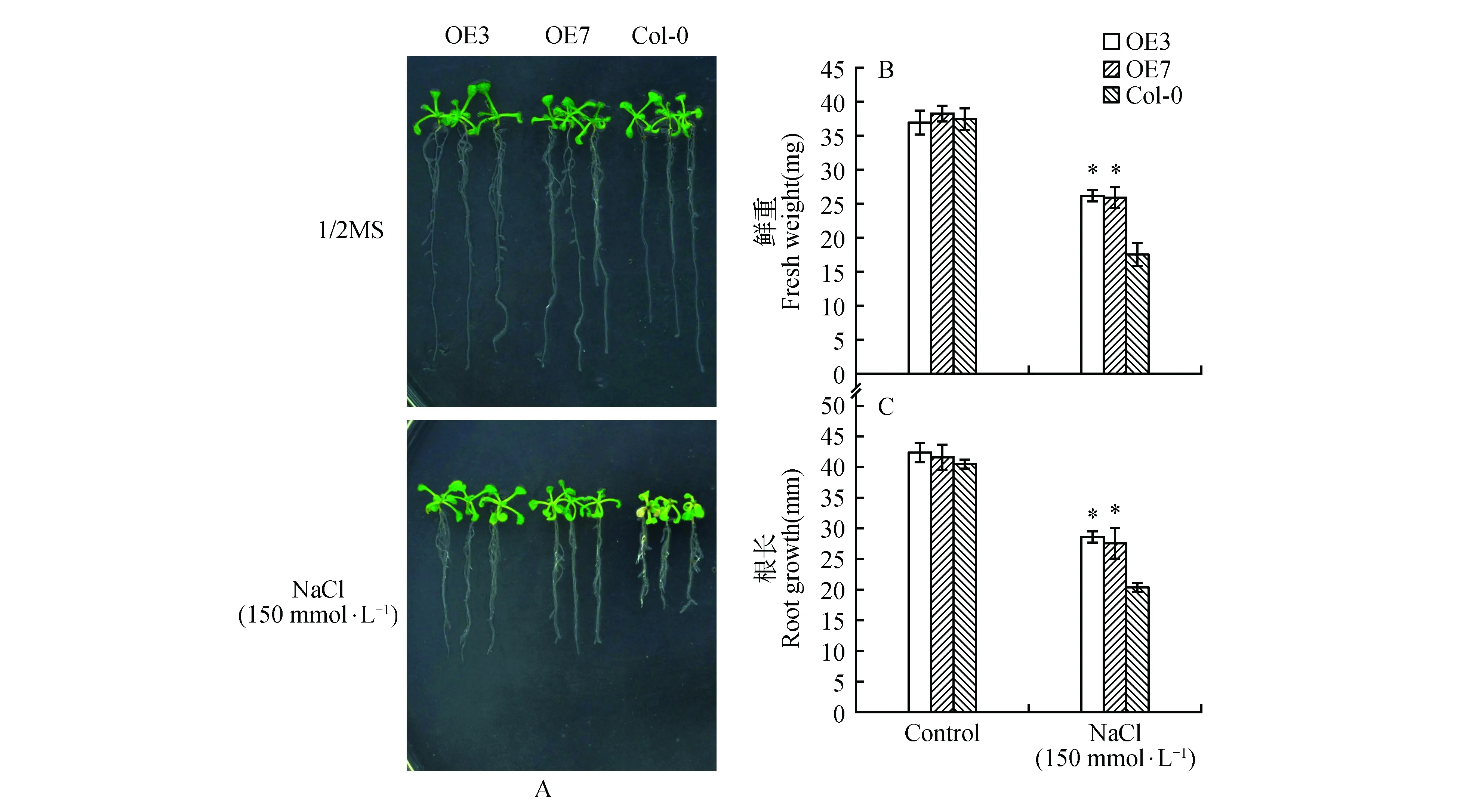
图4 盐胁迫下过表达AtUNE12及野生型拟南芥的长势分析Fig.4 Growth analysis of OE and Col-0 A.thaliana under salt stress
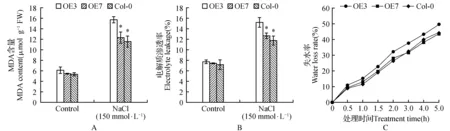
图5 盐胁迫下过表达AtUNE12及野生型拟南芥MDA含量、电解质渗透率及失水率分析Fig.5 MDA contents,Electrolyte leakage and water loss rates in OE and Col-0 A.thaliana under salt stress
2.6 过表达AtUNE12基因与野生型拟南芥植株POD、SOD活性及H2O2含量测定
POD与SOD能清除植物在胁迫过程中产生的有害物质,探究POD与SOD活性以反映植物抗逆能力。分别取盐胁迫后的过表达AtUNE12基因及对照拟南芥植株进行POD与SOD活性测定(3次重复)。结果表明:正常生长条件下,过表达AtUNE12基因(OE3和OE7)及野生型(Col-0)拟南芥POD、SOD活性无明显差异;而盐胁迫下,过表达AtUNE12基因拟南芥的POD、SOD活性要显著高于野生型拟南芥(图6:A,B)。上述结果表明AtUNE12基因在拟南芥中正向调控POD和SOD活性,增强了拟南芥的ROS清除能力,进而提高了拟南芥的耐盐功能。
测定过表达AtUNE12基因与对照拟南芥植株内的H2O2含量变化,以分析其活性氧(ROS)水平。分别取盐胁迫过表达AtUNE12基因及对照拟南芥叶片测定H2O2含量(3次重复),结果表明:在正常生长条件下,H2O2含量在过表达AtUNE12基因(OE3和OE7)及野生型(Col-0)拟南芥中基本一致;而在盐胁迫下,过表达AtUNE12基因拟南芥的H2O2含量明显低于野生型拟南芥(图6C)。上述结果表明过表达AtUNE12基因能够降低拟南芥植株内H2O2的含量,进而降低ROS的积累。

图6 盐胁迫下过表达AtUNE12及野生型拟南芥植株ROS水平及POD、SOD活性分析Fig.6 Analysis of ROS accumulation and the activities of POD and SOD in OE,Col-0 A.thaliana under salt stress
3 讨论
本研究选取拟南芥bHLH转录因子家族的AtUNE12基因进行耐盐功能分析。通过浸花法获得了AtUNE12基因过表达拟南芥,利用qRT-PCR技术选出AtUNE12基因相对表达量较高的OE3和OE7株系,用于后续耐盐能力的分析。分别对AtUNE12基因过表达及野生型拟南芥植株的根长、鲜重及耐盐生理指标进行测定。在盐胁迫下,发现过表达AtUNE12基因拟南芥的根长、鲜重及长势显著优于野生型,为了进一步验证AtUNE12基因的耐盐功能,在盐胁迫下,AtUNE12基因的过表达降低拟南芥植株的电解质渗透率、MDA含量及失水率,减轻细胞损伤,进而增加拟南芥的耐盐能力。通过POD和SOD活性及H2O2含量测定,来检验拟南芥体内的ROS水平。在盐胁迫下,过表达AtUNE12植株的POD、SOD活性要显著高于野生型植株,H2O2含量明显低于野生型。因此,我们推断在盐胁迫下,AtUNE12基因的过表达能够影响相关调控POD、SOD酶活的基因,进而提高了拟南芥ROS清除能力。
大量的研究表明bHLH转录因子基因能提高植物对非生物胁迫的耐受性。过表达刚毛柽柳(Tamarixhispida)ThbHLH1基因通过增强ROS清除能力,提高了转基因拟南芥及刚毛柽柳的耐盐和抗旱能力[33]。将AtUNE12基因进行blast比对,结果发现其与ThbHLH1基因具有较高的同源性。NtbHLH123基因在烟草中过量表达,参与胁迫相关基因的表达调控,能够正向调节烟草的ROS清除能力;与此同时降低了植株电解质渗透率及MDA含量,来减轻细胞损伤程度,进而增强烟草非生物胁迫耐受性[34]。ZmbHLH105基因响应逆境胁迫调控,锰(Mn)/铁(Fe)相关转运蛋白的表达,通过增强ROS清除能力,提高玉米非生物胁迫耐受性[35]。甜橙(Citrussinensis)中CsbHLH18基因在烟草中过量表达,通过减少植株ROS的积累增强其耐寒性[36]。在低温胁迫下,过表达PubHLH1的山梨(Pyrusussuriensis)品系较野生型具有更高的存活率,更低的电解质渗透率及MDA含量。转基因品系较野生型的ROS清除水平更高[37]。在盐、干旱胁迫下,过表达TabHLH1的小麦品系体内SOD、POD的活性较野生型显著增强;在渗透胁迫条件下,H2O2含量明显减少,表明TabHLH1响应非生物胁迫,增强ROS清除水平,提高小麦非生物胁迫耐受性[12~13]。在拟南芥中,AtbHLH112通过与GCG-Box或E-Box结合调节基因的表达,提高ROS的清除能力,以增强拟南芥非生物胁迫耐受性[38]。
上述研究表明,bHLH转录因子基因能够介导增强ROS清除能力与减轻细胞损伤程度来提高植物对非生物胁迫的耐受性。这与本研究中过表达AtUNE12基因提高拟南芥耐盐能力的结果相符。本研究丰富了bHLH转录子家族抗逆基因功能研究的成果,为进一步系统阐述bHLH转录因子响应非生物胁迫的调控机制奠定了基础。
4 结论
本研究克隆了bHLH转录因子家族中的AtUNE12基因并构建其过表达载体,获得了T3代过表达AtUNE12基因拟南芥。AtUNE12基因正向调控POD与SOD酶的活性,过表达AtUNE12基因增强了拟南芥的ROS清除能力,减少细胞受损程度,进而提高了拟南芥的耐盐能力。
