酶法协同超声波辅助酸法提取柚子皮中果胶工艺条件优化
2020-04-02刘媛洁1胡欢平1严美婷
刘媛洁1,张 良,*,胡欢平1,严美婷
(1.江西医学高等专科学校,江西上饶 334000;2.江西省食品发酵研究所,江西宜春 336000)
果胶(pectin)是一种由聚半乳糖醛酸组成的高分子多糖物质[1-2],是一种膳食纤维,不被人体所吸收,具有多种生理功效,如改善便秘、降血糖、美容养颜、排除体内毒素等,在工业上还可用于增稠剂、乳化剂等[3-5]。天然的果胶类物质常以果胶、原果胶的形态存在于植物细胞中,是构成植物细胞壁的成分之一[6]。有研究表明,柚子皮中含有丰富的果胶,含量可达干物质的30%左右[7]。我国柚子产量高,资源丰富[8],但目前柚子主要是用来鲜食,果皮大多被丢弃,而柚子皮占整个果实重量的30%~50%[9-10],被当作废弃物弃之会造成资源的浪费,故将柚子皮作为提取果胶的原材料,可大大的提高柚子附加值。
常用的果胶提取方法有酸提取法、超声波提取法、微波提取法和酶提取法等[11-13]。酸提取法操作简单,提取的果胶品质好[14-15]。超声波提取法可利用其产生的空化作用有效地破坏组织的细胞壁,并且能加快物质的扩散速度,从而利于果胶的快速溶出,以提高果胶得率[16]。酶解提取法是利用具有专一性和高效性的酶来分解破坏植物细胞壁和细胞间质等组织结构,从而提高果胶提取率[17]。酶法协同超声波辅助酸提取法能有效结合酶解提取法、超声波提取法和酸提取法三者的优点,能协同有效地提高果胶的提取率,用时短,应用性强[18]。目前以酶法协同超声波辅助酸法提取柚子皮中的果胶尚未见报道。
本研究以江西广丰成熟期的马家柚为原料,采用酶法协同超声波辅助酸法提取柚子皮中的果胶,在单因素实验基础上,运用Plackett-Burnman试验设计筛选出对果胶得率有显著影响的要素因子,进一步采用Box-Behnken试验设计优化了柚子皮中果胶的提取工艺,可为柚子皮的深加工提供数据基础。
1 材料与方法
1.1 材料与仪器
柚子 产自江西广丰成熟期的马家柚;纤维素酶(2×104U/g) 北京索莱宝科技有限公司;无水乙醇、浓盐酸(均为分析纯) 西陇化工股份有限公司。
HH-4恒温水浴锅 上海一恒科学仪器有限公司;KQ-400KDE超声波清洗机 昆山市超声仪器有限公司;ML204电子天平 上海精科天美有限公司;GZX-9240MBE电热鼓风干燥箱 无锡莱蒲仪器设备有限公司;PHS-3C pH计 上海仪电科学仪器股份有限公司。
1.2 试验方法
1.2.1 柚子皮的预处理 将新鲜柚皮切成碎块,用热水漂洗数次至无色,再置于60 ℃下干燥24 h,粉碎后过60目筛,将制备好的柚子粉末放入干燥器中密封备用。
1.2.2 柚子皮中果胶提取流程 称取适量柚子皮粉末于500 mL锥形瓶中,以一定的料液比加入蒸馏水,根据柚子皮的质量加入一定量的纤维素酶进行水浴酶解一定时间,酶解完后用盐酸调节提取液至一定pH,然后置于超声波清洗机中在一定的功率计一定的提取温度下超声一定的时间提取果胶,提取完成后4000 r/min离心20 min,取上清液。再将1.5倍体积的无水乙醇缓慢加入上清液中,并不断搅拌,静置一段时间后8500 r/min离心10 min,收集沉淀,置于55 ℃烘箱中干燥至恒重得到果胶。
1.2.3 柚子皮中果胶提取工艺优化
1.2.3.1 酶用量的确定 按照 1.2.2的方法,固定料液比为1∶20 g/mL,酶解时间为70 min,提取液pH为2.0,超声功率为250 W,提取温度为80 ℃,提取时间为30 min,研究酶用量(0.5%、1.0%、1.5%、2.0%、2.5%)对柚子皮中果胶得率的影响。
1.2.3.2 酶解时间的确定 选择最佳酶用量,固定料液比为1∶20 g/mL,提取液pH为2.0,超声功率为250 W,提取温度为80 ℃,提取时间为30 min,研究酶解时间(30、50、70、90、110 min)对柚子皮中果胶得率的影响。
1.2.3.3 料液比的确定 选择最佳酶用量、酶解时间,固定提取液pH为2.0,超声功率为250 W,提取温度为80 ℃,提取时间为30 min,研究料液比(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35 g/mL)对柚子皮中果胶得率的影响。
1.2.3.4 提取液pH的确定 选择最佳酶用量、酶解时间及料液比,固定超声功率为250 W,提取温度为80 ℃,提取时间为30 min,研究提取液pH(1.0、1.5、2.0、2.5、3.0)对柚子皮中果胶得率的影响。
1.2.3.5 超声功率的确定 选择最佳酶用量、酶解时间、料液比和提取液pH,固定提取温度为80 ℃,提取时间为30 min,研究超声功率(150、200、250、300、350 W)对柚子皮中果胶得率的影响。
1.2.3.6 提取温度的确定 选择最佳酶用量、酶解时间、料液比、提取液pH和超声功率,固定提取时间为30 min,研究提取温度(70、75、80、85、90 ℃)对柚子皮中果胶得率的影响。
1.2.3.7 提取时间的确定 在上述最佳酶用量、酶解时间、料液比、提取液pH、超声功率和提取温度基础上,研究提取时间(10、20、30、40、50、60 min)对柚子皮中果胶得率的影响。
1.2.3.8 Plackett-Burman试验 以果胶得率为响应值,单因素实验为基础,选取酶用量、酶解时间、料液比、提取液pH、超声功率、提取温度和提取时间共7个因素的水平值,选用Plackett-Burman试验设计确定显著性影响因素,为进一步Box-Behnken试验奠定基础。试验设计因素及水平见表1。

表1 Plackett-Burman试验设计因素及水平表Table 1 Factors and levels of Plackett-Burman
1.2.3.9 响应面试验 在Plackett-Burman试验基础上,以酶用量、超声功率、提取温度和提取时间为自变量,以柚子皮中果胶得率为响应值,设计响应面试验,确定最佳果胶提取工艺。Box-Behnken试验设计见表2。

表2 Box-Behnken试验设计Table 2 Design of Box-Behnken test
1.2.4 果胶得率的测定 果胶的得率采用重量法[19]。按照下列公式计算:

1.3 数据处理
所有试验均重复3次,结果取平均值,运用Excel软件绘制趋势曲线图。采用JMP Trial 14软件进行Plackett-Burman试验设计及数据处理,用Design-Expert 7.0软件进行Box-Behnken试验设计及数据分析。
2 结果与分析
2.1 果胶提取单因素实验结果
2.1.1 酶用量的确定 由图1可知,当纤维素酶用量低于2.0%时,柚子皮中果胶得率随着酶用量的增加而增加,这可能是由于纤维素酶分解破坏了柚子皮细胞的细胞壁结构,使得柚子皮中的果胶更易溶出,从而提高了果胶得率[16,20]。当酶用量为2.0%时,果胶得率达最大,为21.67%。继续增大酶用量,果胶得率基本无变化,可能是由于反应底物已全部被结合[21],导致果胶得率不再增加。因此选择酶用量为2.0%。

图1 酶用量对果胶得率的影响Fig.1 Effect of enzyme dosage on the yield of pectin
2.1.2 酶解时间的确定 由图2可知,随着酶解时间延长,柚子皮中果胶得率呈现先增加后缓慢减少的趋势,当酶解时间为70 min时,果胶得率达最大值,可能是酶解时间达到70 min后,酶解基本完全,继续延长酶解时间,会造成部分果胶水解,使得果胶得率降低。因此选择酶解时间为70 min。
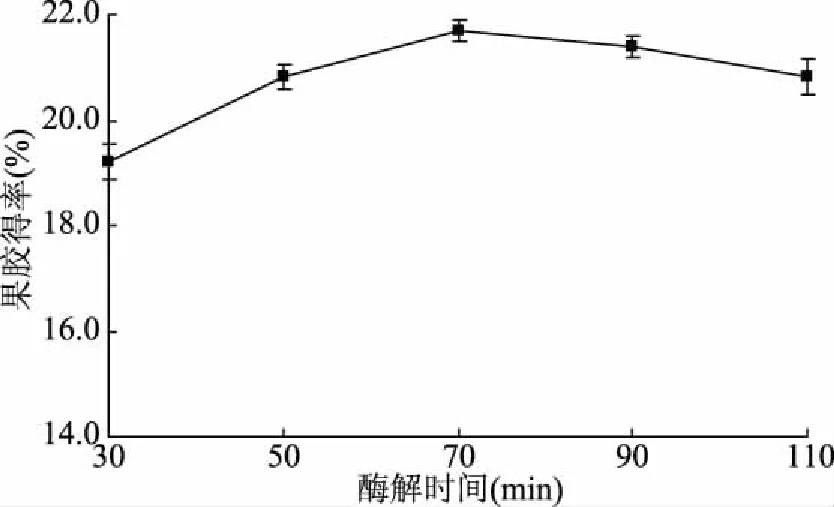
图2 酶解时间对果胶得率的影响Fig.2 Effect of enzymatic hydrolysis time on the yield of pectin
2.1.3 料液比的确定 由图3可知,柚子皮中果胶得率随着料液比的增大而增加,当料液比为1∶25 g/mL时,果胶得率达最大值。继续增大料液比,果胶得率反而下降,可能是提取液比例过大,溶液中的果胶浓度太低,不利于果胶的溶出。因此选择料液比为1∶25 g/mL。
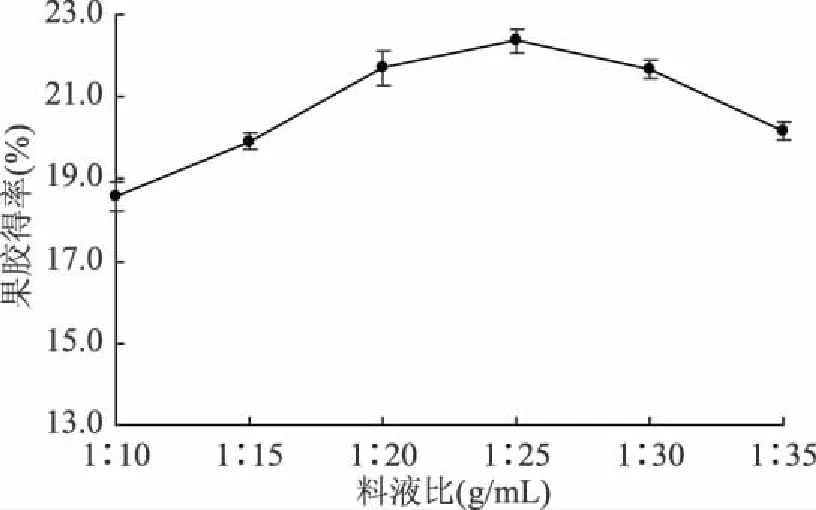
图3 料液比对果胶得率的影响Fig.3 Effect of material liquid ratio on the yield of pectin
2.1.4 提取液pH的确定 由图4可知,提取液pH在1.0~3.0范围内,柚子皮中果胶得率随着pH的增大,呈现先增加后减少的趋势。当pH为2.0时,果胶得率达最大值。可能是由于pH低于2.0时,酸性太强,导致果胶水解过度;pH高于2.0时,因为提取液酸性减弱,使得原果胶水解成果胶的程度随着提取液pH的升高而降低[22],从而导致果胶得率降低。因此选择提取液pH为2.0。

图4 pH对果胶得率的影响Fig.4 Effects of pH on the yield of pectin
2.1.5 超声功率的确定 由图5可知,当超声功率在150~300 W范围内,柚子皮中果胶得率随着超声功率的增大而增加,超声功率为300 W时,果胶得率达最大值,继续增大超声功率,果胶得率显著下降,可能是因为功率过高,超声波的空化作用过强,导致果胶水解过度,裂解成了多糖分子[23],从而使果胶得率下降。因此选择超声功率为300 W。

图5 超声功率对果胶得率的影响Fig.5 Effect of ultrasonic power on the yield of pectin
2.1.6 提取温度的确定 由图6可知,柚子皮中果胶的得率随超声提取温度的升高呈现先增加后减少的趋势,当酶解温度为80 ℃时,果胶得率达最大值,提取温度超过80 ℃后,会使果胶发生水解,导致得率降低。因此选择提取温度为80 ℃。

图6 提取温度对果胶得率的影响Fig.6 Effect of extraction temperature on the yield of pectin
2.1.7 提取时间的确定 由图7可知,提取时间对柚子皮中果胶得率的影响较大,随着提取时间的延长,果胶得率呈现先增加后减少的趋势,当提取时间为40 min时,果胶得率达最大值,为25.71%。提取时间低于40 min时,柚子皮中的原果胶未完全水解,使得果胶得率较低,但提取时间过长时,溶液中的果胶在高温酸性条件下会被降解[15],导致果胶得率下降。因此选择提取时间为40 min。

表5 偏回归系数及显著性检验Table 5 Partial regression coefficients and their significance test

图7 提取时间对果胶得率的影响Fig.7 Effect of extraction time on the yield of pectin
2.2 果胶提取Plackett-Burman试验结果
Plackett-Burman试验设计及响应值见表3,方差分析结果见表4,偏回归系数及显著性检验见表5。

表3 Plackett-Burman设计的各因素水平及响应值Table 3 Experimental design and response results of Plackett-Burman design

表4 Plackett-Burman 设计方差分析表Table 4 Analysis of variance of Plackett-Burman design
用JMP软件对表3中的实验数据进行回归分析和显著性检验。由表4可知,该模型显著(P<0.05)。由表5可知,因素X1(酶用量)、X5(超声功率)、X6(提取温度)和X7(提取时间)对柚子皮中果胶得率影响显著(P<0.05),所以选择X1、X5、X6、X7共4个因素进行响应面优化试验;因素X2(酶解时间)、X3(料液比)和X4(提取液pH)对柚子皮中果胶得率影响不显著,故在后续优化试验中因素X2、X3和X4的条件固定为:酶解时间70 min、料液比1∶25 g/mL、提取液pH2.0。
2.3 果胶提取响应面试验结果
2.3.1 响应面试验设计与结果分析 响应面试验结果见表6,用Design-Expert 7.0软件处理试验数据,经非线性回归的二次多项式拟合,得到回归模型为:Y=26.28+0.22A+0.23B-0.0075C+0.037D-0.27A2-0.27B2-0.12C2-0.14D2+0.050AB+0.067AC-0.040AD-0.0075BC+0.037BD+0.023CD,对回归模型进行方差分析,结果见表7。

表6 响应面试验设计及结果Table 6 Experimental design and results for response surface

表7 回归模型的方差分析Table 7 Variance analysis of regression model


图8 酶用量和提取温度交互作用的响应面图Fig.8 Response surface of interaction of enzyme dosage and extraction temperature
由图8可知,酶用量和提取温度两因素的交互作用对果胶得率的影响较大,得率随着酶用量的增加和提取温度的升高,均出现先增大后减小的趋势,响应面为凸型曲面,表明果胶得率存在极大值。
2.3.2 最优工艺条件及验证试验 根据模型预测得到的最佳柚子皮中果胶提取工艺条件为:酶用量1.71%、超声功率262.79 W、提取温度83.07 ℃,提取时间49.86 min,在此最佳条件下,果胶得率理论上可达27.89%。考虑实验的可操作性,修正最佳的工艺条件为:酶用量1.7%、超声功率260 W、提取温度83 ℃,提取时间50 min,在此条件下得出实际测得的果胶得率为27.01%±0.91%,与预测值的相对误差为0.88%,说明该模型拟合程度良好。
3 结论
通过优化酶法协同超声波辅助酸法提取柚子皮中果胶的工艺,得到最佳工艺条件为:酶用量1.7%、酶解时间70 min、料液比1∶25 g/mL、提取液pH2.0、超声功率260 W、提取温度83 ℃,提取时间50 min,在此条件下从柚子皮中提取果胶的得率为27.01%±0.91%。该方法结合了酶解提取法、超声波提取法和酸提取法三者的优点,有效地提高了果胶得率,从而提高了柚子皮的附加值。
