低温胁迫对台湾泥鳅抗氧化系统与能量代谢的影响
2020-03-31陶志英马本贺王海华李秋桃徐先栋
陶志英 马本贺 王海华 李秋桃 徐先栋
摘要:为了研究低温胁迫对台湾泥鳅抗氧化系统与能量代谢的影响,将台湾泥鳅在10℃水中暂养1周后分别放入3个温度组(4℃、10℃、16℃)各30尾,温度胁迫后于0h、6h、12h、24h和48h进行解剖采肝脏组织,检测氧化物歧化酶( SOD)、过氧化氢酶( CAT)、谷胱甘肽过氧化氢酶( GSH-PX)活力,丙二醛( MDA)含量,三磷酸腺苷(ATP)含量共5个指标。实验结果表明,不同温度组间,各指标差异显著。4℃和16℃组中SOD活性先降后升,10℃组中SOD活性较平稳。4℃组中CAT活性变化与SOD相似, 10℃和16℃组组中CAT活性先降后升趋稳。4℃组中GSH-PX活性变化与SOD、CAT保持一致,10℃和16℃组中GSH-PX活性先升后降,分别于12h、24h时达最大值。4℃组中MDA含量先升后降趋稳,10℃组中MDA含量上升趋稳。16℃组中中MDA含量呈波动性下升,至48h时达最低值。这些均说明低温下泥鳅机体受损伤严重,在秋冬季节应采取相应保护措施。4℃组中T-ATP含量先降后升,48h时高于0h时含量。10℃和16℃组中T-ATP含量呈上升趋势。说明台湾泥鳅的自我修复能力较强。
关键词:温度胁迫;台湾泥鳅;抗氧化指标
中图分类号:S965 文献标识码:A
Abstract: In order to study the effects of cold Stress on antioxidant defense and energy metabolism of Paramisgurnus dabryanus, the muddy shovel at 10℃, After holding for one week in the water, they were placed in three temperature groups (4℃, 10℃, 16℃) for 30 tails. After temperature stress, the liver tissues were dissected at 0 h, 6 h, 12 h, 24 h and 48 h to detect oxide disproportionation. Enzyme (SOD), catalase (CAT), glutathione catalase (GSH-PX) activity, malondialdehyde (MDA) content, adenosine triphosphate (ATP) content a total of five indicators. The experimental results show that the indicators vary significantly among different temperature groups. The SOD activity in the 4℃ and 16℃ groups decreased first and then increased, and the SOD activity in the 10℃ group was stable. The change of CAT activity in the 4℃ group was similar to that of SOD. The CAT activity in the group at 10°C and 16°C decreased first and then stabilized. The activity of GSH-PX in the 4°C group was consistent with SOD and CAT. The activity of GSH-PX in the 10℃ and 16℃ groups increased first and then decreased, reaching the maximum at 12 h and 24 h, respectively. The MDA content in the 4℃ group increased first and then decreased, and the MDA content in the 10℃ group increased. The MDA content in the 16℃ group fluctuated and rose to the lowest value at 48 h. All of these indicate that the muddy body is seriously damaged under low temperature, and corresponding protective measures should be taken in autumn and winter. The content of T-ATP in the 4℃ group decreased first and then increased, and was higher than that at 0 h at 48 h. The T-ATP content in the 10℃ and 16℃ groups showed an upward trend. It shows that Paramisgurnus dabryanus has a strong ability to repair itself.
Key words: temperature stress; Paramisgurnus dabryanus; antioxidant index
水溫是影响鱼类生理活动和行为特征的一个重要环境因子。水温的变化会导致鱼体的多种生理应激反应,使鱼类代谢加速和能量需求增加,同时伴随着活性氧自由基(reactive oxygen species,ROS) 的过量产生,使鱼类酶系统受到不同程度的破坏。甚至引起蛋白质、核酸和甾醇类物质的损伤以及细胞膜脂质的过氧化等。长期处于这种氧化压力下,将导致鱼体免疫防御能力和抗病力下降,影响鱼类的正常生长[1]。而动物体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)是机体清除自由基的关键酶类,而肝脏中丙二醛( MDA)的含量可反映机体内脂质过氧化的程度[2]。环境因子对鱼类抗氧化防护方面的研究已有较多研究,表明温度、盐度和环境污染物等均可对鱼体的抗氧化酶活力产生影响[3-5]。
台湾泥鳅(Paramisgurnus dabryanus)属于鲤形目、鳅科、花鳅亚科的代表种,是重要的淡水经济鱼类。台湾泥鳅因其肉质鲜美,并且富含多种蛋白质和维生素,广受青睐,被冠以“水中人参”之美誉。目前,对该泥鳅的繁殖、发育、生长等方面已有相关的研究,然而对其的温度耐受能力尤其是低温耐受还鲜见报道。我国南方在秋冬交替季节,常遇到气温忽高忽低的变化,在中部及北方地区又常遭遇寒潮等恶劣天气,水温骤变,导致鱼、虾等机体受损,抵抗力下降突发病害,甚至大面积死亡,对水产养殖业造成巨大损失。本实验以该泥鳅为研究对象,探讨其在温度骤变的情况下,不同时间段内肝脏中抗氧化酶活性、MDA含量及ATP的变化,为该泥鳅低温胁迫下机体调节机制的研究提供参考,并为泥鳅养殖提供可行性建议。
1 材料与方法
1.1 实验用鱼及条件
实验用鱼为当年繁育的台湾泥鳅,挑体长(13±2)㎝、体质量(20±2) g、体表无伤、体色正常的泥鳅用于实验。实验时间为2017年 12月底,采用随机分组法,在9个50 L的玻璃缸中随机放入30尾,个体间无显著差异(P<0.05),实验前暂养一周,暂养期间每天以人工配合饲料饱足投喂2次,投喂 40 min后清除残饵,水温为(10±1) ℃。
1.2 实验设计与取样
根据台湾泥鳅生物学特性,12℃~16℃正常摄食,10℃停止摄食,0℃开始出现死亡。因此本实验设置3个温度组(4℃、10℃、16℃),每个温度组各三个重复。实验正式开始前,通过换水将水温同步调节至设定温度,采用控温仪( 型号:ZNHW-Ⅲ,上海越从仪器厂生产) 控制水温,正式实验周期为48h,分别在第0h、6h、12h、24h和48h进行采样,对泥鳅进行解剖,取肝脏于-70℃超低温冰箱中保存。
1.3 指标检测
采用南京建成生物工程研究所的试剂盒测定肝脏中的超氧化物歧化酶(SOD)活力、过氧化氢酶 (CAT)活力、谷胱甘肽过氧化酶(GSH-Px)活力、丙二醛(MDA)含量。SOD采用黄嘌呤氧化酶法测定, SOD活力单位定义:在反应体系中 SOD抑制率达50%时所对应的酶量为一个SOD活力单位(U)。CAT活力采用比色法测定,CAT活力单位定义:每毫升血清(或每毫克组织)每秒分解1μmol双氧水的量为1个活力单位(U/mL)。GSH-Px活力检测采用比色法,GSH-Px酶活定义:每0.1 mL血清( 或每毫克组织) 在37℃反应5min,扣除非酶促反应,使反应体系中 GSH浓度降低1 μmol/L为一个酶活力单位(U/mL)。MDA采用比色法测定(mmol/mL)。采用Bradford 法测定组织匀浆上清液中总蛋白含量,ATP含量测定采用肌酸激酶(CK)法(U/g)。
1.4 数据统计与分析
实验结果用SPSS 13.0软件进行统计与分析。采用 ANOVA对实验结果进行方差分析,采用t检验,当P<0.05时为差异显著。所有数据以平均值±标准差(Mean ± SD) 表示。
2 结果与分析
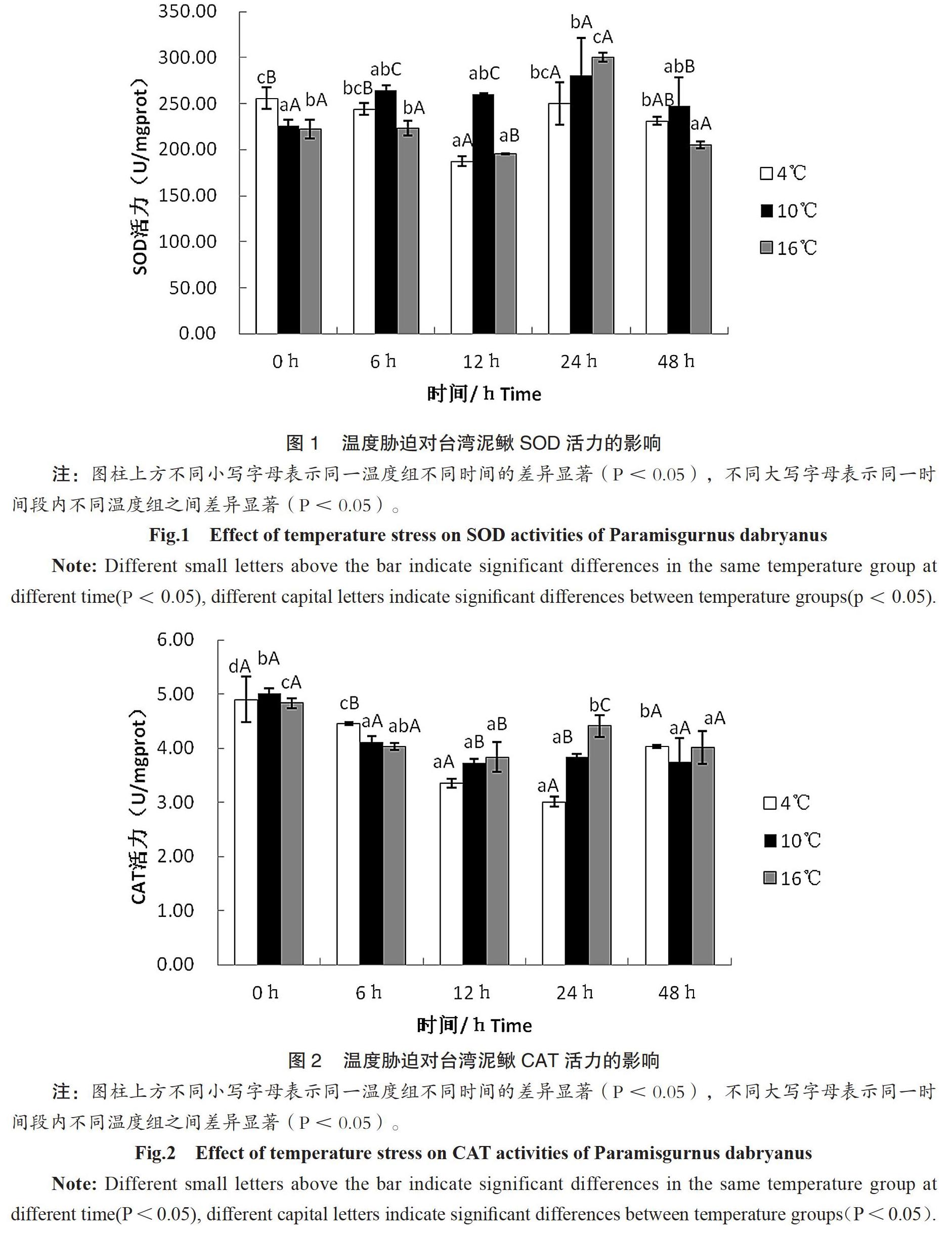
2.1 温度胁迫对台湾泥鳅SOD活力的影响
温度胁迫后台湾泥鳅SOD活性的变化见图1,结果表明,从不同时间来看,4℃和16℃组中SOD活性先降后升,在12h时达到最低值,随后SOD活性开始上升。说明温度骤变,泥鳅机体受到损伤,氧化能力下降。10℃组中SOD活性较稳定。说明经过实验前的暂养,泥鳅已经适应环境温度。当经过相同的时间处理后,不同温度组之间的SOD活性有显著差异性(P<0.05)。
2.2 温度胁迫对台湾泥鳅CAT活力的影响
温度胁迫后台湾泥鳅CAT活性变化见图2,结果表明,从不同时间来看,4℃组中CAT活性先降后升,在24h时达到最低值,随后CAT活性开始上升。10℃和16℃组中CAT活性先降至12h时后略升趋稳。当经过相同的时间处理后,不同温度组之间的CAT活性有显著差异性(P<0.05)。
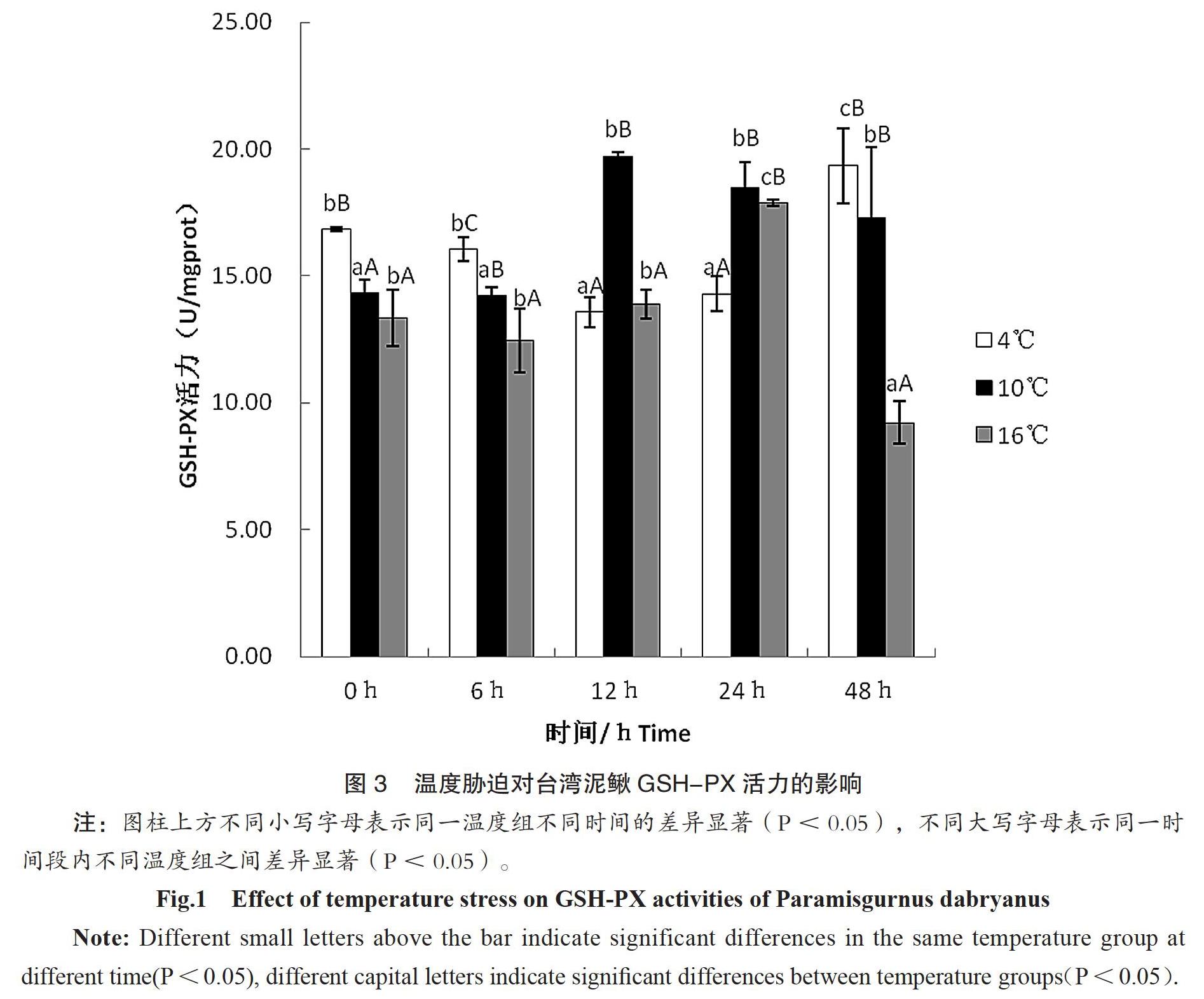
2.3 温度胁迫对台湾泥鳅GSH-PX活力的影响
温度胁迫后台湾泥鳅GSH-PX活性变化见图3,结果表明,从不同时间来看,4℃组中GSH-PX活性先降后升,在12h时达到最低值,随后GSH-PX活性开始上升,48h时达最大值。10℃和16℃组中GSH-PX活性先升后降,分别于12h、24h时达最大值。说明不同温度下机体损伤程度不同。当经过相同的时间处理后,不同温度组之间的GSH-PX活性有显著差异性(P<0.05)。
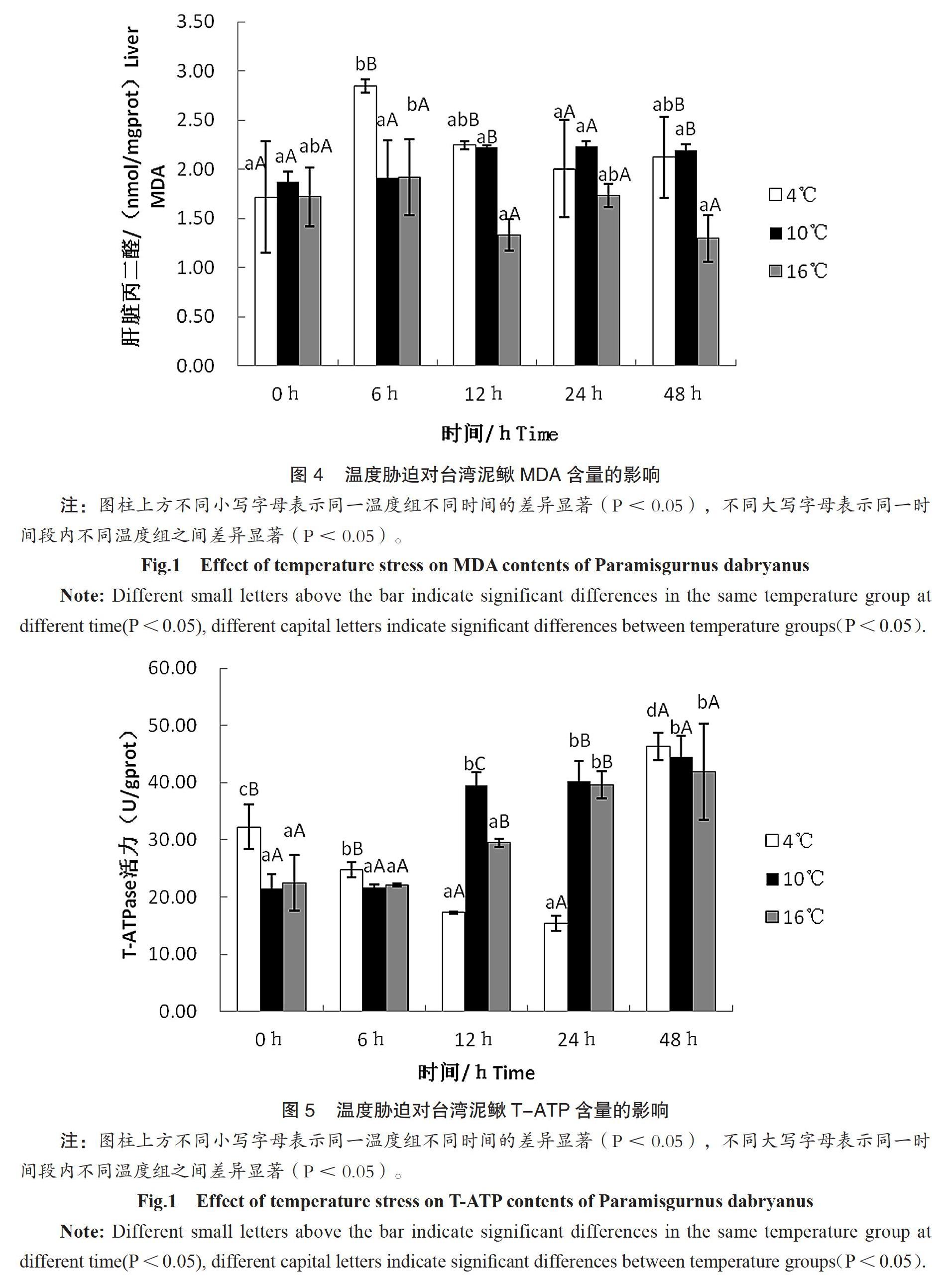
2.4 温度胁迫对台湾泥鳅MDA含量的影响
温度胁迫后台湾泥鳅MDA含量变化见图4,结果表明,从不同时间来看, 4℃组中MDA含量先升后降趋稳,10℃组中MDA含量渐渐上升趋稳。且两组MDA含量最后均高于0h时。16℃组中MDA含量呈升降波动性变化。说明水温聚变,使泥鳅集体受到损伤,且4℃组损伤最严重。当经过相同的时间处理后,不同温度组之间的MDA含量有显著差异性(P<0.05)。
2.5 温度胁迫对台湾泥鳅T-ATP含量的影响
温度胁迫后台湾泥鳅T-ATP含量变化见图5,结果表明,从不同时间来看,4℃组中T-ATP含量先降后升,在24h时达到最低值,随后T-ATP含量开始上升,48h时高于0h时含量。10℃和16℃组中T-ATP含量呈上升趋势,分别于12h、24h趋稳。最后三组T-ATP含量均高0h时。当经过相同的时间处理后,不同温度组之间的T-ATP含量有显著差异性(P<0.05)。
3 讨论
在水产养殖过程中,环境温度的变化极大的影响鱼类的生理代谢能力。温度胁迫会使鱼体产生应激反应,应激反应多与活性自由基的过量生成有关。一般情况下,鱼体正常代谢所产生的自由基处在动态平衡状态[6]。但当受到环境胁迫后,魚体内就会产生大量的自由基,过量的自由基会对机体的脂质、蛋白质和核酸产生一定的损伤。有研究表明,生物体具有通过调节抗氧化酶活性来清除过量自由基的能力。本研究中,温度降低显著改变了台湾泥鳅的抗氧化酶、ATP酶的活力。
SOD可以直接清除机体内多余的自由基,一般情况下,受到环境胁迫SOD活力显著增强,机体启动抗氧化防御系统来进行抗氧化;但机体损伤较为严重时,SOD短期难以恢复[7]。本实验中对台湾泥鳅进行温度组分配后随即采样,4℃组和16℃组均先降再升,可见温度对其产生了应激反应,急性变温使泥鳅机体损伤较严重;直至12h后才渐渐恢复,说明机体渐渐适应低温,氧化损伤随着恢复时间增加而下降。表明台湾泥鳅对环境温度变化较敏感,其自身调节能力较强,一段时间后酶活力恢复。
大量自由基在SOD作用下生成H2O2和氧分子,CAT将H2O2进一步氧化成水和氧气[8]。因此CAT的活性随SOD而变化。本实验中4℃组、16℃组和10℃组CAT的活性与SOD基本一致。
GSH-Px以谷胱甘肽为底物,GSH-Px与CAT在机体内协同作用清除H2O2和脂质过氧化物,将H2O2降解为水,将脂质过氧化物降解为醇类。4℃组中GSH-PX活性先降后升,变化趋势与CAT、SOD保持一致,进一步说明低温刺激使泥鳅机体受到严重损伤。而10℃和16℃组中GSH-PX活性先升后降,分别于12h、24h時达最大值。说明不同温度下泥鳅机体损伤程度不同,温度较高组启动了抗氧化酶系统对抗氧化应激。
MDA是细胞膜脂质过氧化作用的产物之一,它反映机体受氧化损伤的程度[9]。本实验4℃组先升后降,最终活性高于起始含量,说明低温使泥鳅机体受损伤严重,机体内产生大量的脂质过氧化物。若长期处在这种氧化压力下,将使泥鳅免疫防御能力和抗病力下降,诱发泥鳅发病,导致大规模死亡[10]。10℃组略有上升,说明10℃组较4℃组损伤较轻。16℃组呈波动下降趋势,说明该温度下泥鳅机体基本没有损伤。由此可见,秋冬交替季节,水温聚降对台湾泥鳅的损伤是严重的,应注意提前预防和采取相应保护措施。
ATP作为重要的能量分子在细胞的各种生理和病理过程中均发挥重要作用。温度做为重要的环境因子显著影响生物体新陈代谢速率,进而影响生物体内能量代谢[11]。4℃组中T-ATP含量先降后升,在24h时达到最低值,随后T-ATP含量开始上升,48h时高于0h时含量。推测机体受到低温胁迫后受损伤,肝脏自我调节适应低温后为维持机体生命需不断合成ATP抵御外界环境低温。进一步说也明台湾泥鳅对环境温度变化较敏感,但其自身调节能力也较强。10℃和16℃组中T-ATP含量呈上升趋势,分别于12h、24h趋稳。外界环境的刺激使机体产生应激,较高水温加速了机体内T-ATP的合成。
参考文献
[1] FILHO D W, TORRES M A, ZANIBONI-FILHO E, et al. Effect of different oxygen tensions on weight gain, feed conversion, and antioxidant status in piapara, Leporinus elongatus (Valenciennes, 1847)[J].Aquaculture,2005,244(1/4):349-357.
[2]孔祥会,王桂忠,李少菁. 低温驯化锯缘青蟹鳃抗氧化防护、ATPase及膜脂肪酸组成变化[J].水生生物学报,2007,31(1):59-66.
[3]彭婷,胡庭俊,林勇,等.低温胁迫对罗非鱼血液生化、免疫及抗氧化指标的影响[J].水产科学,2012,31(5):259-263.
[4]王妤,庄平,章龙珍,等. 盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响[J].水产科学,2011,35(1):66-73.
[5]孙淑红,焦传珍,刘小林,等. Cd(Ⅱ)对泥鳅抗氧化酶活性和脂质过氧化物的影响[J].大连水产学院学报,2009,24(1):52-56.
[6]徐颖,董文宾,代春吉. 自由基的清除[J].食品研究与开发,2005,26(3):10-13.
[7]周顺伍.动物生物化学[M].北京:中国农业出版社. 1999.
[8]李勇,孔令青,高洪,等. 自由基与疾病研究进展[J].动物医学进展,2008,29(4):85-88.
[9]王伟,姜志强,孟凡平,等. 急性温度胁迫对太平洋鳕仔稚鱼成活率、生理生化指标的影响[J].水产科学,2012,24(3):213-220.
[10]孙鹏,伊飞,彭士明,等. 盐度对条石鲷幼鱼肝脏抗氧化酶活力的影响[J].海洋渔业,2010,32(2):154-159.
[11]朱孟凯,姚翠鸾.温度胁迫对凡纳滨对虾肝胰腺氧代谢及能量代谢的影响[J]. 水产学报,2015,39(5):669-678.
