建兰种子萌发的影响因素研究
2020-03-27王思蕲曹小勇胡选萍秦公伟赵垚
王思蕲 曹小勇 胡选萍 秦公伟 赵垚

摘要:以建兰不同发育状态种子为材料,通过无菌播种的方法,研究种子成熟度(授粉后60d、90d、180d、270d、360d、480d的种子,下文授粉后天数用DAP表示),液体与固体培养方式以及植物生长调节剂6-BA,NAA等因素对种子萌发的影响。结果表明:DAP60种子未萌发,DAP90、DAP180、DAP270种子的萌发率高于DAP360、DAP480种子;液体培养基中种子萌发率为39.56%高于固体培养基萌发率23.47%;6-BA与NAA都可促进建兰种子萌发,且萌发率随着激素浓度增加而升高,种子在1/2MS+6-BA 2mg/L中萌发率达到96.27%,且萌发指数优于NAA及其它浓度6-BA。
关键词:建兰;种子成熟度;固液培养;6-BA;NAA
中图分类号:S-3 文献标识码:ADOI:10.19754/j.nyyjs.20200229007
建兰(Cymbidium ensifolium),又名四季兰,为兰科兰属多年地生草本植物,生于海拔600~1800m的山谷、疏林、灌丛或草丛中,广泛分布于东南亚和南亚各国。我国主要产地有浙江、福建、广东、海南等。叶片宽1cm左右,长40~60cm,形状如剑,花多葶长,花清香,花梗和花瓣多数为淡黄色,唇瓣上有暗点紫块,在我国有悠久的栽培历史[1,2]。
建兰单个蒴果内具有大量种子,和其它兰科植物相似其种子细小,无胚乳,种子发育缓慢,萌发率低[3-5]。目前,对建兰组织培养研究主要在茎尖与侧芽诱导原球茎[6-9]、根状茎增殖与分化[10-12]、花芽诱导[13]、遗传多样性分析[14,15] 等方面。同时,建兰不同种子成熟度与萌发率的关系未见报道。因此,本试验通过研究建兰种子成熟度、液体与固体培养方式、植物生长调节剂6-BA及NAA对萌发的影响,确定适合建兰种子萌发的培养基,以提高种子萌发率,为推进建兰离体培养的效率提供技术支持。
1材料和方法
1.1材料
建兰植株培养于陕西理工大学生物科学与工程学院实验准备室,2017年9月—2018年6月盛花期进行人工授粉,2019年1月8日首个果实开裂成熟,从授粉到果实成熟需要约480d。选取DAP60、DAP90、DAP180、DAP270、DAP360、DAP480的无菌种子用于不同成熟度种子萌发的培养,DAP360用于液体、固体培养基与不同浓度6-BA、NAA培养。
1.2培养方式与培养条件
采用液体、固体培养方式,以30mL的玻璃螺口顶空瓶为培养容器,每瓶内培养基约为10~15mL,每个处理重复3次,培养温度25±1℃,种子激素处理暗培养,其他处理光照强度1000~2000Lx,光照12h/d。
1.3试验方法
1.3.1建兰果实消毒
果实采收后,去除干枯花瓣,用毛笔粘上肥皂刷洗果皮,流水冲洗2h后移入超净工作台,用75%酒精浸泡30s,0.1%升汞消毒15min,无菌水清洗3次,在无菌培养皿中切去多余果柄、干枯合蕊柱后,切分果实,得到的种子作为实验材料。
1.3.2不同成熟度种子培养
以1/2MS液体培养基为萌发培养基。分别将不同发育时期的无菌种子均匀播种至培养基内150d后,统计各时期种子萌发(萌发为种子发育至下文B阶段)数量。
1.3.3液体、固体培养
将无菌种子均匀播种于1/2MS固体、液体培养基中360d后,统计萌发种子数量。固体培养基中添加7g/L琼脂,液体培养基不添加琼脂。每瓶种子数量约为70~200粒。
1.3.4不同浓度6-BA与NAA培养
将无菌种子均匀播种于以下7种液体培养基中:(A1):1/2MS(对照组); (A2):1/2MS+0.1mg/L 6-BA;(A3):1/2MS+1mg/L 6-BA;(A4):1/2MS+2mg/L 6-BA;(A5):1/2MS+0.1mg/L NAA;(A6):1/2MS+1mg/L NAA;(A7):1/2MS+2mg/L NAA。培养360d后,统计种子萌发数量。每瓶种子数量约为70~200粒。
1.4萌发指标计量
萌发率=B+C+D+EA+B+C+D+E×100%
萌发指数=10B+20C+30D+40EA+B+C+D+E×100%
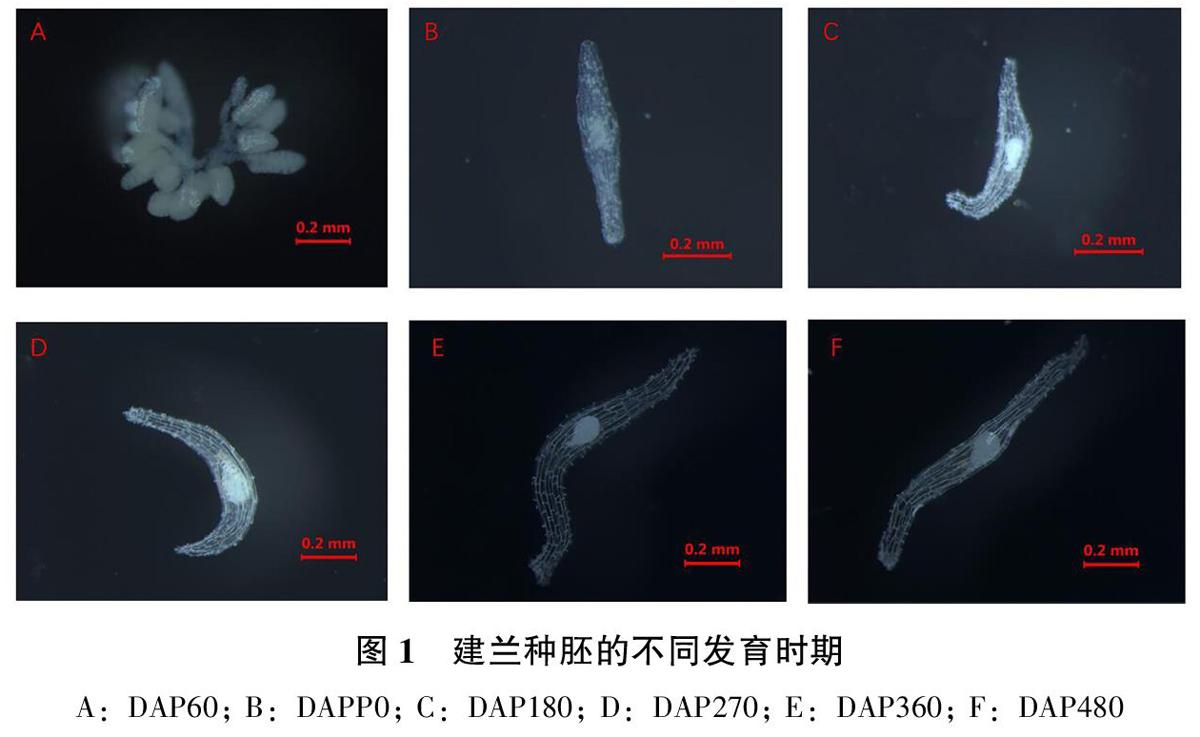
ABCDE分別表示建兰种子萌发过程5个阶段(未萌动、膨大、突破种皮、伸长、分叉)。
A:种胚未萌动,胚的长度小于0.19cm;
B:种胚膨大但未突破种皮,胚的长度0.19~0.23cm;
C:原球茎突破种皮,原球茎长度0.24~0.35cm;
D:根状茎大部分已突破种皮或与种皮分离,此阶段许多根状茎变成绿色,长度大于0.35cm;
E:一个根状茎上的分叉数量大于1。
通过对种子萌发各阶段数量统计,得到萌发指数。
1.5统计分析
采用Microsoft Excel 2007、SPSS19.0和Prism 5对试验结果进行统计学分析。
2结果与分析
2.1种子成熟度对萌发的影响
建兰种子的成熟度显著影响种子的萌发数量,成熟度低以及完全成熟的种子萌发数量均较低。DAP60的蒴果瘦小,其宽度与DAP90-480蒴果存在明显差异,解剖蒴果种子白色,细小,紧贴于胎座组织,在培养基上未萌发;DAP90种子白色,细小,可见发育较小的胚,在培养基上出现萌发;DAP180种子白色,伸长呈絮状,显微镜下可见明显胚体,在培养基上出现萌发;DAP270-480种子黄白色,粉状,均在培养基上出现萌发,蒴果的宽度随着生长时间的延长逐渐增加。DAP90、DAP180、DAP270种子萌发数量高于DAP60、DAP360、DAP480,说明建兰种子成熟度对种子萌发有较大影响。
DAP/d蒴果 Capsule重量/g宽度/cm特征种子特征萌发数量601.150.91深绿色,饱满白色,细小,紧贴于胎座组织/902.191.18深绿色,饱满白色,细小,紧贴于胎座组织++1802.181.26深绿色,饱满白色,絮状++2701.731.36深绿色,饱满黄白色,粉状++3603.421.90深绿色,饱满黄白色,粉状+4803.361.96尖端褐色,干枯开裂黄白色,粉状+注:因早期建兰种子细小并粘黏在一起,不能精确统计种子数量,所以无法得出具体的萌发率,用“/”代表无萌发,“+”代表萌发数量,“+”越多,萌发数量越多。
2.2液体、固体培养方式对建兰种子萌发的影响
液体、固体培养方式对建兰种子的萌发影响较大,液体培养方式种子的萌发率为39.56%,较固体培养萌发率23.47%更高。在液体培养基中种子充分接触水与营养物质,同时稀释了种子萌发抑制物,从而促进种子萌发[21]。因此在本试验中,液体培养基较固体培养基更能提高建兰种子的萌发率。
2.3不同浓度6-BA与NAA对建兰种子萌发的影响
不同浓度6-BA与NAA对建兰种子萌发率影响均有显著性差异。不添加任何外源植物生长调节剂时,种子也可萌发,萌发率为16.43%。添加不同浓度6-BA与NAA后,可明显提高种子的萌发率,随着6-BA与NAA浓度的增加,萌发率和萌发生长指数逐渐增加,在浓度为2mg/L时,种子的萌发率可分别达到96.27%、95.84%,极显著高于对照组,较对照组增加了486%、483%;种子的萌发指数可分别达到27.76、20.82,远高于对照组,较对照组增加了658%、469%,这说明2mg/L 6-BA与NAA都能显著提高种子萌发率,且种子在2mg/L 6-BA中萌发后的生长速度更优。因此,建兰种子适宜萌发的培养基为1/2MS+2mg/L 6-BA+25g/L蔗糖(暗培养)。
3讨论
成熟度是兰科植物种子萌发的影响因素之一,许多兰科植物种子完全成熟后种子的萌发率远低于未成熟种子。本实验研究表明,建兰种子不同发育阶段对其萌发有较大影响:DAP60种子过于细小、幼嫩,尚无萌发;DAP360及以后的种子萌发率低于DAP90、DAP180、DAP270种子,这说明建兰种子过于幼嫩或高度成熟均不利于种子萌发,此研究结果与大花杓兰(C. macranthum)、小叶兜兰(P. barbigerum)、C. reginae、黄花杓兰 (C. flavum)结果相似。相关研究发现,内源性脱落酸浓度随着种子成熟度的增加而增加,高浓度的脱落酸是阻碍种子萌发的主要因素,这可能是导致该现象的原因之一。Yamazaki and Miyoshi认为,在种子成熟过程中木质素等物质在胚胎周围的内珠被积累,对诱导成熟种子休眠具有重要作用。也有人认为,兰科植物种子在成熟过程中内种皮会变成一层“Carapace”的封闭结构,从而导致成熟种子的种皮渗透性差,种子萌发困难。因此,成熟种子内的抑制萌发物质,或种皮渗透性差,抑或是以上因素共同作用引起种子休眠,降低了成熟种子萌发率;过于幼嫩种子可能由于胚发育不完全,而未发生萌发。
虽然建兰种子在液体培养基中萌发率更高的结果与Zeng S、丁长春关于兜兰的研究结果一致,但液体培养方式不一定适合所有兰科植物种子。这可能是因为液体培养存在缺少氧气及长时间培养营养不足的问题。因此在液体培养的过程中可以减少液体培养的时间、定期加入营养液并及时将萌发的原球茎转接至固体培养基中,从而促进种子萌发及萌发后原球茎的健康生长。
参考文献
[1] 陈心启,吉占和.中国兰花全书[M].北京:中国林业出版社,1998:70-100.
[2]中国科学院中国植物志编辑委员会.中国植物志(第18卷)[M].北京:科学出版社,1999:213.
[3]田梅生,王伏雄,钱南芬,等.四季兰种子离体萌发及器官建成的研究[J].Journal of Integrative Plant Biology,1985(05):455-459,564.
[4]刘思思,陈娟,郭顺星.兰科植物种子萌发的研究进展[J].种子,2015,34(06):43-50.
[5]郭顺星,徐锦堂.兰科植物种子无菌萌发的研究[J].种子,1990(05):36-37,58.
[6]王熊,陈季楚,刘桂云,顾梅仙,包慈华.建兰和秋兰原球茎的发生及其无性系的建立[J].植物生理学报,1981(02):203-207.
[7]王熊,張菊野,连宏坤,龚颂福,金于荣.素心建兰无性繁殖系的建立及其开花[J].园艺学报,1988(03):205-208,218.
[8]傅向东,钱秀红,毛碧增,李德葆.几种理化因子对建兰原球茎生长分化的影响[J].浙江农业大学学报,1997(05):65-68.
[9]孙安慈,任玲,王伏雄.建兰根状茎增殖条件的研究[J].植物学通报,1989(03):147-150.
[10]毛碧增,林蔚红,钱秀红,傅向东,李德葆.影响建兰原球茎增殖的若干因素[J].浙江农业大学学报,1998(01):68-70.
[11]高丽,李洪林,杨波.基本培养基与生长调节剂组合对素心建兰根状茎增殖和芽分化的影响[J].亚热带植物科学,2007(04):13-15.
[12]刘翠华,蒙阳,王朝雯,张小燕,杨柏云.建兰组织培养及根状茎增殖的动力学[J].南昌大学学报(理科版),2012,36(03):264-267,272.
[13]贾勇炯,曹有龙,王水,唐琳,徐莺,陈放.彩心建兰花枝茎节离体培养的研究[J].四川大学学报(自然科学版),2000(01):94-97.
[14]白坚,胡旭,周淑婷,王慧中.47个建兰品种的SRAP遗传多样性分析[J].植物遗传资源学报,2012,13(03):376-380.
[15]胡薇,黄儒珠,潘晓华,李锦凤,孙端.建兰38个品种的RAPD分析[J].园艺学报,2008(02):289-294.
