鸢尾生香菌的分离鉴定及鸢尾酮的生物合成
2020-03-26南海珍徐志南
南海珍,黄 磊,蔡 谨,徐志南
(浙江大学生物质化工教育部重点实验室,浙江大学 化学工程与生物工程学院,浙江 杭州 310027)
1 前 言
1893年TIEMANN等[1]从鸢尾精油中分离出一种气味宜人的酮类化合物,将它命名为鸢尾酮(irone)。鸢尾酮具有柔和的甜香,香气清新纯正,因具有特殊的紫罗兰香味而被广泛用于化妆品、香水、烟草和食品等行业[2-4]。鸢尾酮为无色或淡黄色透明液体,分子式为 C14H22O,不溶于水,易溶于乙醇等有机溶剂。新鲜鸢尾根茎无鸢尾酮特征香气,一般需将生长3年后的鸢尾根茎在常温下贮存2~3年甚至更长时间,鸢尾酮的前体物质才能逐渐转化为鸢尾酮[5]。在陈化鸢尾根茎中鸢尾酮以α-鸢尾酮、β-鸢尾酮和γ-鸢尾酮3种异构体的形式存在,其中大部分为α-鸢尾酮和γ-鸢尾酮,β-鸢尾酮的含量较少[6]。α-鸢尾酮具有天然鸢尾凝脂的香味,香气淡雅,鸢尾精油中α-鸢尾酮含量越高其价格越高[6-7]。鸢尾植物中鸢尾酮的生物合成途径目前还不明晰,有报道推测鸢尾根茎中的某些三萜化合物(iridals)可能是鸢尾酮的前体物质,单环iridals开链末端的双键先经转甲基反应,随后环化形成鸢尾酮[4,8]。
从陈化的鸢尾根茎中直接提取是目前鸢尾酮的主要获取方法。鸢尾根茎陈化需要占用大量存储空间,长期保存容易出现霉变、虫蛀等问题,且根茎中鸢尾酮含量极少,植物提取法得率低,所得产品价格高昂,无法满足日益增长的市场需求[9-11]。化学合成鸢尾酮方法普遍存在途径冗长、收率低、生产成本高和生产过程污染较大等问题[12]。生物合成法具有条件温和、操作简单、绿色环保等优势。张玲琪等[13-15]尝试从陈化的香根鸢尾根状茎干片中分离得到两株能产香的枯草芽孢杆菌,但仅做了菌种鉴定的研究,随后又筛选出多株能产香的真菌,经鉴定为米根霉,但固体发酵所产净油成分中鸢尾酮只占 3.87%,且无具体鸢尾酮产量数据报道。目前鸢尾酮的生物合成研究尚处于实验室阶段,筛选所得菌株存在合成效率低和生产性能不稳定等问题。
本文选择浙江磐安种植的香料用鸢尾作为鸢尾酮合成菌的分离对象,从其陈化根茎中分离能产鸢尾酮的菌株,并对得到的菌株进行形态学和16S rDNA基因序列分析。通过培养条件优化和上罐发酵提高菌株利用新鲜鸢尾为底物合成鸢尾酮的能力,为建立微生物发酵新鲜鸢尾根茎快速生产鸢尾酮提供了一条新路径。
2 材料及方法
2.1 培养基
LB 培养基(g⋅L-1):Tryptone 10,Yeast Extract 5,NaCl 10,Agar 15~20。
PDA 培养基(g⋅L-1):Potato 200,Glucose 20,Agar 15~20。
复筛培养基(g⋅L-1):MS培养基[16],Glucose 10,鸢尾根粉30(晾干后粉碎过100目筛)。
碳源基础培养基(g⋅L-1):Yeast Extract 5,(NH4)2SO45,K2HPO41.5,KH2PO41,NaCl 1,MgSO4⋅7H2O 0.5,CaCl20.05,鸢尾根粉30。
氮源基础培养基(g⋅L-1):Glycerol 10,K2HPO41.5,KH2PO41,NaCl 1,MgSO4⋅7H2O 0.5,CaCl20.05,鸢尾根粉 30。
牛肉膏蛋白胨培养基(g⋅L-1): Beef Extract 3,Peptone 10,NaCl 1,鸢尾根粉30。
甘油混合培养基,简称甘油培养基(g⋅L-1):Glycerol 10,Peptone 10,K2HPO41.5,KH2PO41,NaCl 1,MgSO4⋅7H2O 0.5,CaCl20.05,鸢尾根粉 30。
发酵培养基(g⋅L-1):Glycerol 10,Peptone 10,K2HPO41.5,KH2PO41,NaCl 1,MgSO4⋅7H2O 0.5,CaCl2 0.05,鸢尾根粉5,以上培养基120 ℃灭菌20 min。
2.2 试剂
α-鸢尾酮标准品,99%纯度,瑞士奇华顿公司;色谱纯甲醇,美国Simga公司;新鲜和陈化3年的鸢尾植物根茎,浙江磐安天蓝香料厂;正己烷,美国Simga公司;其他化学试剂购自国药集团化学试剂有限公司。
2.3 仪器与设备
高效液相色谱仪(HPLC),Agilent1100,安捷伦科技公司;气相色谱质谱联用仪(GCMS),GCMS-QP2010SE,日本岛津;10 L发酵罐,上海保兴生物设备工程有限公司;紫外可见光分光光度计,上海精密科学仪器有限公司;高温灭菌锅,YXQ-LWS-SH,上海博讯实业有限公司;低温离心机,Thermo Scientific公司。
2.4 菌种的筛选
将陈化2~3年的鸢尾根茎切成5 mm×5 mm大小的方块,75%乙醇消毒5 min,无菌水洗涤后置于LB、PDA固体培养基上30 ℃培养。待切口边缘长出菌落时,用平板划线法纯化获取单菌落。挑取菌落至复筛培养基,30 ℃、180 r⋅min-1条件下培养72 h后HPLC检测细胞中鸢尾酮的含量。获得产鸢尾酮的菌株再次进行摇瓶发酵验证并作GCMS定性分析。
2.5 鸢尾生香菌的鉴定
将筛选获得的菌株接种至LB固体培养基,培养24 h后进行菌落形态观察。提取目标菌株基因组,用细菌通用引物27F,1492R进行16S rDNA 扩增,引物基因序列如下:
27F:5'- AGAGTTTGATCCTGGCTCA -3' ;1492R:5'- GGTTACCTTGTTACGACTT -3'。测序后用 BLAST(http: //www.ncbi.nlm.nih.gov) 程序与NCBI数据库中序列进行比对分析,利用MEGA7.0软件构建系统发育树。
2.6 发酵条件优化
将保存的菌种平板划线活化,挑单菌落接入装有50 mL LB培养基的250 mL摇瓶中,28 ℃、200 r⋅min-1培养 24 h,接种 1% 的种子液进行液体发酵,采用单因素实验的方法优化发酵条件,设置不同的转速、温度、时间和根粉添加量,发酵结束后取样检测OD值(option density,OD)及鸢尾酮的含量。
2.7 10 L发酵罐分批培养
将保存的菌种划线活化,挑取单菌落接入装有300 mL LB培养基的1 000 mL摇瓶中,28 ℃、200 r⋅min-1培养24 h作为发酵种子液。采用分批发酵的模式在10 L发酵罐中进行发酵(装液量6 L),28 ℃,搅拌转速200~400 r⋅min-1,通气量3 L⋅min-1,利用氨水和盐酸控制pH为7.0,发酵36 h,每3 h取样,通过HPLC检测样品中的鸢尾酮的含量。
2.8 产物提取及分析
发酵液离心 (4 ℃、1 000 r⋅min-1、5 min)去除培养基中的根粉。收集的细胞和培养基混合液再次离心(4 ℃、8 000 r⋅min-1、5 min),收集细胞沉淀并用蒸馏水洗涤两遍。用正己烷重悬细胞,细胞悬液体积分数为φB=1:1,30 ℃,200 r⋅min-1条件下萃取1 h,萃取液进行HPLC和GCMS分析。
HPLC条件:色谱柱为Agillent SB-C18反向色谱柱(5 μm×4.6 mm×250 mm),流动相75%甲醇,流速1 mL⋅min-1,柱温为25 ℃,吸收波长为230 nm,进样量为10 μL。
GCMS条件:毛细管气相色谱柱SH-Rxi-5 Sil MS柱 ( 0.25 mm × 30 m ×0.25 μm),载气氦气,流速50 mL⋅min-1,进样口温度250 ℃,不分流,程序升温过程:初温50 ℃,保留1 min,终温220 ℃,保留5 min,升温速率5 ℃⋅min-1。电子轰击源EI,电离能量70 EV,离子源温度200 ℃,质量扫描范围为40~400,1 μL进样量。GCMS所获得质谱信息与NIST数据库的比较分析后,确认其中的化学成分。
2.9 鸢尾酮标准曲线的建立
将α-鸢尾酮标准品用正己烷稀释成一系列浓度后进样,绘制顺式α-鸢尾酮标准曲线如图1所示。经过线性拟合所得的回归方程为Y=26 164.84X-38.45,其线性相关系数为0.998,因此在0.01~0.10 mg⋅mL-1具有良好线性。
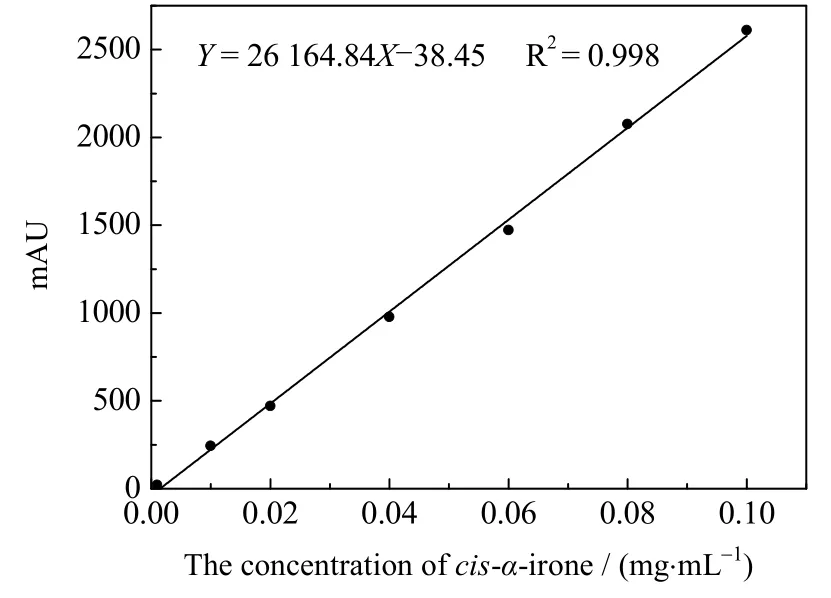
图1 顺式α-鸢尾酮标准曲线图Fig.1 Standard curve of cis-α-irone standard
3 实验结果和讨论
3.1 鸢尾生香菌的筛选
α-鸢尾酮标准品液相色谱结果如图2所示,峰 1的保留时间为 17.516 min,峰 2的保留时间为19.077 min。核磁共振氢谱结果显示峰1为反式α-鸢尾酮,峰2为顺式α-鸢尾酮,表明此α-鸢尾酮标准品中存在顺式和反式2种异构体。

图2 α-鸢尾酮标准品液相色谱图Fig.2 HPLC chromatogram of α-irone standard
从陈化鸢尾根茎中初筛分离得到15株细菌和8株真菌。复筛经HPLC检测获得一株产顺式α-鸢尾酮的细菌,发酵72 h后细胞提取物和加入内标样品经液相色谱分析(见图3),结果显示细胞提取物中峰3和α-鸢尾酮标准品中顺式α-鸢尾酮(峰2)的保留时间非常接近。进一步将细胞提取物做GCMS分析,鸢尾酮分子量为206.42,峰3对应物质经过质谱分析出现分子量206的响应值,质谱信息与NIST数据库的比较后,确认该物质为α-鸢尾酮(见图4)。图中,m/z为质量电荷比。
3.2 菌种鉴定
将筛选获得的菌株接种至LB培养基,培养24 h后,观察其菌落呈圆形,表面及边缘粗糙,呈乳白色,蜡状,菌株革兰氏染色结果表明其为革兰氏阳性菌(见图5)。

图3 细胞提取物液相色谱图Fig.3 HPLC chromatogram of cell extracts
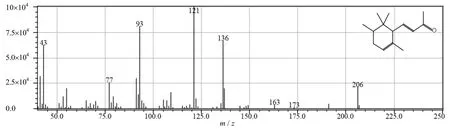
图4 细菌发酵样品GCMS图Fig.4 Gas chromatography-mass spectrometry curve of bacterial fermentation materials
扩增所得菌株16S rDNA的长度为1 454 bp,经BLAST程序与NCBI数据库中数据比对,显示该菌株与简单芽孢杆菌(Bacillus simplex strain)菌株的同源性高达99%,将其命名为 YWT-5。利用 MEGA 7.0软件按Neighbor-Joining法构建系统发育树,YWT-5菌株与登录号为KY312780的Bacillus simplex strain GT38的亲缘关系最近,处于系统发育树的同一分枝(见图6),因此鉴定该菌为简单芽孢杆菌。
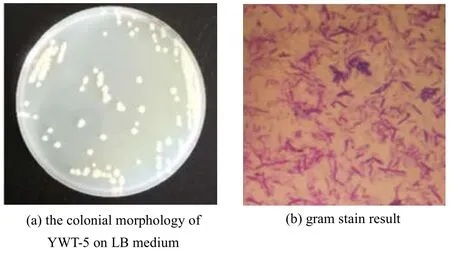
图5 YWT-5菌株的形态特征Fig.5 Morphological features of the YWT-5 strain
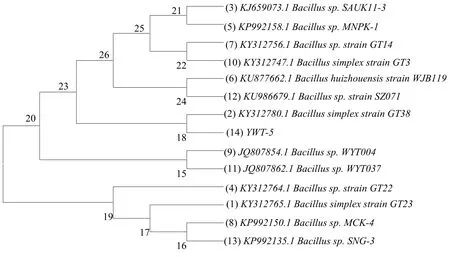
图6 基于16S rDNA 基因序列构建的YWT-5菌株系统发育树Fig.6 Phylogentic tree based on 16S rDNA gene sequences of the YWT-5 strain
3.3 碳氮源对鸢尾酮产量的影响
发酵过程中培养基中的营养成分会影响菌株的生长和产物的合成。在碳源基础培养基中分别添 1%的葡萄糖、蔗糖、淀粉、甘油,在氮源源基础培养基中分别添加1%的酵母提取物、牛肉膏、蛋白胨、硫酸铵,考察各种碳氮源对产物合成的影响作用。培养72 h后测定发酵液中顺式α-鸢尾酮的产量,如表1所示,所检测的各种碳源和氮源对顺式α-鸢尾酮合成的影响差别不大,产量均在50 mg⋅kg-1左右。在后续发酵条件优化实验中,选取10 g⋅L-1甘油和10 g⋅L-1蛋白胨分别作为培养基的碳氮源。

表1 不同碳源、氮源对顺式α-鸢尾酮产量的影响Table 1 Effects of different carbon and nitrogen sources on the yields of cis-α-irone mg⋅kg-1
3.4 摇床转速对鸢尾酮产量的影响
在不同转速条件下,顺式α-鸢尾酮的产量如图7所示,当摇床转速为160~220 r⋅min-1时,随着转速增大,YWT-5菌株发酵液中顺式α-鸢尾酮的产量呈现先上升后下降的趋势,在200 r⋅min-1时顺式α-鸢尾酮含量最高,可达到56.02 mg⋅kg-1。提升转速有利于提高培养基中的溶氧和物质交换效率,但细胞也容易在高转速条件下被剪切力所破坏,当转速达到220 r⋅min-1时顺式α-鸢尾酮产量有所下降,只有46.66 mg⋅kg-1。因此后续实验中选择200 r⋅min-1作为YWT-5菌株摇瓶产顺式α-鸢尾酮发酵的摇床转速。
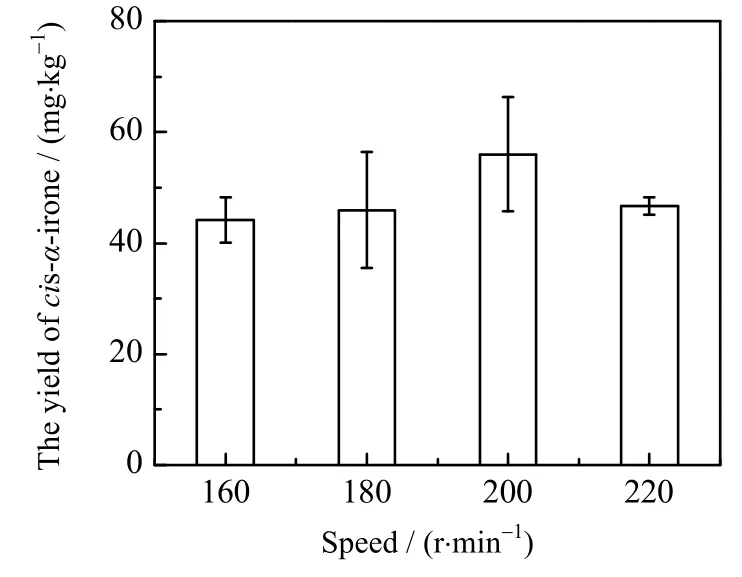
图7 不同摇床转速下顺式α-鸢尾酮的产量Fig.7 Yields of cis-α-irone under different rotating speeds
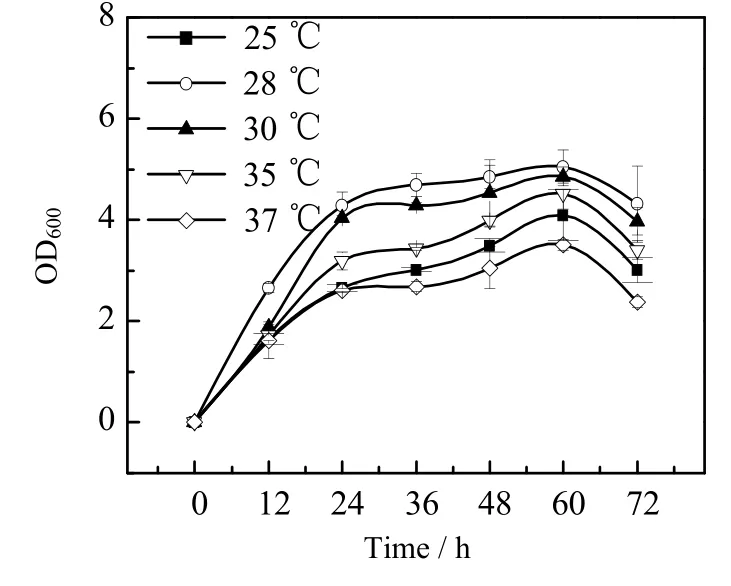
图8 不同温度下菌株的生长曲线Fig.8 Growth profiles of the strain under different temperatures
3.5 发酵温度对YWT-5菌株的生长及产物产量的影响
发酵温度会直接影响着菌体内多种代谢酶的活性,从而影响菌体的生长及代谢产物的合成[16],采用单因素实验考察了发酵温度对菌体生长及产物积累的影响。不同温度下YWT-5菌株的生长曲线见图8,较低的温度不利于菌体的生长,28 ℃下细菌OD值相对较高,最大值可达到5.05,随着温度进一步升高,菌体生长速度逐渐降低。不同发酵温度条件下,顺式α-鸢尾酮的产量如图9所示,和菌体生长情况规律相似,在28 ℃下顺式α-鸢尾酮产量相对较高。因此选择28 ℃作为YWT-5菌株生长的发酵温度,此条件下顺式α-鸢尾酮产量可达到63.73 mg⋅kg-1。
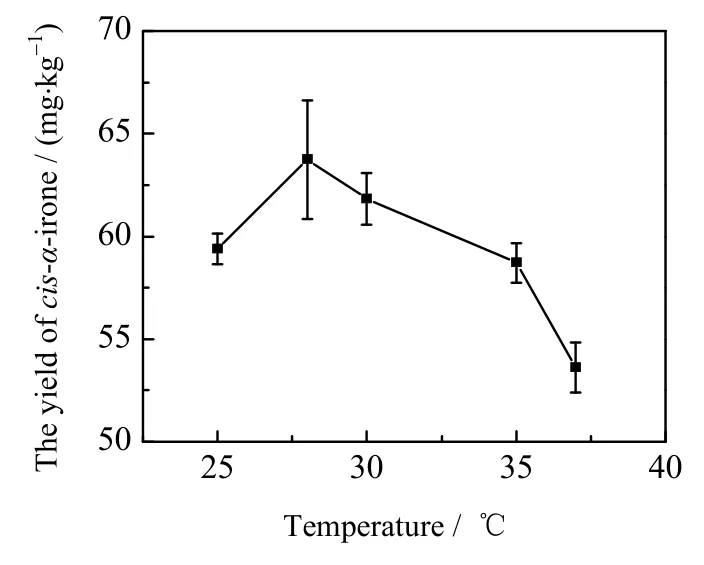
图9 不同温度条件下顺式α-鸢尾酮的产量Fig.9 Yields of cis-α-irone under different temperatures

图10 不同时间菌体生长曲线及顺式α-鸢尾酮的产量Fig.10 Growth curves of the strain and yields of cis-α-irone under different temperatures
3.6 发酵时间对鸢尾酮产量的影响
发酵过程中随着菌体的生长鸢尾酮不断合成,发酵时间太短产物积累量少,而过长的发酵时间会导致菌体衰老甚至死亡。发酵时间对YWT-5菌株的生长和产物合成的影响如图10所示,在0~24 h内细菌快速生长,36 h后菌体生长进入稳定期,细菌生长放缓,OD在60 h时达到最大值5.07,随后菌体进入衰退期OD值下降。在0~24 h内菌体密度快速增长时,顺式α-鸢尾酮含量也迅速提高,24 h时顺式α-鸢尾酮产量最高可达81.90 mg⋅kg-1,发酵24 h后虽然菌体OD值还在缓慢增加,但菌体中顺式α-鸢尾酮的含量保持稳定并逐渐缓慢降低。可能是因为摇瓶发酵中菌体进入稳定期后顺式α-鸢尾酮的合成能力下降,且部分产品被菌体消耗或发生了降解。
3.7 根粉添加量对鸢尾酮产量的影响
在发酵过程中底物的添加量对发酵结果有重要的影响,新鲜鸢尾根茎中虽没有鸢尾酮,但含有鸢尾酮的前体物质iridals[5]。本实验以新鲜鸢尾根粉作为底物进行发酵,产物产量随着根粉添加量呈现出先增加后稳定的趋势(见图11)。当添加量从3提高到20 g⋅L-1时,顺式α-鸢尾酮的产量从1.49提高到1.93 mg⋅L-1,但产量的增加和根粉添加量不成正比关系,可见发酵中根粉添加已相对过量。特别是当根粉添加量在30~40 g⋅L-1时,顺式α-鸢尾酮产量基本保持不变。在添加5 g⋅L-1的根粉时,摇瓶中顺式α-鸢尾酮产量为1.64 mg⋅L-1,相当于每千克新鲜鸢尾根粉可产315.95 mg顺式α-鸢尾酮。
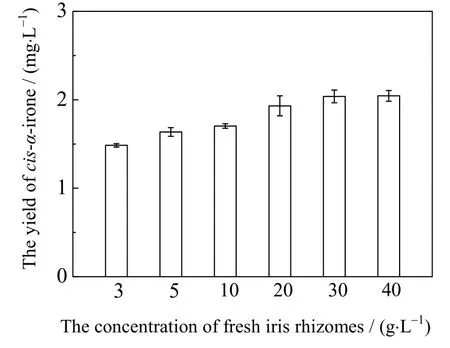
图11 不同根粉浓度下顺式α-鸢尾酮的产量Fig.11 Yields of cis-α-irone under different iris rhizomes concentrations
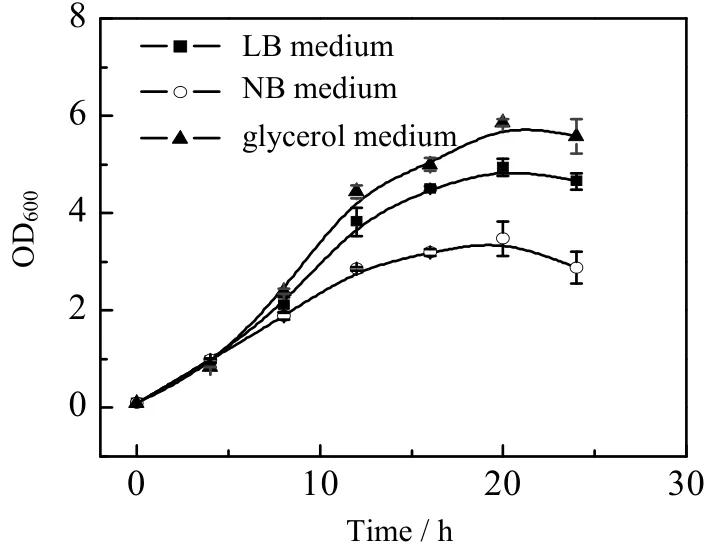
图12 不同培养基中菌株的生长曲线Fig.12 Growth profiles of the strain in different media
3.8 发酵罐放大培养
首先考察了LB、牛肉膏蛋白胨培养基和甘油混合培养基中菌株的生长和鸢尾酮的合成情况,菌株生长曲线如图12所示,牛肉膏蛋白胨培养基中菌体生长较缓慢,最大OD值只有3.47,而菌株在甘油培养基中生长情况良好,能获得较高的OD值,20 h左右菌体OD值达到6.26。发酵24 h时,甘油培养基中的顺式α-鸢尾酮产量也相对较高,可达到93.32 mg⋅kg-1(见图13),因此选择甘油培养基作为上罐的发酵培养基。

图13 不同培养基中顺式α-鸢尾酮的产量Fig.13 Yields of cis-α-irone in different media

图14 菌体生长曲线及顺式α-鸢尾酮的产量Fig.14 Growth curves of the strain and yields of cis-α-irone
利用上罐发酵改善菌体培养环境,通过提高菌体培养密度解决底物过量问题,从而提高鸢尾酮的产量。在10 L发酵罐中进行分批发酵,发酵过程中菌体的生长曲线及鸢尾酮产量变化如图14所示。当6 h之后,菌体生物量显著增加,进入对数生长期,发酵18 h时OD达到最大值25.67,18 h后菌体量缓慢降低。发酵过程中顺式α-鸢尾酮的产量呈现出先上升后缓慢降低的趋势,0~9 h产量缓慢增加,9~15 h菌体对数生长期内顺式α-鸢尾酮的产量增加迅速,15~18 h产量保持相对稳定。18 h后随着菌体生长进入稳定期直至衰退期,顺式α-鸢尾酮产量也缓慢降低。发酵过程中根粉添加量为5 g⋅L-1,发酵18 h时顺式α-鸢尾酮产量最高,可达到1 037.65 mg⋅kg-1,是相同根粉添加量时摇瓶发酵产量(315.95 mg⋅kg-1)的3.28倍。
4 结 论
从鸢尾根茎中筛选到一株产香细菌,通过细菌16S rDNA基因序列分析确定为简单芽孢杆菌(Bacillus simplex strain)。该菌株可以发酵新鲜鸢尾根粉合成顺式α-鸢尾酮,查阅文献,这是简单芽孢杆菌可用于顺式α-鸢尾酮合成的首次报道。发酵条件优化结果显示,当添加5 g⋅L-1的新鲜根粉时,在28 ℃、200 r⋅min-1条件下,发酵24 h顺式α-鸢尾酮摇瓶产量达到315.95 mg⋅kg-1。采用分批发酵模式,在10 L发酵罐中发酵18 h后顺式α-鸢尾酮产量可达1 037.65 mg⋅kg-1。本研究选用了浙江种植的香料用鸢尾,陈化2~3年后的根茎中总鸢尾酮含量约为300 mg⋅kg-1,其中顺式α-鸢尾酮含量为169.02 mg⋅kg-1。相对于传统的陈化提取工艺,YWT-5菌株利用新鲜根粉发酵生产鸢尾酮,不仅使生产周期由2~3年缩短至1 d,而且α-鸢尾酮的产量大为提高。本工作极大缩短了鸢尾酮的生产时间,降低了生产成本,同时分离得到的产香菌株也为后续解析鸢尾酮生物合成途径的相关研究提供了物质基础。
