化学平衡教学“静态模型”思维构建及其应用
2020-03-20慈夫玲夏振洋陈瑞蛟
慈夫玲 夏振洋 陈瑞蛟
(1.山东省济宁市海达行知学校 山东济宁 272100;2.重庆市彭水县教师进修学校 重庆彭水 409600;3.山东省济宁医学院 山东济宁 272067)
一、问题的背景及提出
中学化学教学中存在很多常用模型,如假想建模、虚拟建模、动态建模等。有学者提出,建模过程所需能力为四阶段八步骤,分别为:1.模型发展阶段,含模型选择和模型建立;2.模型精致阶段,含模型效化和模型分析;3.模型转移阶段,含模型应用和模型调度;4.模型重建阶段,含模型修正和模型转换。
2018年高考化学新课标卷考试说明[1]中提出:
(6)化学反应速率和化学平衡
⑤理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。
⑥了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
如何让学生快速、准确地理解这个难点呢?有不少老师先用化学平衡的实验佐证“条件改变影响化学平衡的移动方向”这一结论,再比较化学平衡常数K与浓度商(Qc)的大小,然后进行理论剖析。这在教学过程中不失为一个较好的方法。但在条件发生变化的过程中,学生同时分析反应物和生成物的速率变化,容易出问题。因为在动态的体系中动态建模,自然容易出现错误。这些教学难点可否进行建模处理?笔者做了静态建模尝试。
二、利用静态模型解决化学平衡问题
(一)课堂教学案例:《化学反应原理》[2]第二章第二节
教师:在化学平衡的影响条件中,课本实验2-5通过现象的变化佐证了增减生成物C(H+)的变化会使平衡方向发生改变,现象也比较明显。化学平衡为什么发生移动呢?
教师:逆反应速率加快,正反应速率也在加快啊,平衡为什么就向逆反应方向移动呢?
学生:这个……
设计意图:有不少学生在学习平衡条件的影响因素时,不能从本质上理解平衡移动的原因。表现为化学平衡移动是由于浓度、温度、压强的变化使可逆反应从一种平衡状态变为另一平衡状态的过程。平衡移动的实质是因为条件的变化打破了正反应、逆反应速率相等的关系:υ(正)≠υ(逆)。在外界条件改变的瞬间,V反、V生会发生怎样的变化?增大C(H+),会使逆反应速率加快,正反应速率不变,V反>V生,因此,平衡逆向移动。
(二)静态模型平衡理论
根据任意条件的改变,分析改变条件的瞬间V反、V生发生的变化,即:在外界条件发生改变时,静态分析由条件变化引起各标量变化,构建出如表1所示理论。对可逆反应:

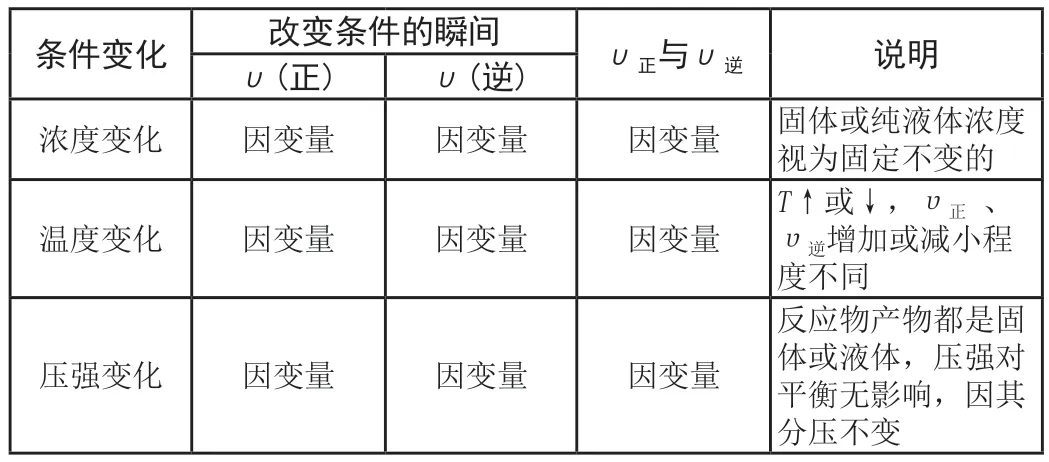
表1 静态模型平衡理论框架
(三)静态模型平衡理论的应用
1.由一个变量推导多个变量
例1 在密闭容器中,反应xA(g)+yB(g)zC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变,将密闭容器的容积增加一倍,当达到新的平衡时,测得A的浓度为0.3mol/L,则下列叙述中正确的是( )。
A.平衡向正反应方向运动 B.x+y>z
C.V(c)%增大 D.物质B的转化率增大
解析:此题中重要的信息素是“保持温度不变,将密闭容器的容积增加一倍”,在静态模型中(见图1),A气体的浓度应为0.25mol/L,而实际上为0.3mol/L,则说明平衡逆向移动。则答案选B。
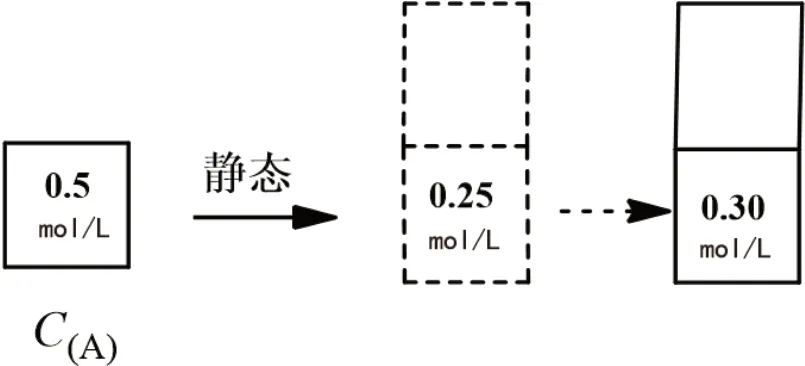
图1
2.容器问题
例2 一定温度下,在一容积固定的密闭容器中,建立了下列平衡:恒温下,再向容器通入一定量NO2,重新建立平衡后,容器中N2O4的体积分数( )。
A.减少 B.增大 C.不变 D.无法判断变化情况
解析:此题中首先要想到“再向容器通入一定量NO2”中的NO2不是单一的NO2,而是已经达到与前者一样的平衡体系,现在是将两个平衡体系压缩在一个容器中,借助静态模型分析。若压缩的瞬间,平衡不移动,则容器中N2O4的体积分数不变,而实际上是体积减小,V生>V反。因此,平衡正向移动,容器中N2O4的体积分数增大(见图2)。若保持温度不变,将密闭容器改为恒压条件下体积可变容器(见图3),则N2O4的体积分数不变。图2和图3均为等效平衡理论中常见的两种情况。
三、应用静态模型思维的注意事项
静态模型适用于气相反应,也适用于液相中某成分的浓度判断,依据是客观条件的变化导致V反≠V生,从而引起平衡的移动,最后形成新的化学平衡移动。
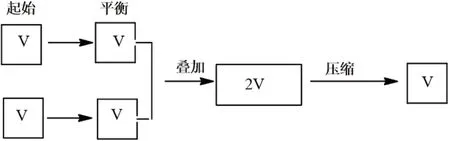
图2
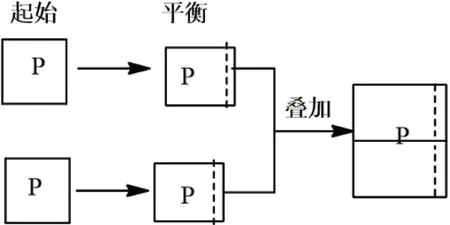
图3
例3 判断下列溶液中离子浓度问题的正误。
A.0.2mol/L与0.1mol/L醋酸中C(H+)之比为2:1
B.甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,甲中的C(OH-)为乙中C(OH-)的10倍
C.对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释10倍后,两溶液的pH均增大
D.如果取0.2mol/L HX溶液与0.1mol/L NaOH溶液等体积混合,测得混合溶液的pH>7,则说明HX的电离程度 NaX的水解程度(填>、<或=)
解析:
A选项,0.2mol/L醋酸与0.1mol/L醋酸,从浓度上看,前者的浓度是后者是两倍,将前者浓度稀释一倍后就变成0.1mol/L醋酸,静态处理分析:前者稀释的过程中若平衡不移动,则C(H+)之比为2:1,而实际是平衡发生移动,导致C(H+)之比大于2:1。
B、C选项正确。
D选项,0.2mol/L HX溶液与0.1mol/L NaOH溶液等体积混合后溶液成分变成等物质量的NaX与HX混合溶液,对于等物质量的混合溶液静态处理分析:若酸电离程度大,则溶液显酸性;若盐的水解程度大,则溶液显碱性。实际情况是pH>7,说明HX的电离程度小于NaX的水解程度,故填<。
四、结束语
静态模型的构建是针对化学平衡理论的应用做出的一种有效的静态模型化处理,是将复杂的化学问题、实际问题的一些次要细节及非本质的内容舍去,通过建模简化和理想化处理,即借符号、线条、图形等将实际问题概念化、符号化,最后用数学工具求解。化学平衡问题也可以将条件改变产生的不同变量静态化建模处理,凸显出几个标量,并通过模型求解,最后判定平衡移动的综合效果。
