例析高考化学实验中的温度控制
2020-03-17李大艳
李大艳
(浙江省绍兴市鲁迅中学 312050)
化学是一门以实验为基础的学科,化学实验题也成为高考必考题型,实验过程中的条件的控制,对实验成败、产品的产量、质量、安全生产及节约能源等方面有着重要的意义,也备受命卷教师青睐,但却让很多学生头疼,得分率始终居低难高,本文以条件控制的重要一环——温度的控制为主体,结合历年高考真题,总结归纳了三大角度来分析实验中的温度控制,以期考生能举一反三,提高答题能力.
一、控制温度以减少副反应的发生
1.控制温度防止原料或产品受热分解
例1(2019年江苏)实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:

废渣浸取在如图所示的装置中进行.控制反应温度在60~70 ℃,搅拌,反应3h.温度过高将会导致CaSO4的转化率下降,其原因是____.
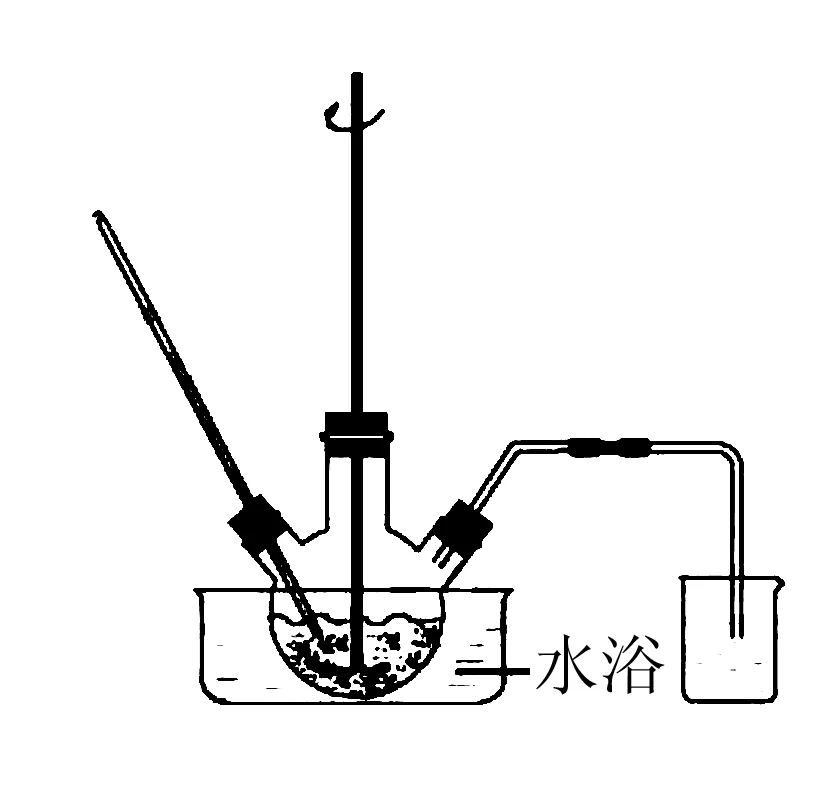

答案温度过高,(NH4)2CO3分解
特别提醒当原料或产品中存在受热易分解的物质时,温控时温度往往不易过高.常见的受热易分解的物质有双氧水(在30℃以下时比较稳定,60℃时,分解率已达50%左右)、草酸、次氯酸、硝酸、氨水、铵盐、硝酸盐等等,同时警惕题干中出现的受热易分解的陌生物质.
2.控制温度防止原料或产品的水解反应
例2(2009年江苏)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高.其主要流程如下:
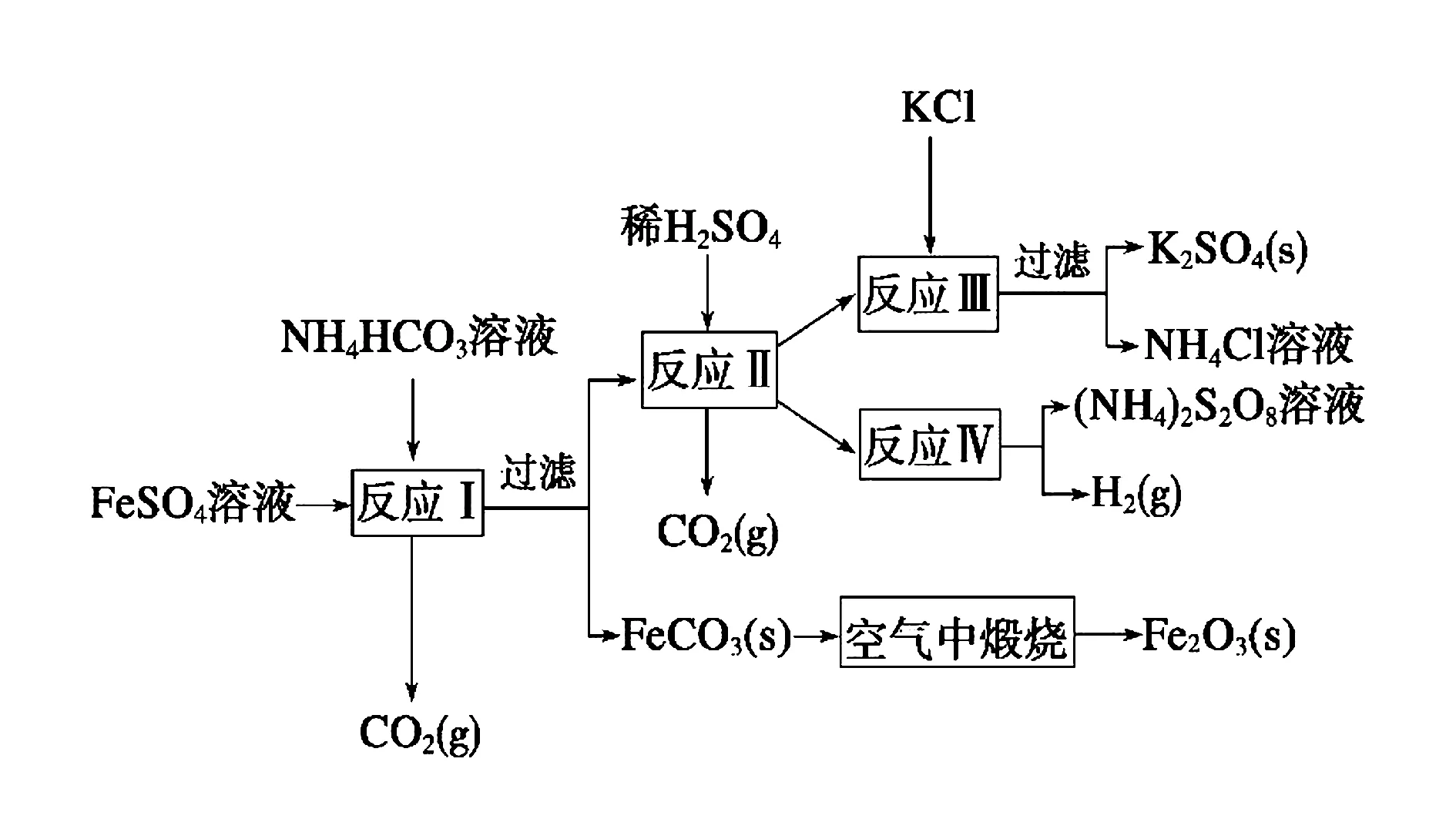
反应Ⅰ需控制反应温度低35℃,其目的是____ .
解析反应Ⅰ原料有NH4HCO3、FeSO4,温度若过高,Fe2+水解程度会加大,NH4HCO3会分解,这些都会使浓度下降,原料利用率下降,所以实验温度要控制低温.
答案防止NH4HCO3分解或减少Fe2+的水解
3.控制温度防止杂质参与引发的副反应
例3(2018年全国卷1)醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于水,易溶于酸,在气体分析中用作氧气吸收剂.一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还有为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬.实验装置如图所示.

实验中所用蒸馏水均需经煮沸后迅速冷却,目的是____.
解析根据题目信息,醋酸亚铬和二价铬易被氧气氧化,故所用蒸馏水均需经煮沸除去其中的氧气(温度越高,气体的溶解度越小),以免醋酸亚铬或二价铬与氧气反应.
答案除去水中的溶解氧
特别提醒升高温度可以减小气体溶解度,减少水中溶解的O2、CO2等气体,避免一些副反应.
4.控制温度防止题目给定信息中的副反应的发生
例4(2018年4月浙江省选考)某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉.
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大.
下列操作或描述正确的是____.
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃

答案BD
二、控制温度以提高原料的利用率
1.控制温度以提高原料的富集程度
例5(2014年江苏)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
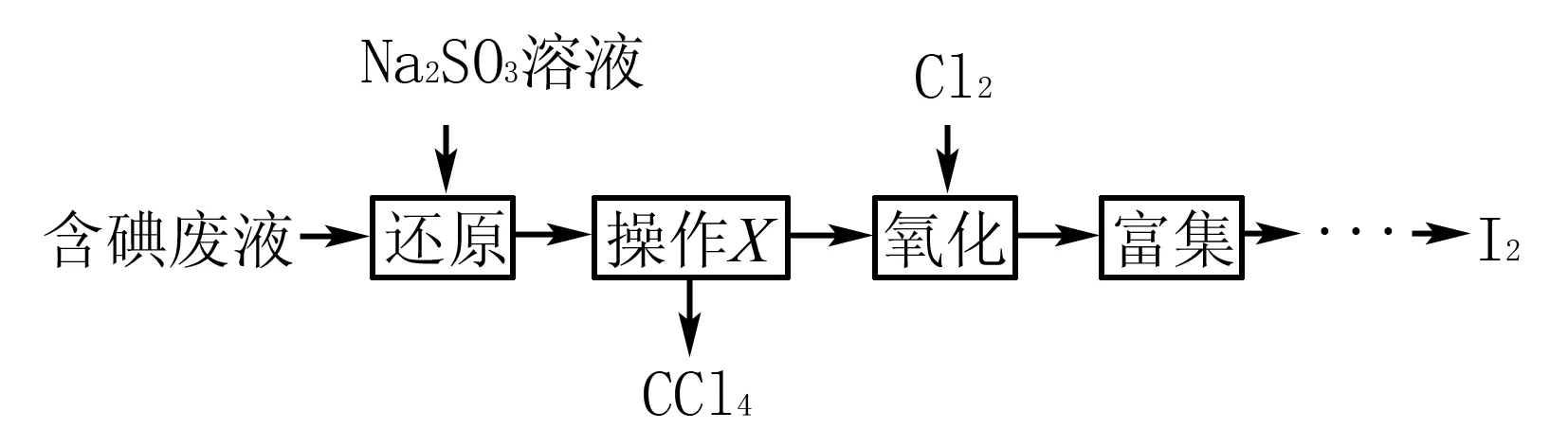
氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示).实验室控制在较低温度下进行的原因____;
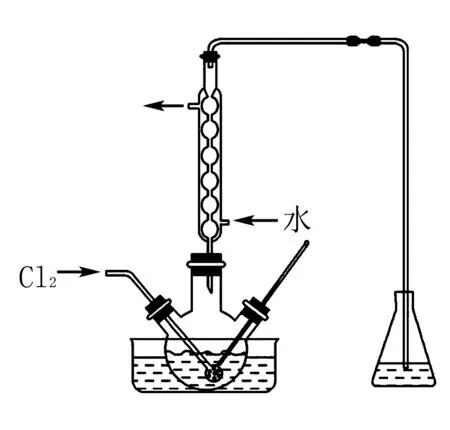
解析根据题意,氧化步骤的主反应是2I-+Cl2=I2+2Cl-,Cl2的溶解度随温度升高而减小,温度越高,氯气的溶解度越小,反应就越不充分.
答案使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化)
2.控制温度以调控化学反应速率
例6(2019年全国卷Ⅰ)硫酸铁铵[(NH4Fe(SO4)2·xH2O]是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:
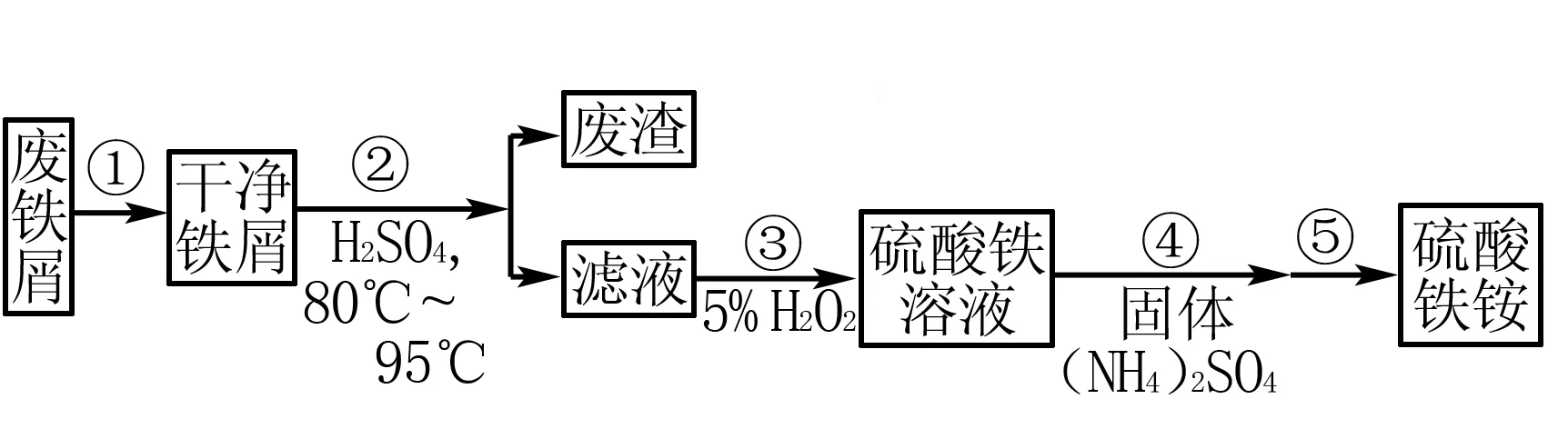
步骤②需要加热的目的是____,温度保持80~95℃,采用的合适加热方式是 ____.

答案加快反应;热水浴
特别提醒温度升高,会加快反应速率,提高单位时间内的原料利用率,但速率过快,也可能产生实验安全方面问题.
3.控制温度以使主反应平衡向正方向移动
例7(2015年江苏)以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3.
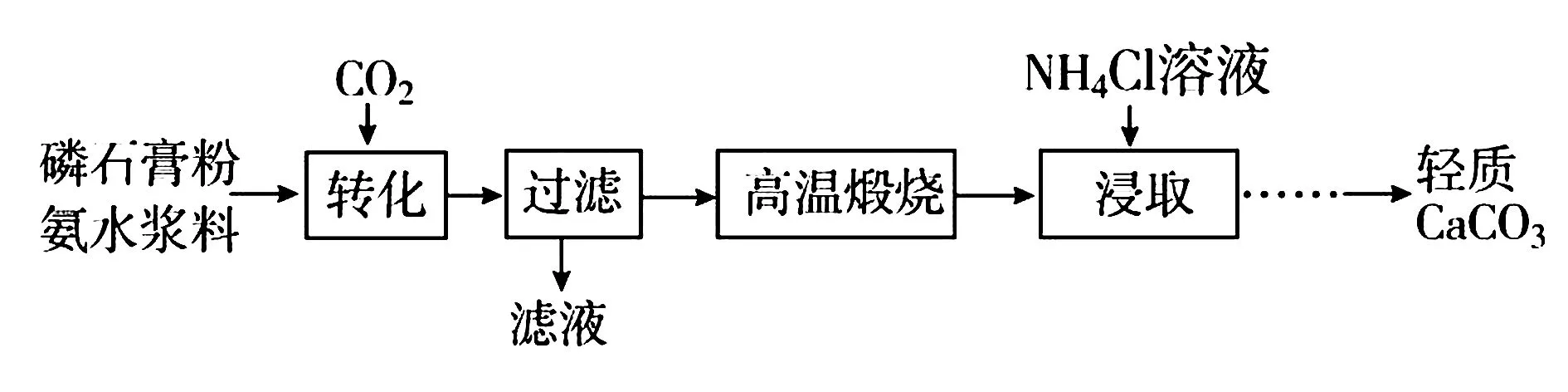
在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是____.

答案浸取液温度上升,溶液中氢离子浓度增大,促进固体中钙离子浸出
三、控制温度以减少产品收集时损耗
1.调控产品的溶解度以便收集到更多的产品
例8(2019年全国卷3)乙酰水杨酸(阿司匹林)是目前常用药物之一.实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
水杨酸 醋酸酐
乙酰水杨酸
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解.缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应.稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤.
②所得结晶粗品加入50 mL 饱和碳酸氢钠溶液,溶解、过滤.
③滤液用浓盐酸酸化后冷却、过滤得固体.
④固体经纯化得白色的乙酰水杨酸晶体5.4 g.
请回答问题:
操作①中需使用冷水,目的是____.
解析根据题意,操作①中加入冷水,后过滤得到粗品乙酰水杨酸,因此操作①中使用冷水的目的是降低温度,降低乙酰水杨酸的溶解度,使乙酰水杨酸充分析出.
答案充分析出乙酰水杨酸固体
特别提醒(1)温度影响溶解度,一般情况温度越高,固体溶解度越大,气体溶解度越小,根据题目不同需求调控温度.如结晶时,采取低温,是降低其溶解度,使晶体充分析出;如晶体洗涤时,采取冰(冷)水洗涤晶体,是降低晶体溶解度,减少晶体损耗.
(2)注意留意溶解度随温度变化反常的物质,如Ca(OH)2其溶解度随温度升高而减低.
(3)注意留意题干中出现的陌生物质的溶解度与温度关系的信息,灵活应答.
例9(2015年江苏)结合图形分析,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为____.
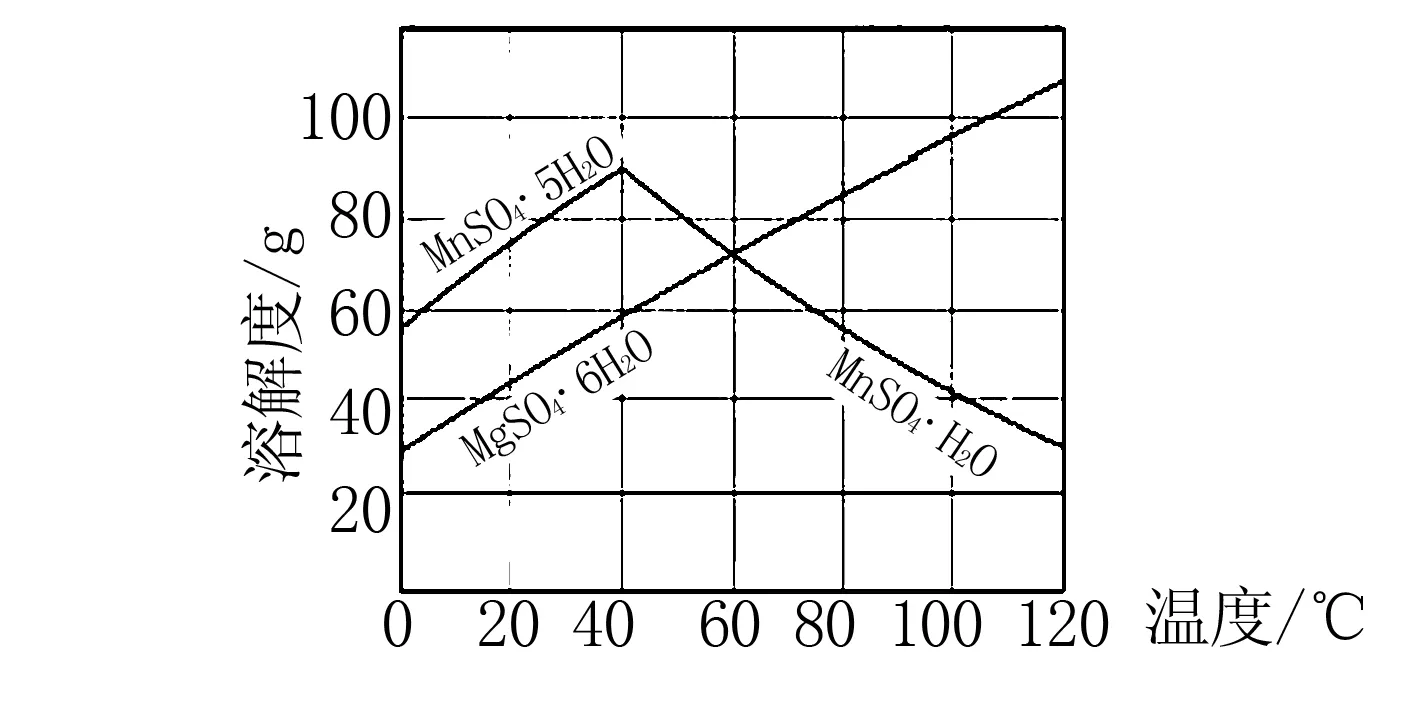
解析从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,根据图示信息,温度低于40℃后,MnSO4以MnSO4·5H2O晶体形式出现,不能得到MnSO4·H2O;温度60℃时,MnSO4·H2O和杂质MgSO4·6H2O的溶解度一样,不能得到纯净的MnSO4·H2O晶体;温度高于60℃时后,MnSO4·H2O的溶解度减小,MgSO4·6H2O的溶解度增大,MnSO4·H2O的溶解度低于MgSO4·6H2O,结晶可得到纯净的MnSO4·H2O
答案高于60℃
2.调控产品的状态以便收集到更多的产品
例10(2013年天津)FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
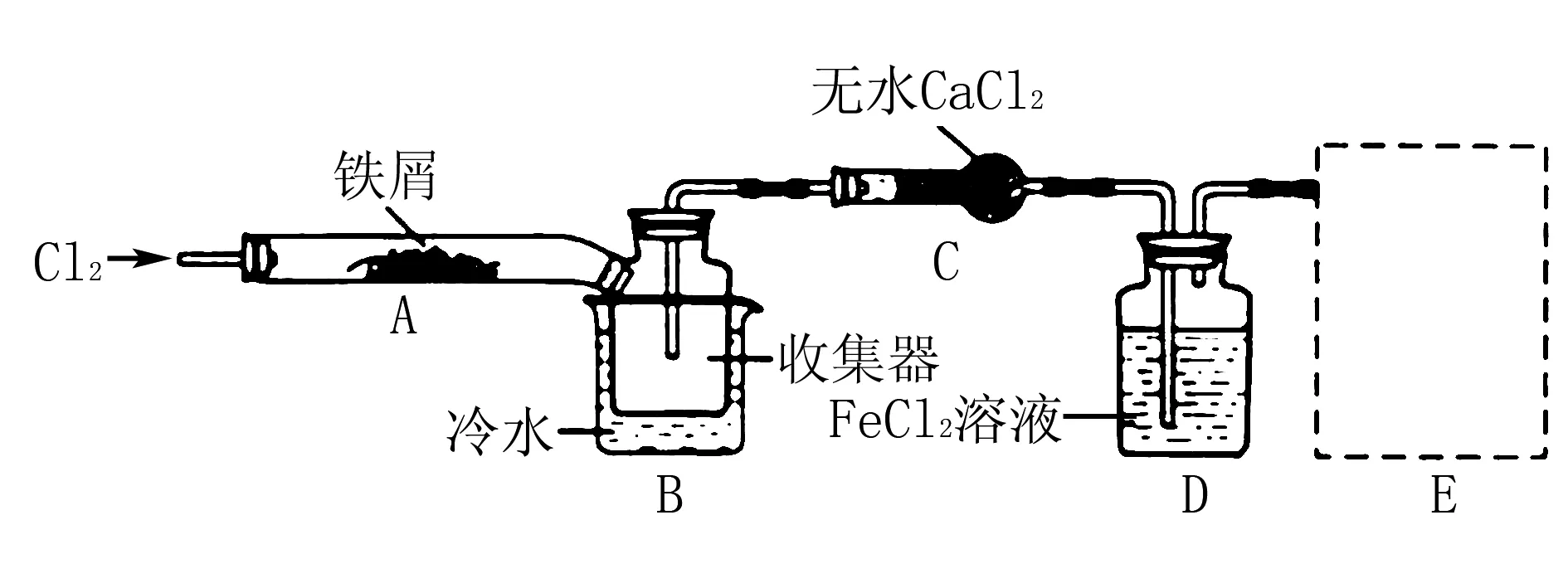
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封.
请回答问题:
第③步加热后,生成的烟状FeCl3大部分进入收集器,装置B中冷水浴的作用为____;
解析根据题干中信息无水FeCl3加热易升华,FeCl3以蒸气形式进入装置B,装置B中的冷水浴能将FeCl3蒸气冷却为FeCl3固体,从而收集到FeCl3
答案冷却,使FeCl3沉积,便于收集产品
特别提醒易升华的物质如I2,低沸点易挥发的物质如乙醇、乙酸,以及题给信息中的具有易升华的或低沸点的或易挥发的陌生物质,在收集此类物质时,一般使用低温或冰(冷)水浴,目的是冷却(冷凝)产品,收集到更多的产品
3.调控温度使胶体聚沉以便收集到更多的产品
例11(2017年全国卷2)水泥是重要的建筑材料.水泥熟料的主要成分为 CaO、SiO2,并含有一定量的铁、铝 和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示:
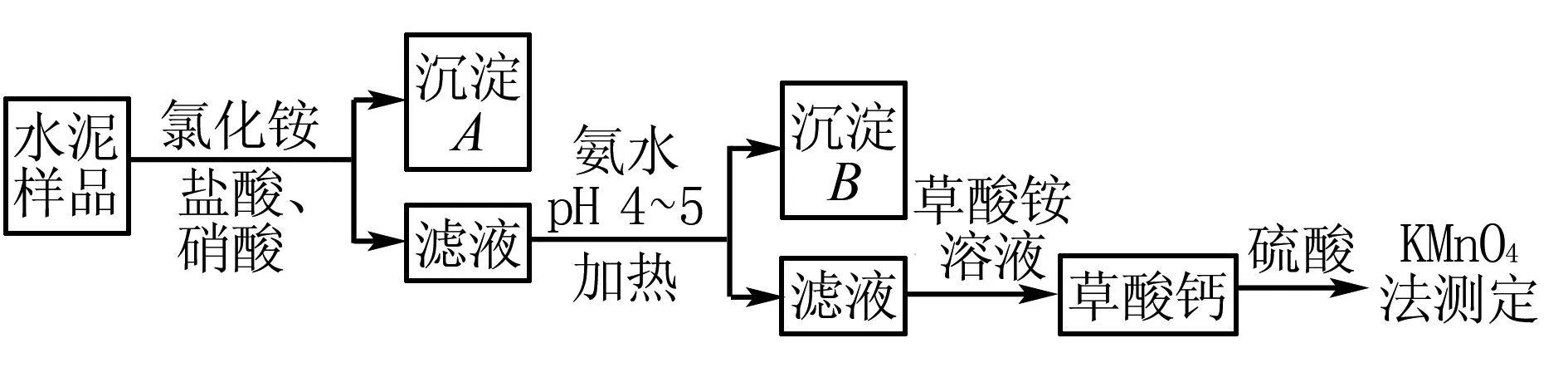
请回答问题:
加氨水过程中加热的目的是____.
解析根据题意,加入氨水,调节pH 4~5,使杂质离子Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀而除去,此过程加热可以加快反应速率,同时防止部分Al(OH)3、Fe(OH)3以胶体形式存在,加热使胶体聚沉,转变为沉淀,便于杂质分离.
答案防止胶体生成,便于沉淀分离
上述笔者总结了选择温度时要考虑的思维角度,实际实验的复杂性,往往需要同学仔细审题、多角度综合分析,选择最合适的温度,经济、安全的得到更多高品质的产品.
