高效溶剂萃取法提取黑果枸杞花色苷及其颜色稳定性研究
2020-03-17王青霞李建颖白金金罗雨家高伟健
王青霞,李建颖,程 瑶,白金金,罗雨家,高伟健
天津商业大学生物技术与食品科学学院 天津市食品生物技术重点实验室 国家级食品与药品实验教学示范中心,天津 300134
黑果枸杞(LyciumruthenicumMurr.)为茄科枸杞属[1],其果实中富含花青素[2,3],花青素在自然界中与糖以糖苷键的形式结合形成花色苷,赋予自然界五彩斑斓的颜色[4]。花色苷类化合物能够以完整的糖苷形式从消化道内进入血浆[5,6],且具有抗氧化活性[7,8]。
花色苷的传统提取方法有溶剂萃取法、超声辅助提取法、微波辅助提取法、酶法等[9]。其共同点是方法简单,操作简便,提取时间长,提取率低。随着仪器技术的进步,高效溶剂萃取法因其萃取时间短、效率高、对有效成分破坏少而深受欢迎,但其在花色苷提取上的应用鲜少[10]。高效溶剂萃取技术是利用随温度变化的情况下,扩散度随温度的升高而增加、粘度随温度的升高而降低、表面张力随温度升高而降低、溶解度随温度升高而升高,从而加速溶解过程;同时在高压下使溶剂保持液态并快速充满萃取罐。本研究采用高效溶剂萃取法,旨在寻求高效、适用于黑果枸杞花色苷的提取方法。
黑果枸杞颜色的变化是由多种复杂的因素造成的,花色苷的种类和含量不同会影响其颜色稳定性。花色苷显色是因为其配基有一个π-电子共轭体系(发色团),可吸收特定波长的光而被激发显色,配基上的羟基和甲氧基(助色团)本身无色,但与发色团相互作用,从而影响颜色[11]。黑果枸杞中的花色苷不稳定,极易受到温度、pH等因素的影响[12,13],多数稳定性研究都是以花色苷的含量为指标,而在实际的加工与储存过程中,颜色通常被视为一个重要的质量指标,为了将这一指标更加精准化和数字化,采用分光测色计测定颜色数值的变化,为进一步研究与开发提供理论依据。
1 材料与方法
1.1 材料与仪器
黑果枸杞干果(产自宁夏);纯水(实验室自制);无水乙醇(德国默克公司);盐酸、磷酸氢二钠、柠檬酸(天津市风船化学试剂科技有限公司);氯化钾(天津光复科技发展有限公司);冰乙酸(天津大学科威公司);无水乙酸钠、硅藻土(国药集团化学试剂有限公司)。
HPSE Gemini型高效溶剂萃取仪(北京莱伯泰科公司);DK-8AS型电热恒温水浴锅(上海精密科学仪器有限公司);AX224ZH型分析天平(奥豪斯仪器有限公司);ST3100型pH计(奥豪斯仪器有限公司);UV-2600型紫外可见分光光度计(日本岛津公司);DH-101型电热鼓风干燥箱(上海精密科学仪器有限公司);RV10DIGITAL型旋转蒸发仪(德国IKA公司);VaCo2-Ⅱ型真空冷冻干燥机(德国ZIRBUS公司);CM-5型分光测色计(柯尼卡美能达公司)。
1.2 方法
1.2.1 实验前准备
将黑果枸杞置于37 ℃电热鼓风干燥箱中,烘干24 h,粉碎,过60目筛,冷藏备用。
pH 1.0的缓冲溶液配制:0.2 mol/L KCl∶0.2 mol/L HCl=25∶67,V/V,用pH计进行测定,并调整至1.0。pH 4.5的缓冲溶液配制[14]:0.2 mol/L NaAc∶0.2 mol/L HAc=1∶1,V/V,用pH计进行测定,并调整至4.5。
pH 2.5的缓冲溶液配制:0.2 mol/L Na2HPO4∶0.1 mol/L 柠檬酸=13∶180;pH 4.0的缓冲溶液配制:0.2 mol/L Na2HPO4∶0.1 mol/L 柠檬酸=77∶123;pH 6.0的缓冲溶液配制:0.2 mol/L Na2HPO4∶0.1 mol/L 柠檬酸=84∶49;pH 8.0的缓冲溶液配制:0.2 mol/L Na2HPO4∶0.1 mol/L 柠檬酸=390∶11;V/V,用pH计进行测定并调整。
1.2.2 总花色苷提取得率测定
采用pH示差法测定总花色苷的含量,测量提取液的体积V,取两份1 mL提取液于具塞试管中,并分别用pH 1.0和pH 4.5缓冲液梯度稀释100倍,混匀,于40 ℃恒温水浴锅中平衡40 min,以提取溶剂作对照进行相应处理。待平衡结束后,分别测其在530 nm和700 nm下的吸光度。原pH示差法以矢车菊素-3-葡萄糖苷为标准,但研究表明黑果枸杞中不含矢车菊素-3-葡萄糖苷,锦葵色素-3-葡萄糖苷含量较高,因此,以锦葵色素-3-葡萄糖苷作为标准对照[15],调整pH示差法计算公式为[16]:
总花色苷提取率(%)=([A530-A700]pH1.0-[A530-A700]pH4.5×Mw×DF×V/ε×L×m)×100%
式中:A530波长为530 nm处的吸光度;A700波长为700 nm处的吸光度;Mw锦葵色素-3-葡萄糖苷的相对分子质量,493.2 g/mol;DF稀释倍数,100;V提取液的体积;ε摩尔消光系数,29 600 L/(mol·cm);L光程厘米数,1 cm;m原料的质量,5.0 g。
1.2.3 总花色苷提取工艺
高效溶剂萃取仪运行前连接氮气,氮气输出压力为0.8 MPa,进行密封性测试,称取5.0 g黑果枸杞粉,称取12.0 g硅藻土,将黑果枸杞粉与硅藻土混合均匀,装入34 mL萃取罐中,压实;以水和乙醇为萃取溶剂,设置温度、乙醇浓度(乙醇与水的比例)、时间、压力和循环次数等条件后开始运行,静态萃取过程可连续进行多次,注入溶剂与冲洗所用溶剂总体积随着循环次数的增加而增加。
静态萃取过程:黑果枸杞萃取罐→注入溶剂→升温升压→静态萃取→冲洗萃取后基质(冲洗体积为罐体体积60%)→吹扫样品
1.2.4 单因素实验
1.2.4.1 静态萃取温度对提取效果的影响
固定乙醇浓度70%,静态萃取压力8 MPa,静态萃取时间4 min,循环次数2次,分别考察静态萃取温度为35、40、45、50、55 ℃对提取效果的影响。
1.2.4.2 乙醇浓度对提取效果的影响
固定静态萃取温度50 ℃,静态萃取压力8 MPa,静态萃取时间4 min,循环次数2次,分别考察乙醇浓度为50%、60%、70%、80%、90%对提取效果的影响。
1.2.4.3 静态萃取时间对提取效果的影响
固定乙醇浓度70%,静态萃取温度50 ℃,静态萃取压力8 MPa,循环次数2次,分别考察静态萃取时间为2、3、4、5、6 min对提取效果的影响。
1.2.4.4 静态萃取压力对提取效果的影响
固定乙醇浓度70%,静态萃取温度50 ℃,静态萃取时间4 min,循环次数2次,由于仪器限制压力范围,分别考察静态萃取压力为6、7、8、9、10 MPa对提取效果的影响。
1.2.4.5 循环次数对提取效果的影响
固定乙醇浓度70%,静态萃取温度50 ℃,静态萃取压力8 MPa,静态萃取时间4 min,分别考察循环次数为1、2、3、4、5次对提取效果的影响。
1.2.5 响应面优化试验
在单因素实验的基础上,采用Box-Benhnken设计方案,通过方差分析与模型建立,确定最优提取条件。选择静态萃取温度、乙醇浓度和静态萃取时间三个因素,以花色苷提取得率为响应值,设计响应面试验[17,18]。因素水平表见表1。
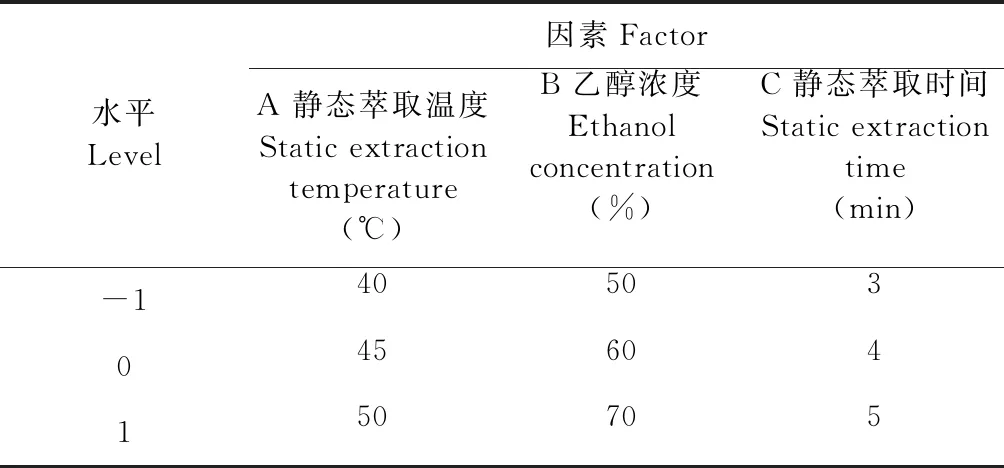
表1 实验因素水平
1.2.6 颜色稳定性实验
按最佳提取条件提取得到黑果枸杞提取液,设置旋转蒸发仪温度为45 ℃,将提取液浓缩至近干,转移至真空冷冻干燥机专用物料盘中,-80 ℃下预冻24 h,真空冷冻干燥48 h,得到黑果枸杞提取物。称取2.5 g黑果枸杞提取物用纯水或缓冲液定容至250 mL,分别考察温度(4、20、40 ℃)、pH(2.5、4.0、6.0、8.0)对其颜色稳定性的影响。
使用分光测色计测定颜色,光源为D65,观测角度10°。采用液体测量模式,仪器需用纯水进行校正,每组样品测两次,求平均值。其中L*代表亮度,纯水L*值为100,a*值为正代表红色,为负代表绿色,b*值为正代表黄色,为负代表蓝色,△E*值表示颜色的变化程度[19]。本实验以纯水做空白校正和对照,测定样品的L*、a*、b*、△E*值,当△E*的变化值大于3.5时肉眼可见[20]。
2 结果与分析
2.1 单因素实验结果
2.1.1 静态萃取温度对提取效果的影响
静态萃取温度对提取效果的影响如图1所示。随着温度的升高,分子运动速度加快,花色苷溶出到溶剂中,进而使得花色苷提取得率升高,但当温度达到45 ℃后,随着温度的升高,花色苷提取得率反而下降,是由于花色苷易受到温度的影响,温度升高会使花色苷结构遭到破坏,从而使得花色苷提取得率降低,因此选取45 ℃为最佳静态萃取温度。
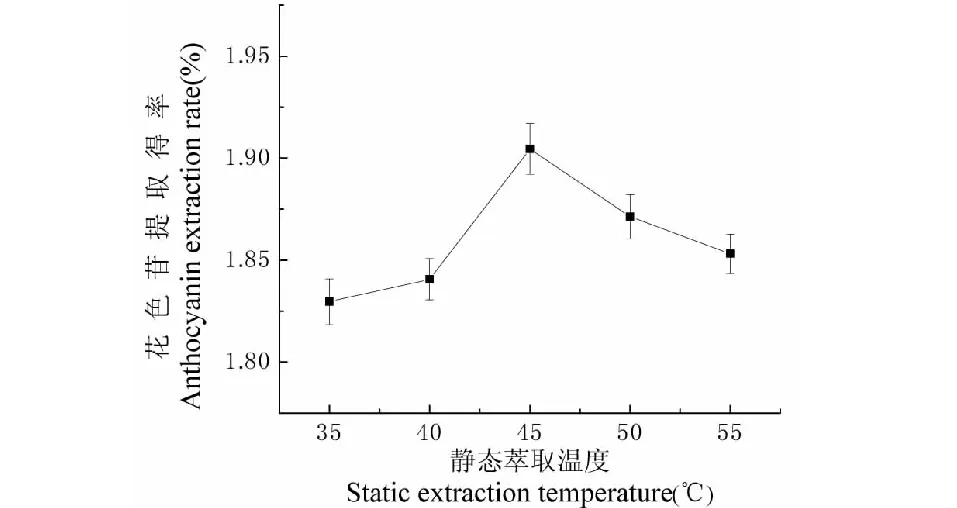
图1 静态萃取温度对提取效果的影响Fig.1 Effect of static extraction temperature on extraction
2.1.2 静态萃取时间对提取效果的影响
不同的静态萃取时间对提取效果的影响如图2所示。随着静态萃取时间的延长,花色苷提取得率呈上升趋势,但静态萃取时间超过4 min,花色苷提取得率呈下降趋势,随着时间的延长,花色苷受温度影响的时间也随之加长,导致花色苷提取得率下降,因此最佳静态萃取时间为4 min。
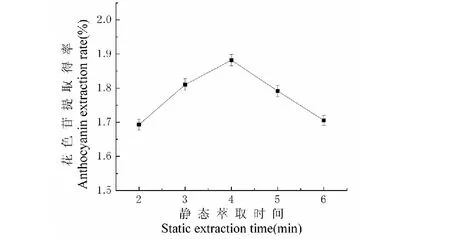
图2 静态萃取时间对提取效果的影响Fig.2 Effect of static extraction time on extraction
2.1.3 乙醇浓度对提取效果的影响
不同乙醇浓度对黑果枸杞花色苷提取的影响如图3所示。根据相似相溶原理,随着乙醇浓度的升高,花色苷提取得率呈现先上升后下降的趋势,说明黑果枸杞中花色苷的极性强于乙醇,比水的极性弱,当乙醇浓度为60%时,利于花色苷的溶出,因此最佳乙醇浓度为60%。
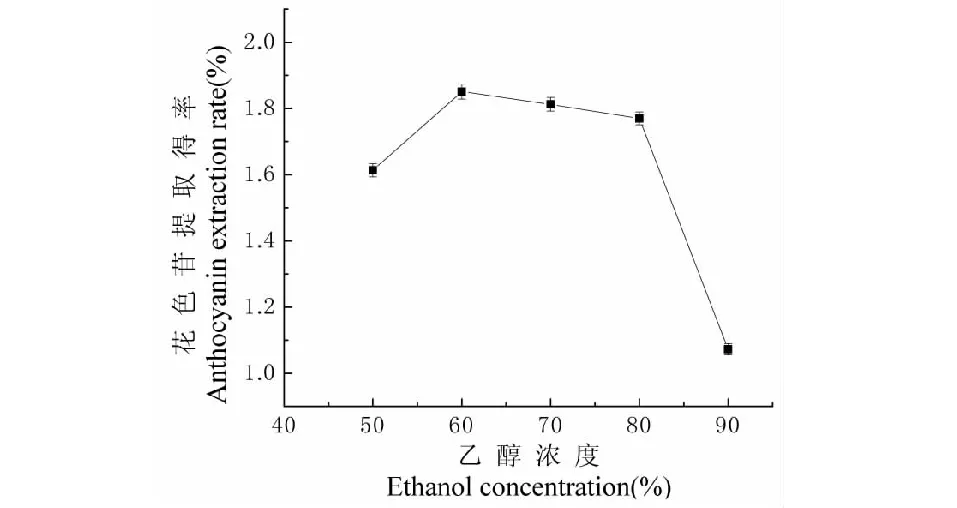
图3 乙醇浓度对提取效果的影响Fig.3 Effect of ethanol concentration on extraction
2.1.4 静态萃取压力对提取效果的影响
静态萃取压力对黑果枸杞提取效果的影响如图4所示。随着压力的升高,花色苷提取得率略微上升,说明压力的增大能够加速溶质的传质速率,加快花色苷的溶出,从而提高提取效率,但当压力超过8 MPa后,压力升高,花色苷提取得率略微下降,说明在此高压状态下,花色苷结构会遭到一定程度的破坏,因此采用压力8 MPa。
2.1.5 循环次数对提取效果的影响
循环次数对黑果枸杞提取效果的影响如图5所示。随着循坏次数的增加,黑果枸杞中的花色苷溶出至溶剂中,但循坏次数超过3次后花色苷提取得率呈下降趋势,原因是升温升压的时间不可忽略,并
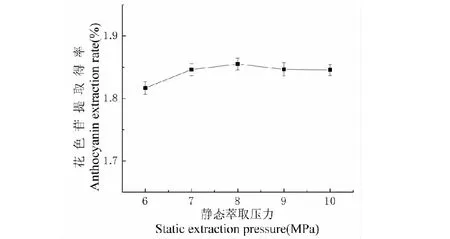
图4 静态萃取压力对提取效果的影响Fig.4 Effect of static extraction pressure on extraction
且循环次数增加导致溶剂体积增加,因而提取液中花色苷浓度降低,花色苷分子之间的共轭作用减弱,花色苷会发生部分降解,因此循环2次最佳。
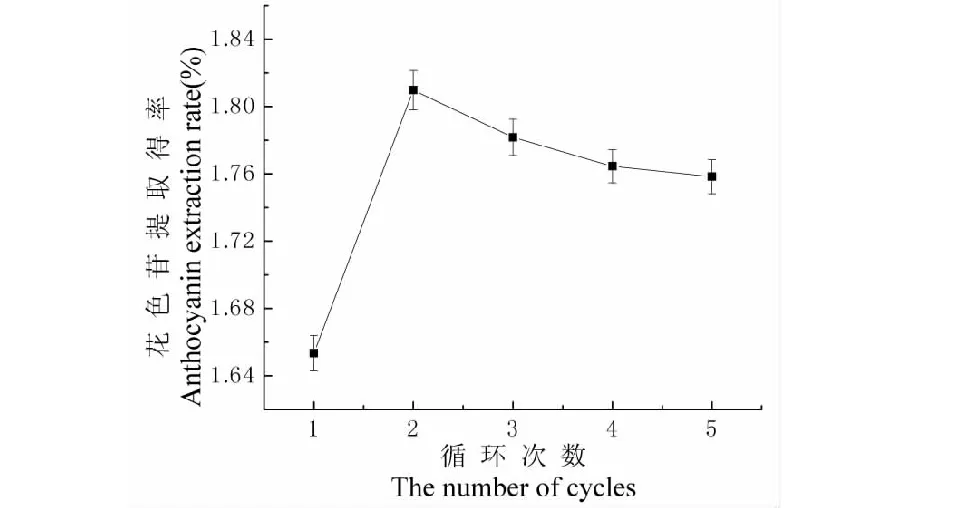
图5 循环次数对提取效果的影响Fig.5 Effect of the number of cycles on extraction
2.2 响应面试验结果及分析
2.2.1 响应面试验结果
响应面试验结果见表2。
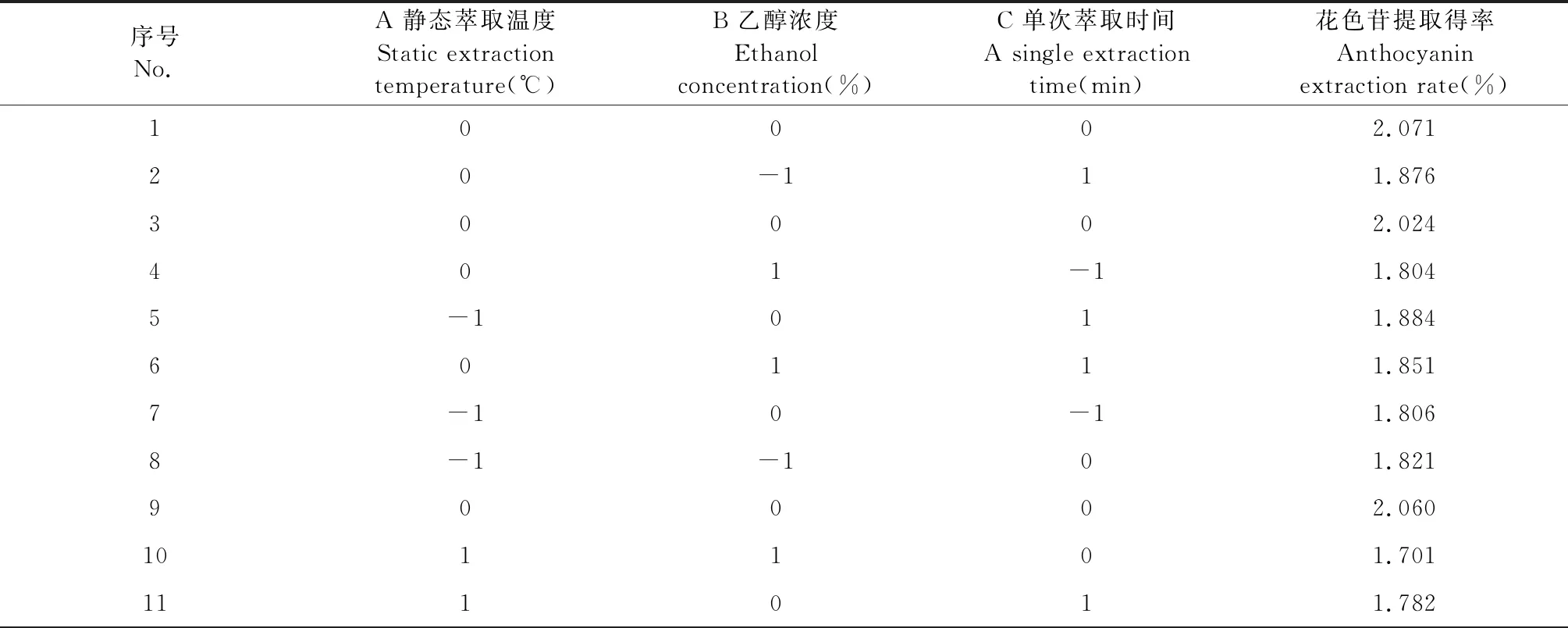
表2 响应面试验结果
续表2(Continued Tab.2)

序号No.A 静态萃取温度Static extraction temperature(℃)B 乙醇浓度Ethanol concentration(%)C 单次萃取时间A single extraction time(min)花色苷提取得率Anthocyanin extraction rate(%)120-1-11.802130002.070140002.031151-101.8551610-11.81517-1101.868
2.2.2 方差分析
运用Design-Expert 8.0软件对表2结果进行方差分析,显著性结果见表3。
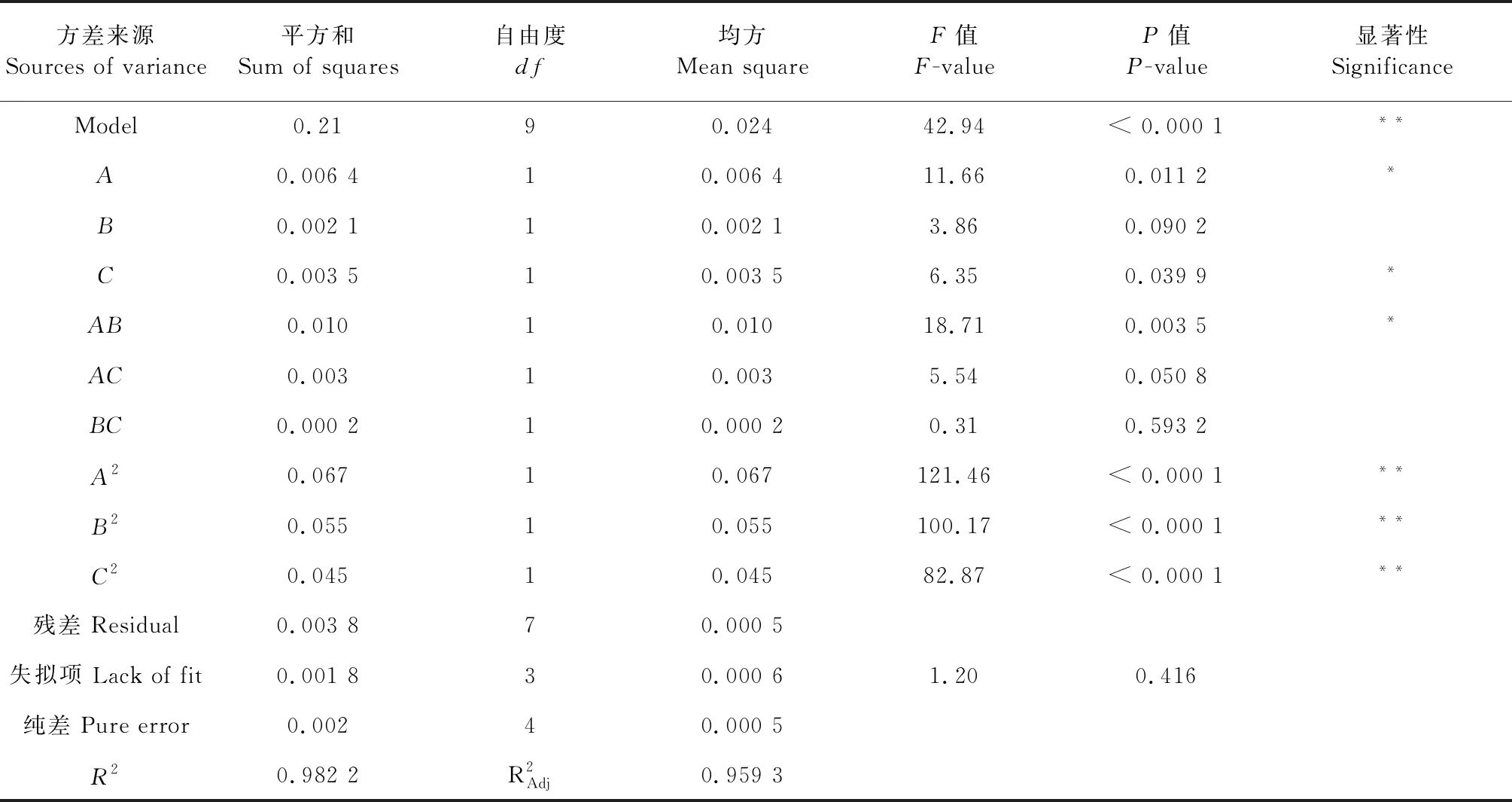
表3 回归模型的方差分析
注:**表示在1‰水平显著;*表示在5%水平显著。
Note:**indicates significant at 1‰ level;*means significant at the 5% level.
经回归拟合,得到花色苷提取得率与各因素变量二次多元回归模型为:
Y=2.05-0.028A-0.016B+0.021C-0.051AB-0.028AC-0.006 6BC-0.13A2-0.11B2-0.10C2
由回归方程可反映出各因素对提取液花色苷提取得率的影响程度,分析一次项系数可得到,影响提取液花色苷提取得率的因素主次顺序为:A(静态萃取温度)>C(静态萃取时间)>B(乙醇浓度)。该模型P<0.000 1,表明该模型是有意义的,失拟项P=0.416>0.05不显著,模型R2=98.22%,表明此模型拟合程度好,使用该回归方程来预测真实情况是可行的。
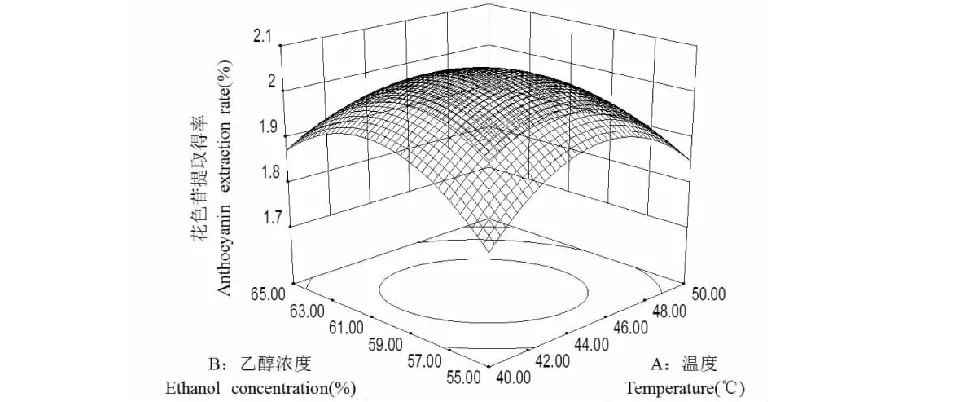
图6 温度与乙醇浓度对花色苷提取得率的交互作用Fig.6 Effect of interaction between temperature and ethanol concentration on the anthocyanin extraction rate
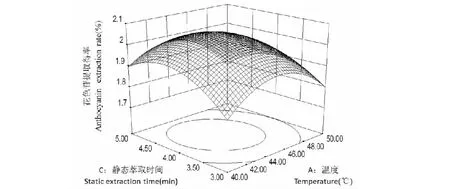
图7 温度与静态萃取时间对花色苷提取得率的交互作用Fig.7 Effect of interaction between temperature and static extraction time on the anthocyanin extraction rate
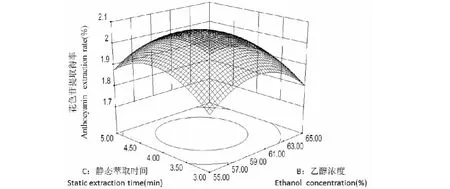
图8 乙醇浓度与静态萃取时间对花色苷提取得率的交互作用Fig.8 Effect of interaction between ethanol concentration and static extraction time on the anthocyanin extraction rate
图6所示为固定静态萃取时间为零水平,温度与乙醇浓度对花色苷提取得率的交互作用,随着温度的升高和乙醇浓度的增大,花色苷提取得率都呈现先增加后降低的趋势。图7所示为固定乙醇浓度为零水平,随着温度的升高以及静态萃取时间的延
长,花色苷提取得率也呈现先增加后降低的趋势。图8所示为固定温度为零水平,随着乙醇浓度的增大与静态萃取时间的延长,花色苷提取得率也呈现先增加后降低的趋势。两因素的交互作用对花色苷提取得率的影响整体趋势与单因素实验基本相符。
2.2.3 验证实验
通过回归方程求解,在试验范围内最佳提取条件为:温度48.15 ℃,乙醇浓度58.95%,提取时间4.02 min,在此条件下提取液的花色苷理论提取得率为1.989%。考虑到实际,将其校正为温度48 ℃,乙醇浓度60%,提取时间4 min。在此条件下进行三组平行试验,提取得到的总花色苷的提取得率为1.973%±0.015%,结果与预测值基本相符,证明了该模型的有效性。
2.3 颜色稳定性实验结果
2.3.1 温度对颜色稳定性的影响
由图9可以看出,当黑果枸杞花色苷溶液保存温度为20 ℃时,随着时间的推移,a*值变大,向红色方向移动,b*值波动较小,且处于蓝色方向,△E*值波动幅度最大,且2天后△E*值的变化值大于3.5,可通过肉眼观察到颜色的变化;当保存温度为40 ℃时,a*值变小,红色变淡,但幅度较小,b*值由负方向渐渐向正方向移动,蓝色渐渐变为黄色,△E*值的变化值4天后超过3.5,颜色变化肉眼可见。当保存温度为4 ℃时,a*、b*和△E*值相对稳定,10天内颜色变化不明显,表明4 ℃利于黑果枸杞花色苷溶液的保存。

图9 温度对黑果枸杞花色苷颜色稳定性的影响Fig.9 Effect of temperature on the color stability of anthocyanins from L.ruthenicum
2.3.2 pH对颜色稳定性的影响
由图10可以看出,当黑果枸杞花色苷溶液pH值为2.5时,a*值较大且非常稳定,溶液颜色偏红,b*值与△E*值也较稳定;当溶液pH值为4.0时,a*值变小,红色变淡,b*值由负方向渐渐向正方向移动,蓝色渐变为黄色,△E*值的变化值2天后超过3.5,颜色变化肉眼可见;当溶液pH值为6.0时,a*值大幅减小,红色变浅,9天后b*值向正方向过渡,变为黄色,△E*在前2 h变化极大,肉眼可观察到颜色变化;当溶液pH值为8.0时,a*值由正方向变为负方向,说明红色渐渐向绿色方向过渡,b*值由负方向渐渐向正方向移动,蓝色渐变为黄色,△E*值变化迅速,肉眼可见颜色变化。表明碱性条件下不利于黑果枸杞花色苷溶液的保存,溶液pH值为2.5时其稳定性最好,利于保存。
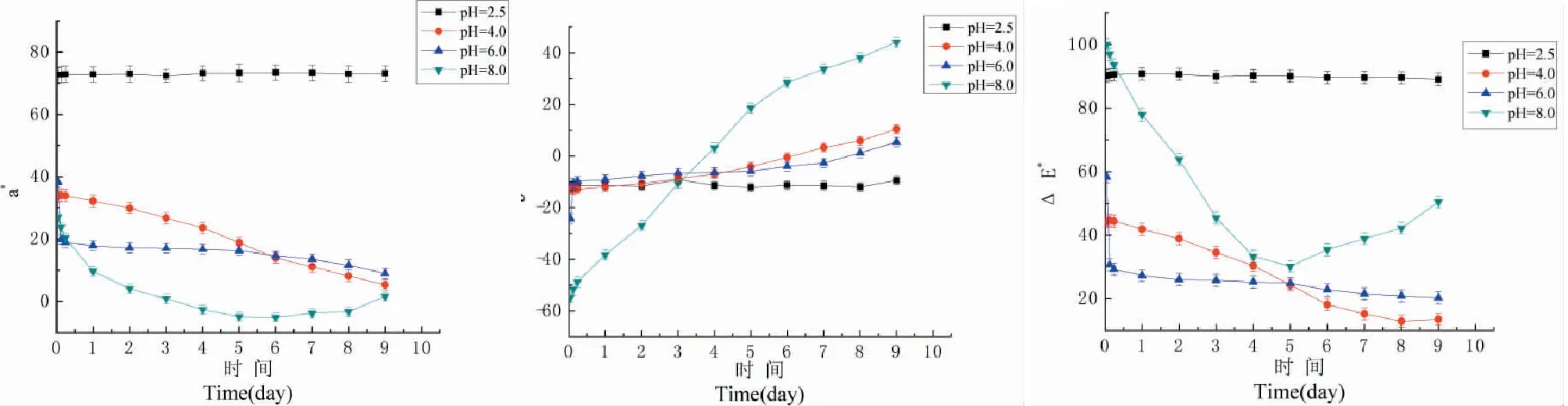
图10 pH对黑果枸杞花色苷颜色稳定性的影响Fig.10 Effect of pH on the color stability of anthocyanins from L.ruthenicum
3 结论
本研究采用高效溶剂萃取法提取黑果枸杞中花色苷,在单因素实验的基础上,通过响应面试验优化提取工艺,得到最佳提取条件:温度48 ℃,乙醇浓度60%,提取时间4 min,静态萃取压力8 MPa,循环2次,在此条件下,花色苷提取得率为1.989%,与传统提取工艺相比,该提取工艺所需时间短,效率高。颜色稳定性实验表明酸性条件和低温条件有助于黑果枸杞花色苷溶液的保存,其最适保存温度为4 ℃、pH值为2.5,为其以后加工与贮藏提供理论依据。
