艾比湖湿地植物群落土壤酶活性特征及影响因素
2020-03-16李艳红朱海强方丽章李发东
李艳红,朱海强,方丽章,李发东,3,4
1 新疆师范大学地理科学与旅游学院,乌鲁木齐 830054 2 新疆维吾尔自治区重点实验室,新疆干旱区湖泊环境与资源实验室,乌鲁木齐 830054 3 中国科学院地理科学与资源研究所,北京 100101 4 中国科学院大学资源与环境学院,北京 100190
土壤酶在湿地生态系统的物质循环中起重要作用[1],可反映土壤中一切生物化学过程的强度和方向,其变化规律与土壤养分、植物群落结构有密切的关系[2- 3],因此土壤酶是评价土壤肥力及土壤质量的敏感性指标[4- 5]。近年来,学者对湿地土壤酶活性的变化与生态环境条件进行了诸多研究。国外,学者研究了引水恢复对沿海湿地反硝化酶活性的影响,发现水中营养物质、土壤深度对酶活性及硝化影响显著[6],以水解胞外酶[7]、脲酶[8]、蛋白酶[9]为指标分别研究了泥炭湿地、人工稻田湿地及沼泽湿地土壤酶的特征及影响因子,发现酶活性有明显的季节变化,其中水位变化、土壤温度的高低对酶活性有显著的影响。国内学者研究了白洋淀、洞庭湖和鄱阳湖等淡水湖泊湿地不同植被下土壤蔗糖酶、脲酶、磷酸酶、蛋白酶和过氧化氢酶,结果表明:土壤水分、有机质、氮、磷含量的差异是酶活性变化的主要因素[10- 12],对高原湿地、滨海湿地及三角洲湿地土壤酶的研究发现植被盖度的变化、有机碳的增减对酶活性的大小影响显著。对西北地区植物群落土壤酶及其季节变化主要侧重于河岸湿地[13]、沼泽湿地[14]、河流湿地[15]等,关于湖泊湿地土壤酶活性的研究较为薄弱。
艾比湖湿地作为干旱区典型的高盐湖泊湿地,绿洲与荒漠化共轭演变的重要核心位置,对区域气候、动植物多样性及土壤质量等生态环境的演变至关重要。目前,诸多学者选取过氧化氢酶、磷酸酶、蔗糖酶和脲酶,研究了艾比湖湿地小尺度典型植物群落[16]、不同土壤质地[17- 18]、水盐胁迫[19- 20]下的土壤酶活性,结果显示,土壤有机质、水盐因子是酶活性变化的主要因素,但对大尺度不同植物群落土壤酶活性动态变化及影响因素的研究较少。因此,本文以艾比湖环湖一周范围内梭梭-柽柳、梭梭、胡杨和芦苇群落为研究对象,研究不同植物群落下土壤过氧化氢酶、磷酸酶和脲酶的动态变化及影响因素,通过与湿润区湿地土壤酶活性特征差异的对比,探讨高盐湖泊湿地土壤酶活性的变化特征,以期为其生态环境的演变及管理提供科学依据。
1 材料与方法
1.1 研究区概况
艾比湖湿地 (44°30′—45°09′ N,82°36′—82°50′ E),是准噶尔盆地西部最低的洼地和水盐交汇中心,属于我国典型的荒漠湿地生态系统[21- 22],新疆第一大咸水湖,面临干旱、高盐、大风三大问题。面积约为2670.8 km2,三面环山且西北部临近阿拉山口,全年8级以上大风数多达165 d,最大风速可达55 m/s;年均气温6.6—7.8 ℃,干旱少雨,蒸发量是降水量的16倍,属于典型的温带大陆性干旱气候。以艾比湖湖心质点(44°52′32.77″N,83°2′18.34″E)[23]为中心(图1),在距湖滨5—15 km,绕湖160 km范围内,将其划分为西北部、东北部、东南部和西南部,土壤主要发育为灰棕漠土、盐土、风沙土等类型,平均粒径在2.63—6.51 μm之间,pH值在7.52—9.29范围内,土壤盐渍化程度高,盐土面积达到568.394 km2[24],四个区域盐分含量的差异使其分别形成以梭梭-柽柳、梭梭、胡杨为主的耐盐碱植物及以芦苇为优势种的湿生植物,植被覆盖度介于13%—66%。

图1 研究区示意图Fig.1 Schematic map of study area
1.2 样品采集
根据新疆土壤盐碱化分级标准,将湿地不同区域划分为低、中、高3个盐分梯度(表1),2015—2016年5、8、11月分别绕湖一周160km范围,在不同盐碱程度区域内的梭梭-柽柳(S-C)、梭梭(SS)、胡杨(HY)和芦苇群落(LW)下采用5点法进行样地设置,共65个,详细记录样地的高程、经纬度及植物的株数与种类。根据艾比湖湿地土壤质地差异进行分层采集0—5、5—10、10—20、20—40、40—60 cm深度的土壤样品,采集样品自然风干后,剔除杂质,过筛保存。
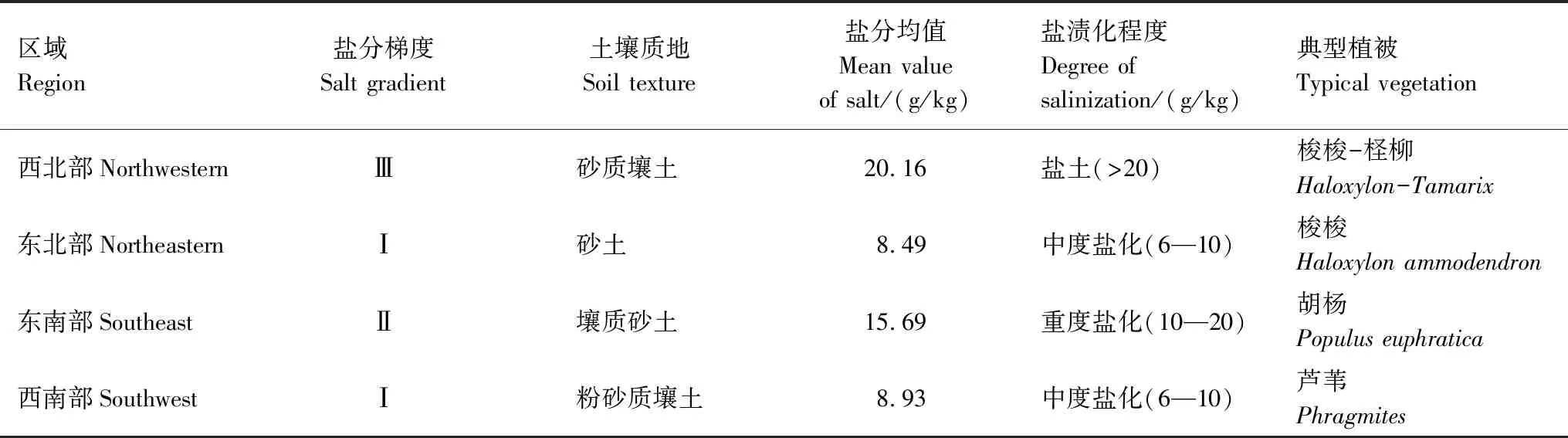
表1 艾比湖湿地土壤盐渍化分级及植被特征
Ⅰ、Ⅱ、Ⅲ分别代表不同植物下土壤盐分梯度
1.3 实验方法
采用常规方法[25]测定,土壤有机质采用重铬酸钾氧化-外加热法,全磷采用碱熔-钼锑抗比色法,全氮采用凯氏定氮法测定,土壤全盐含量将5∶1的水土比溶液过滤,用质量法测定,土壤pH值采用pH 电极(pH211microprocessorpHmeter)测定土壤温度采用便携式土壤温度计(型号:MR- 98501)测定,土壤含水量采用烘干法测定,过氧化氢酶活性采用紫外分光光度法[26- 27],碱性磷酸酶采用磷酸苯二钠比色法[28],用24 h后1 g土壤所释放酚的毫克数表示,脲酶采用苯酚钠-次氯酸钠比色法[29]测定,以24 h后1 g土壤中产生铵态氮的毫克数表示。
1.4 数据处理
采用SPSS 17.0和Excel 2003软件对实验数据进行分析与制图。采用单因素方差分析法(one-way ANOVA)进行方差分析,并利用LSD方法进行显著性多重比较,差异显著性水平为α=0.05,用Pearson法对土壤酶活性和理化因子进行相关性分析(α=0.05),通过建立逐步回归方程进行通径分析。
2 结果
2.1 不同植物群落下土壤酶活性的动态变化
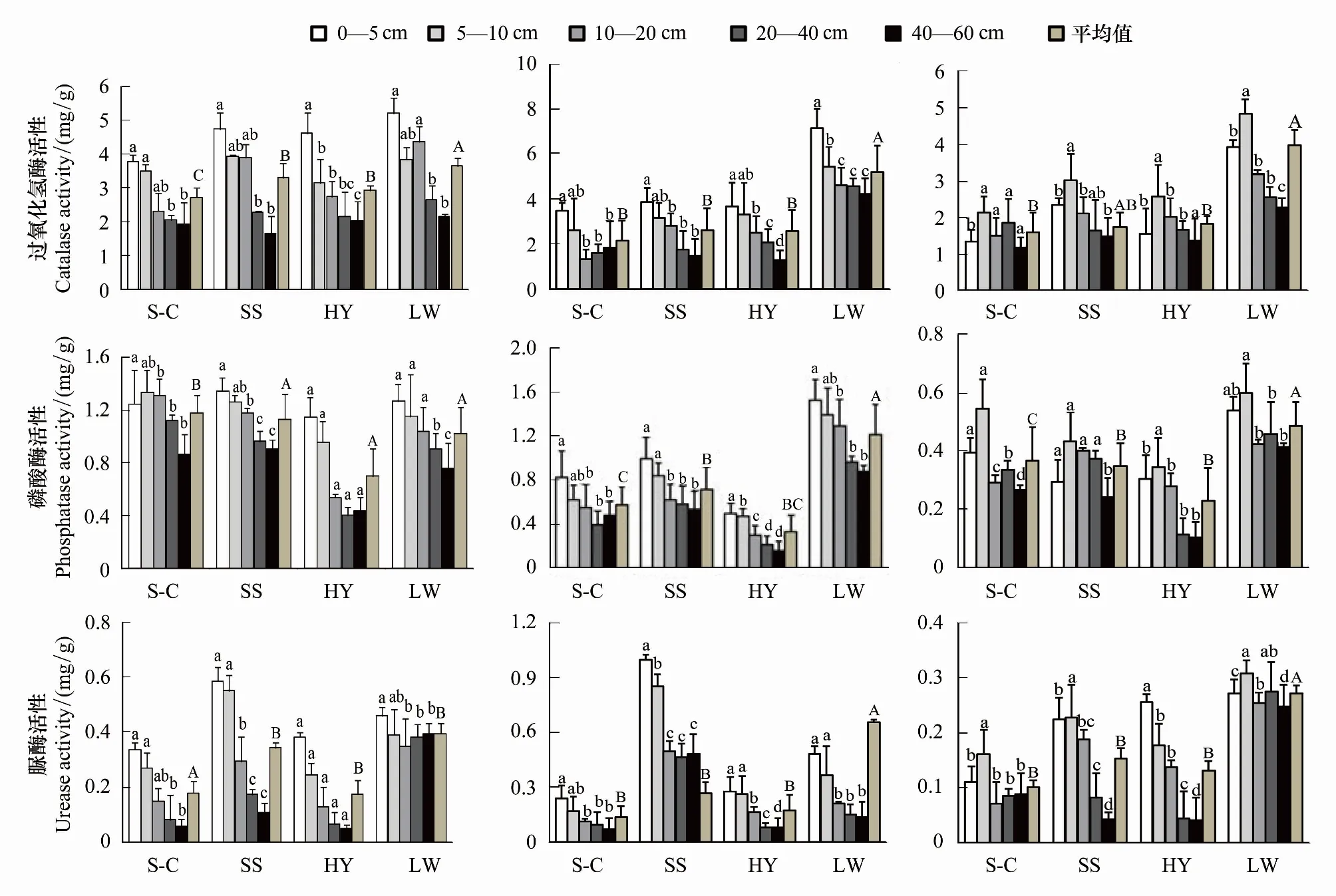
图2 不同植物群落下土壤过氧化氢酶、磷酸酶、脲酶活性的季节变化Fig.2 Seasonal changes of soil catalase, phosphatase and urease activities under different plant communities不同小写字母表示同一植物群落下不同土层间差异显著,不同大写字母表示不同植物群落间酶活性平均值差异显著(P<0.05); S-C为梭梭-柽柳群落、SS为梭梭群落、HY为胡杨群落、LW为芦苇群落
土壤酶是土壤中的生物催化剂,土壤中所进行的一切生物和化学过程都要由酶的催化作用才能完成。通过对梭梭-柽柳、梭梭、胡杨和芦苇群落下土壤过氧化氢酶、磷酸酶、脲酶活性研究发现(图2),4种植物群落下土壤过氧化氢酶、磷酸酶、脲酶活性在5、8月均随土层深度的增加而减少,表层(0—5 cm)土壤酶活性显著高于深层土壤且占总酶活性的比例较大,而11月酶活性在5—10 cm处最大。梭梭-柽柳、梭梭、胡杨和芦苇群落4种异质生境酶活性有明显的季节变化,前3种植物群落下土壤过氧化氢酶、磷酸酶和脲酶活性在5月份出现峰值(2.72、3.31 mg/g和2.94 mg/g)、(1.18、1.32 mg/g和0.69 mg/g)和(0.18、0.34 mg/g和0.17 mg/g),谷值则出现在11月(1.68、2.32 mg/g和2.23 mg/g)、(0.37、0.35 mg/g和0.23 mg/g)和(0.10、0.17 mg/g和0.13 mg/g);芦苇群落3种酶活性均在8月出现峰值(5.18、1.20 mg/g和0.66 mg/g),谷值出现在11月(3.36、0.48 mg/g和0.27 mg/g)。不同群落下土壤酶活性也有差异,土壤过氧化氢酶、脲酶活性均值表现为芦苇群落(3.36—5.18、0.28—0.39 mg/g)>梭梭群落(2.32—3.31、0.17—0.34 mg/g)>胡杨群落(2.23—2.94、0.13—0.17 mg/g)>梭梭-柽柳群落(1.68—2.72、0.10—0.16 mg/g),磷酸酶活性呈现出芦苇群落(0.48—1.20 mg/g)>梭梭群落(0.34—1.13 mg/g)>梭梭-柽柳群落(0.36—1.17 mg/g)>胡杨群落(0.22—0.69 mg/g),芦苇群落与梭梭-柽柳群落酶活性差异显著,其他两个群落间酶活性差异不显著。酶活性的变异系数可表示酶对环境介质的敏感程度及其稳定性[30- 31],4种植物群落下各月土壤过氧化氢酶、磷酸酶、脲酶活性的变异系数分别介于42%—70%、15%—43%、33%—38%范围内,表明过氧化氢酶和脲酶受土壤环境的影响较大。
2.2 不同植物群落下土壤环境因子的动态变化
由图3可知,梭梭-柽柳、梭梭、胡杨和芦苇群落土壤有机质、全氮、全磷、全盐、pH均随土层的增加而减少,土壤温度除11月外也呈现相同的规律,含水量呈相反的趋势,其中全磷、pH在土层间的变异系数分别为3.69%—14.32%、1.03%—3.06%,均属于弱变异强度。4种植物群落下土壤理化因子有明显的季节变化,有机质、全磷、全氮、全盐、pH、土壤温度的平均值均为8月>5月>11月,土壤含水量的峰值出现在11月,谷值出现在8月,土壤温度在各月之间差异显著(P=0.00)。不同植物群落下土壤理化因子各不相同,土壤有机质、全磷、全氮含量为芦苇>梭梭>胡杨>梭梭-柽柳,全盐和pH值为梭梭-柽柳>胡杨>芦苇>梭梭,土壤温度在各群落间无明显的变化,土壤含水量为芦苇>胡杨>梭梭>梭梭-柽柳。各群落下土壤有机质、全磷、全氮平均值分别介于8.93—21.5、0.60—0.94、0.43—0.78 g/kg,根据全国第二次土壤普查标准,土壤表层(0—20 cm)有机质、全磷属于缺乏和很缺乏状态,全氮处于第5级,土壤pH值大于7.5,属于碱性土,各群落下盐分均值分别介于17.37—24.72、15.85—16.99、7.41—10.23 g/kg和7.79—10.61 g/kg范围内,分别属于Ⅲ、Ⅱ、Ⅰ盐分梯度。
2.3 不同植物群落下土壤酶活性与土壤理化性质关系分析
2.3.1相关性分析
由表2可知,4种植物群落下土壤理化因子与酶活性的关系并不相同,梭梭-柽柳群落酶活性在各月与有机质、全氮呈显著正相关,与土壤含水量呈负相关,全盐、pH与酶活性呈负相关,5、11月土壤温度与酶活性呈显著正相关,8月则相反。梭梭群落有机质、全磷与酶活性呈显著正相关,8月份土壤温度与酶活性呈显著负相关,5、8月土壤含水量与酶活性呈显著负相关。胡杨群落下各月土壤酶与有机质、全氮和全磷呈显著正相关,与全盐和pH呈负相关,土壤温度在5、11月与酶活性呈显著正相关,8月则呈显著负相关。芦苇群落下土壤有机质、全氮、土壤温度在各月与土壤酶呈显著的正相关关系,除8月外,其他月份土壤含水量与酶活性均呈显著负相关。
2.3.2通径分析
通径分析可把相关系数分解为直接作用和间接系数,解释因变量对自变量的相对重要性。土壤理化性质对酶活性的影响较为复杂,为更加全面研究二者之间的关系,选择直接通径系数和间接通径系数和,定量阐释土壤理化性质对酶活性影响程度(表3—4)。结果表明,梭梭-柽柳群落下5、11月土壤有机质、全磷对酶活性的直接作用较大,土壤含水量的间接负效应较大;8月土壤温度、全盐对酶活性的间接负作用较大,有机质的直接作用较大。由表3可知,梭梭群落5月土壤含水量是间接影响酶活性的主要因子,土壤温度对其有较大的直接和间接效应,全磷对过氧化氢酶、有机质对磷酸酶有较大的直接影响;8月土壤有机质对酶活性的直接影响较大,土壤含水量、pH对其有较大的间接负效应。表4所示,胡杨群落5月土壤温度、有机质对酶活性存在较大的直接和间接效应;8月土壤温度、有机质是直接影响酶活性的因素,而含水量、pH和全盐的间接影响明显;11月有机质、土壤温度的间接影响较显著。由表4可知,芦苇群落5月土壤全磷对酶活性的直接影响较大,有机质对过氧化氢酶和磷酸酶的间接影响较大;8月土壤有机质、含水量对酶活性的直接影响较大,土壤温度对其有较大的间接正效应;11月土壤全氮的直接影响较大,土壤温度和含水量对酶活性的间接影响较明显。分析可知,土壤盐分、有机质、全磷和全氮对各植物群落酶活性差异的影响较显著,而不同月份之间土壤水分和温度对酶活性的影响较大。

图3 不同植物群落下土壤理化性质变化Fig.3 Soil physicochemical properties of different plant communities
表2 不同植物群落下土壤酶活性与理化性质的相关性分析
Table 2 Correlation coefficients between soil enzyme activities and soil physicochemical properties of different plant communities

群落Community月份Month酶活性Enzyme activity有机质Organic matter全氮TN全磷TP全盐 Total salt土壤含水量Soil moisture土壤温度Soil temperaturepH铵态氮Ammonium N硝态氮Nitrate NS-C5月过氧化氢酶0.991∗∗0.5540.649∗-0.649-0.951∗0.974∗∗-0.5700.7860.960∗∗May磷酸酶 0.717∗0.0110.788-0.621-0.7810.549∗0.2880.5310.590∗脲酶 0.990∗0.599∗0.610∗-0.985-0.982∗∗0.954∗∗-0.4770.8420.981∗∗8月过氧化氢酶0.759∗0.721∗0.820∗-0.289∗-0.701-0.841-0.9220.954∗0.763August磷酸酶 0.876∗0.7810.948∗-0.299∗-0.877-0.904-0.7890.919∗0.848脲酶 0.910∗0.911∗0.974∗-0.971∗-0.919∗-0.981∗∗-0.8280.897∗0.87411月过氧化氢酶0.956∗0.884∗0.414-0.299-0.988∗0.932∗0.8550.6320.785∗∗November磷酸酶 0.5670.909∗0.372∗-0.696-0.8310.932∗-0.6550.2110.929∗脲酶 0.7810.993∗0.242∗-0.509-0.947∗0.757-0.2170.3130.923∗SS5月过氧化氢酶0.715∗0.7010.663∗-0.896-0.940∗0.8140.9380.875∗∗0.463May磷酸酶 0.909∗0.7140.657∗-0.545-0.946∗0.8780.2930.679∗∗0.336脲酶 0.903∗0.696∗0.633∗0.499-0.930∗0.9750.8070.908∗0.778月过氧化氢酶0.8080.8650.538∗0.291-0.983∗-0.950∗-0.9380.940∗0.854August磷酸酶 0.6920.956∗0.435∗0.983-0.915∗-0.984∗-0.4930.924∗0.622脲酶 0.5790.978∗∗0.645∗0.972-0.848-0.952∗-0.8910.925∗0.54211月过氧化氢酶0.575∗∗0.8220.3010.2850.1820.732∗∗-0.2810.3640.014November磷酸酶 0.317∗∗0.7560.411∗∗0.1470.0670.532∗-0.2410.3560.179脲酶 0.804∗0.8830.819∗0.1540.1020.787∗∗0.1220.2450.170HY5月过氧化氢酶0.908∗0.6050.798∗-0.832-0.927∗0.844∗-0.5980.966∗0.587May磷酸酶 0.895∗0.3700.835∗-0.816-0.8350.977∗-0.6940.845∗∗0.301脲酶 0.932∗0.5100.851∗-0.845-0.911∗0.950∗-0.5770.931∗0.4718月过氧化氢酶0.924∗0.938∗0.839∗-0.943-0.905∗-0.579∗∗-0.7600.3320.564August磷酸酶 0.952∗0.897∗0.720-0.942-0.815-0.965∗-0.3800.4050.703脲酶 0.953∗0.874∗0.654-0.934-0.734-0.947∗0.8340.4200.78311月过氧化氢酶0.639∗0.962∗∗0.529∗-0.706-0.945∗0.904∗0.8440.8550.902∗November磷酸酶 0.970∗0.889∗0.694∗-0.899∗-0.8380.919∗0.4300.676∗0.980∗脲酶 0.822∗0.964∗∗0.595∗-0.866-0.522∗0.724∗0.6200.987∗0.592LW5月过氧化氢酶0.931∗0.901∗0.798-0.487-0.941∗0.746∗-0.4880.975∗0.692May磷酸酶 0.964∗0.922∗0.810-0.796∗-0.934∗0.914∗-0.1980.9900.732脲酶 0.6740.477∗0.629-0.106-0.5420.699-0.4780.4940.904∗8月过氧化氢酶0.942∗0.8510.946∗-0.597∗0.932∗0.804-0.488∗0.7370.472August磷酸酶 0.923∗0.987∗∗0.638-0.6890.923∗0.988∗-0.326∗0.986∗0.880∗脲酶 0.996∗0.932∗0.856-0.3990.973∗0.895∗-0.255∗0.8620.64711月过氧化氢酶0.688∗0.8710.868∗-0.468∗-0.992∗0.398∗-0.4530.993∗0.709∗November磷酸酶 0.839∗0.925∗0.875∗0.398∗∗-0.982∗∗0.628-0.8130.8780.895∗脲酶 0.709∗0.665∗0.735∗0.154∗-0.7290.472∗∗0.1820.4670.798
S-C、SS、HY、LW植物群落样本量n分别为:45、30、60、60
表3 梭梭-柽柳、梭梭群落下土壤理化性质对土壤酶活性的通径系数
Table 3 Path coefficient of soil physicochemical properties affecting soil enzyme activities of Haloxylon-Tamarix andHaloxylonammodendronplant communities
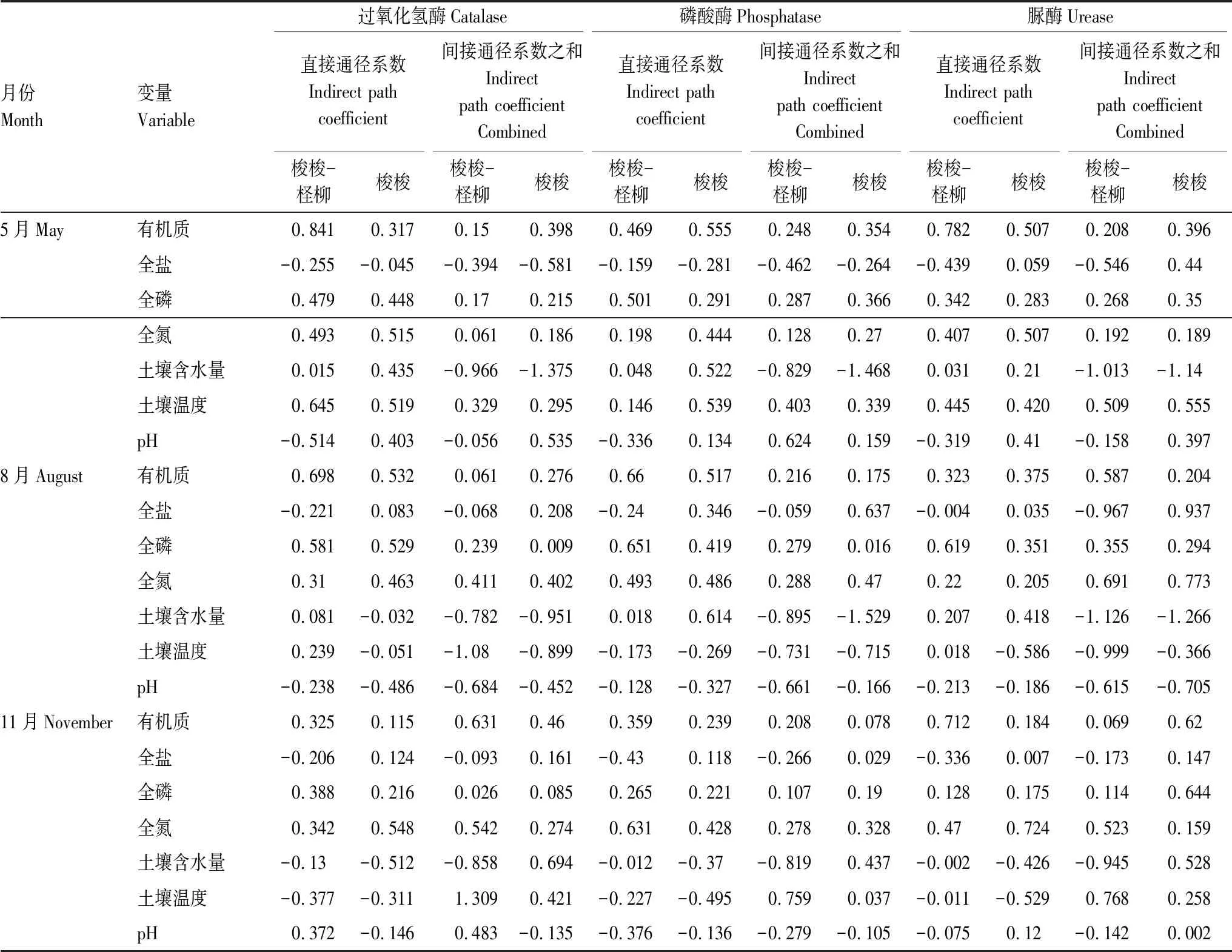
月份Month变量Variable过氧化氢酶Catalase磷酸酶Phosphatase脲酶Urease直接通径系数Indirect path coefficient间接通径系数之和Indirect path coefficient Combined直接通径系数Indirect path coefficient间接通径系数之和Indirect path coefficient Combined直接通径系数Indirect path coefficient间接通径系数之和Indirect path coefficient Combined梭梭-柽柳梭梭梭梭-柽柳梭梭梭梭-柽柳梭梭梭梭-柽柳梭梭梭梭-柽柳梭梭梭梭-柽柳梭梭5月May有机质0.8410.3170.150.3980.4690.5550.2480.3540.7820.5070.2080.396全盐-0.255-0.045-0.394-0.581-0.159-0.281-0.462-0.264-0.4390.059-0.5460.44全磷0.4790.4480.170.2150.5010.2910.2870.3660.3420.2830.2680.35全氮0.4930.5150.0610.1860.1980.4440.1280.270.4070.5070.1920.189土壤含水量0.0150.435-0.966-1.3750.0480.522-0.829-1.4680.0310.21-1.013-1.14土壤温度0.6450.5190.3290.2950.1460.5390.4030.3390.4450.4200.5090.555pH-0.5140.403-0.0560.535-0.3360.1340.6240.159-0.3190.41-0.1580.3978月August有机质0.6980.5320.0610.2760.660.5170.2160.1750.3230.3750.5870.204全盐-0.2210.083-0.0680.208-0.240.346-0.0590.637-0.0040.035-0.9670.937全磷0.5810.5290.2390.0090.6510.4190.2790.0160.6190.3510.3550.294全氮0.310.4630.4110.4020.4930.4860.2880.470.220.2050.6910.773土壤含水量0.081-0.032-0.782-0.9510.0180.614-0.895-1.5290.2070.418-1.126-1.266土壤温度0.239-0.051-1.08-0.899-0.173-0.269-0.731-0.7150.018-0.586-0.999-0.366pH-0.238-0.486-0.684-0.452-0.128-0.327-0.661-0.166-0.213-0.186-0.615-0.70511月November有机质0.3250.1150.6310.460.3590.2390.2080.0780.7120.1840.0690.62全盐-0.2060.124-0.0930.161-0.430.118-0.2660.029-0.3360.007-0.1730.147全磷0.3880.2160.0260.0850.2650.2210.1070.190.1280.1750.1140.644全氮0.3420.5480.5420.2740.6310.4280.2780.3280.470.7240.5230.159土壤含水量-0.13-0.512-0.8580.694-0.012-0.37-0.8190.437-0.002-0.426-0.9450.528土壤温度-0.377-0.3111.3090.421-0.227-0.4950.7590.037-0.011-0.5290.7680.258pH0.372-0.1460.483-0.135-0.376-0.136-0.279-0.105-0.0750.12-0.1420.002
表4 胡杨、芦苇群落下土壤理化性质对土壤酶活性的通径系数
Table 4 Path coefficient of soil physicochemical properties affecting soil enzyme activities ofPopuluseuphraticaandPhragmitesplant communities
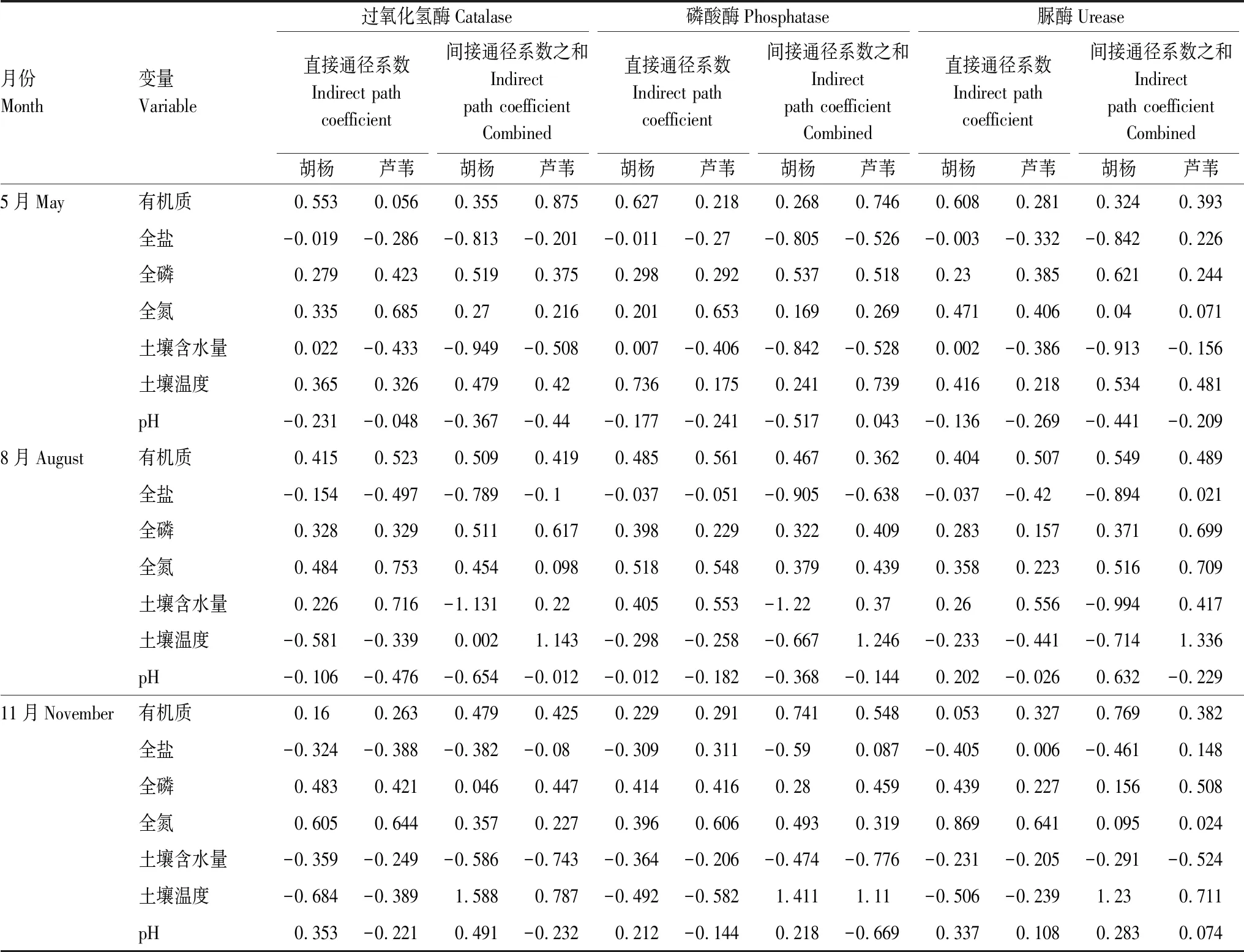
月份Month变量Variable过氧化氢酶Catalase磷酸酶Phosphatase脲酶Urease直接通径系数Indirect path coefficient间接通径系数之和Indirect path coefficient Combined直接通径系数Indirect path coefficient间接通径系数之和Indirect path coefficient Combined直接通径系数Indirect path coefficient间接通径系数之和Indirect path coefficient Combined胡杨芦苇胡杨芦苇胡杨芦苇胡杨芦苇胡杨芦苇胡杨芦苇5月May有机质0.5530.0560.3550.8750.6270.2180.2680.7460.6080.2810.3240.393全盐-0.019-0.286-0.813-0.201-0.011-0.27-0.805-0.526-0.003-0.332-0.8420.226全磷0.2790.4230.5190.3750.2980.2920.5370.5180.230.3850.6210.244全氮0.3350.6850.270.2160.2010.6530.1690.2690.4710.4060.040.071土壤含水量0.022-0.433-0.949-0.5080.007-0.406-0.842-0.5280.002-0.386-0.913-0.156土壤温度0.3650.3260.4790.420.7360.1750.2410.7390.4160.2180.5340.481pH-0.231-0.048-0.367-0.44-0.177-0.241-0.5170.043-0.136-0.269-0.441-0.2098月August有机质0.4150.5230.5090.4190.4850.5610.4670.3620.4040.5070.5490.489全盐-0.154-0.497-0.789-0.1-0.037-0.051-0.905-0.638-0.037-0.42-0.8940.021全磷0.3280.3290.5110.6170.3980.2290.3220.4090.2830.1570.3710.699全氮0.4840.7530.4540.0980.5180.5480.3790.4390.3580.2230.5160.709土壤含水量0.2260.716-1.1310.220.4050.553-1.220.370.260.556-0.9940.417土壤温度-0.581-0.3390.0021.143-0.298-0.258-0.6671.246-0.233-0.441-0.7141.336pH-0.106-0.476-0.654-0.012-0.012-0.182-0.368-0.1440.202-0.0260.632-0.22911月November有机质0.160.2630.4790.4250.2290.2910.7410.5480.0530.3270.7690.382全盐-0.324-0.388-0.382-0.08-0.3090.311-0.590.087-0.4050.006-0.4610.148全磷0.4830.4210.0460.4470.4140.4160.280.4590.4390.2270.1560.508全氮0.6050.6440.3570.2270.3960.6060.4930.3190.8690.6410.0950.024土壤含水量-0.359-0.249-0.586-0.743-0.364-0.206-0.474-0.776-0.231-0.205-0.291-0.524土壤温度-0.684-0.3891.5880.787-0.492-0.5821.4111.11-0.506-0.2391.230.711pH0.353-0.2210.491-0.2320.212-0.1440.218-0.6690.3370.1080.2830.074
3 讨论
3.1 艾比湖湿地不同植物群落下土壤酶活性差异分析
艾比湖湿地西北、东南、东北和西南部土壤分别为盐土、重度盐化和中度盐化,盐分梯度的差异使4个区域形成了旱生、盐生、沙生及湿生为主的植被群落[30],不同的植被群落导致枯枝落叶、根系分泌物、生物数量有所不同,进而导致酶活性大小的差异。芦苇群落酶活性最大,梭梭-柽柳群落酶活性最小,主要是因为芦苇群落所在的西南部土壤盐分为中度盐化,引水围堰生态修复后土壤的盐渍化降低[31],芦苇的覆盖度及根系分泌物增多,腐殖质层厚度增加导致土壤有机质的输入量增加,酶促底物更加充分;梭梭-柽柳群落岩质荒漠分布较广,土壤贫瘠,盐渍化程度达到盐土,土壤高盐分对植物生长和土壤质量产生不良的影响[32],同时植被稀疏且临近阿拉山口,风沙肆掠严重,不利于有机质的累积,从而导致酶活性低于其他群落,因此不同植物群落下酶活性随着盐分梯度的增加而减小,当达到盐土时对酶活性的胁迫作用最明显。其中,艾比湖湿地不同月份土壤磷酸酶活性远低于洞庭湖和梁子湖湿地酶活性[33- 34],这可能是艾比湖湿地与二者的气候、植物覆盖度、土壤pH的变化范围以及磷素含量等影响因子的差异有关;同时,土壤磷酸酶也低于高寒沼泽湿地[14, 35],这可能是二者的养分含量存在差异。与鄱阳湖淡水湖泊湿地、云南高原湿地、杭州湾潮滩湿地及人工湿地相比[36- 39],艾比湖湿地土壤脲酶活性较低,这可能是由于前者土壤以草甸土、泥炭土为主,土壤肥力高,酶促底物丰富,加之土壤水热条件较好,而艾比湖土壤发育程度较低、微生物数量少,所以酶活性较低。通过对4种植物群落土壤酶活性变异系数的对比发现,3种酶活性的变异系数均超过10%的敏感界限,但过氧化氢酶、脲酶对土壤环境介质的变化更为敏感,磷酸酶活性相对较为稳定,这与何东进、罗来超等[40- 41]发现脲酶活性变异程度最大的研究结果不一致,可能与酶的生存环境、农业施肥的影响有关。通过分析发现,艾比湖湿地4种植物群落下盐分梯度的变化使酶活性空间差异明显且酶活性低于其他湿地,因此运用酶活性指标预测其土壤质量变化及脆弱的环境演变时应与其他区域的评价标准有所不同[42]。
3.2 艾比湖湿地土壤盐分、水热及养分对土壤酶活性的影响
土壤酶活性的季节变化是对不同时期土壤理化特性的反映[43],不同季节土壤理化因子对酶活性的影响程度有所差别。不同植物群落下土壤盐分对酶活性呈现不同程度的抑制作用,一方面可能是土壤盐分的盐析作用通过破坏蛋白质分子结构、导致酶的水溶性降低,另一方面是土壤高盐分降低了土壤微生物的活性和数量,减少了其分泌酶的数量,从而抑制酶活性[44- 45]。各月的土壤有机质、全磷等养分因子对酶活性的直接和间接影响均较大,因为土壤酶活性与土壤养分含量及存在状况密切相关,较高的有机质可以改善土壤通透性、土壤容重及缓冲能力[46],为土壤酶的存在提供良好的土壤环境,同时有利于促进微生物的数量增加及生长代谢活动,因而酶活性较高。这与王改玲等[47]关于长期施肥对土壤酶活性影响的结果不一致,可能是由气候、土壤质地及人为影响程度的差异所造成的。芦苇群落8月份土壤含水量对酶活性有促进作用,在其他3种植物中8月份含水量对酶活性起到抑制作用;4种植物群落下5月份土壤温度均有利于酶活性的增加,而8月和11月不利于酶活性的增加,这种差异是由于土壤水热条件过高或过低会直接或间接影响土壤微生物的功能[48],不利于土壤动、植物的生长,减少土壤酶的来源,导致酶活性降低[5]。从5—8月土壤温度逐渐升高并达到最大,艾比湖湿地沙生或旱生植物覆盖度低,土壤含水量蒸发旺盛导致水分亏缺严重,湿生植物芦苇群落土壤含水量虽有减少但没有超过酶所需水分的阈值,这种差异导致土壤水分在不同的植物群落间对酶活性产生截然相反的作用。在梭梭-柽柳、梭梭和胡杨群落中土壤酶活性并没有出现温度最高的8月,这与刘彦杰等[49]对棉田土壤酶的研究结果有所差异,这可能与人为影响和土壤水热因子的变化范围有关。综上所述,艾比湖湿地不同植物群落下土壤盐分、养分对酶活性的影响较为显著,不同月份间土壤水热因子的影响大于其他因素。
4 结论
艾比湖湿地不同植物群落土壤酶活性在各月间变化明显,梭梭-柽柳、梭梭、胡杨群落3种酶活性为5月>8月>11月,而芦苇群落为8月>5月>11月;4种异质生境下盐分梯度使各植物群落下酶活性有明显变化,芦苇群落下土壤酶活性最大,梭梭-柽柳群落下酶活性最小。土壤有机质、全磷对酶活性的直接和间接影响均较大,5月土壤温度的升高利于酶活性的提高,而8、11月对酶活性有一定的抑制,植物类型的差异、时间变化导致土壤含水量对酶活性产生不同的影响,土壤盐分、有机质、全磷及水热因子是影响艾比湖湿地不同植物群落土壤酶活性的主导因子。
