UVB下调IFN-γ诱导的正常人角质形成细胞表面抗原的表达
2020-03-16朱健伟
朱健伟 骆 丹
1浙江医院皮肤科,浙江杭州,310013;2南京医科大学第一附属医院皮肤科,江苏南京,210029
正常人表皮角质形成细胞(KC)能低水平表达CD40、CD54以及MHC-II等重要的表面抗原,其中以CD40的炎症介导作用较为突出[1,2]。在皮肤炎症(如银屑病、特应性皮炎等)病理条件下,KC表面的CD40分子能被多种炎症因子如IFN-γ、IL-6、TNF-α等不同程度地上调,并与其趋化到表皮的T细胞表面的天然配体gp39相作用,加强KC炎症介质如IL-8、RANTES、MCP-1的释放和表面抗原CD54等的表达,进一步扩大炎症反应,即所谓的CD40/gp39途径[2]。以银屑病为例,CD40在银屑病皮损中显著表达,伴大量T细胞浸润,用CTLA4 Ig阻断T细胞的共刺激能逆转银屑病皮损中KC和内皮细胞的病理状态,使病情得到临床改善,并在连续性标本中见到CD40等表面抗原的表达显著下降[2,3]。此外,KC尚能自分泌具有较强免疫抑制作用的神经肽α-MSH,而UVB能诱导KC分泌α-MSH[4]。为进一步明确CD40是否参与介导KC的炎症反应,部分阐明UVB治疗炎症性皮肤病的可能机制,本研究以IFN-γ刺激KC,模拟炎症状态下KC的微环境,观察UVB对该环境下KC形态、活性、表面抗原CD40、CD54、MHC-II及炎症因子IL-8、IL-6、TNF-α表达的影响,并探讨UVB对KC产生α-MSH的时效性影响。
1 材料和方法
1.1 材料 二甲基亚砜(DMSO)、胰蛋白酶、分离酶、台式UVB照射仪均为美国Sigma公司产品。角质形成细胞无血清培养基(KC-SFM)购自美国Gibco公司。25 cm2塑料培养瓶、6孔和96孔培养板为美国Corning公司产品。噻唑蓝(MTT)为美国Amersco公司产品。FITC标记鼠抗人CD40、CD54、MHC-II等抗体、IL-8、IL-6和TNF-α ELISA试剂盒购自生工生物工程(上海)有限公司。α-MSH放免试剂盒购自瑞典Euro-Diagostica公司。重组人IFN-γ和可溶性CD40配体(sCD40L)均购自英国Peprotech公司。Clinibio128c酶联免疫检测仪系澳大利亚Clinibio公司产品。FACSCalibur流式细胞仪购自美国BD公司。DFM-96型16管放免γ计数器为众成公司产品。
1.2方法
1.2.1 细胞培养 取环切术后正常青少年包皮1块,碘伏浸泡5 min后PBS清洗,剪除皮下组织,然后把皮片剪成1 cm2的皮片置入含0.5%分离酶的PBS中4℃消化12~16 h,眼科剪小心分离表皮,采用0.25%胰酶(含EDTA 0.53 mmol/L)37℃消化表皮5~10 min,吸去胰酶,加入含10%小牛血清培养基终止消化,反复吹打,离心1000转10 min后弃上清,再用培养基吹悬细胞,以1×106个/cm2细胞密度接种于培养瓶,培养基为含50 mg/L BPE、5 μg/L EGF、100 U/mL青霉素和100 μg/mL链霉素的角质形成细胞无血清培养基(KC-SFM),37℃、5% CO2条件下培养20 h后更换新鲜培养基,去除未贴壁细胞。以后每3天换液1次,细胞传至3代用于实验。
1.2.2 实验分组 我们用多个浓度的IFN-γ(50, 100, 200, 300, 500, 1000 IU/mL)处理KC,并在不同时间点进行观察和标本收集,发现300 IU/mL的IFN-γ对KC的刺激作用较强,且无明显毒性,在作用72 h后刺激作用最佳;更高浓度的IFN-γ则对KC产生明显毒性,表现为增殖抑制,细胞凋亡增加。因此,我们选择了300 IU/mL的IFN-γ作为最终实验浓度。然后,将细胞以105个/cm2的密度接种于6孔板,待其生长贴壁并融合至80%后,分为空白组、300 IU/mL IFN-γ 处理72 h组、300 IU/mL IFN-γ处理72 h后再加100 ng/mL sCD40L孵育48 h组3组,每组重复3次,IFN-γ和sCD40L剂量及处理时间的设计参考文献[5]。然后在以上分组的基础上再分设照光组和非照光组,照光组以30 mJ/cm2的生理剂量UVB进行照射,以模拟表皮对UVB的反应[6]。第3组的照光组在照光结束24 h后再加入sCD40L孵育。
1.2.3 KC的形态学观察 用倒置光学显微镜(奥林巴斯,CH型)观察IFN-γ处理72 h前后细胞形态学的变化,以及IFN-γ处理后再用30 mJ/cm2UVB照射后细胞形态学的改变。
1.2.4 细胞活性的测定 采用MTT法,将细胞按空白组、300 IU/mL IFN-γ处理72 h组、30 mJ/cm2UVB组、300 IU/mL IFN-γ 处理72 h+30 mJ/cm2UVB组接种于96孔板,第3、4两组均在照光后24 h进行测定。每组设8个复孔。待细胞贴壁后,按上述分组对细胞进行处理,然后每孔(含100 mL培养基)加入20 mL浓度为5 mg/mL的MTT,孵育4 h,弃去上清,加入等量二甲基亚砜(DMSO)溶解,室温下振荡15 min,酶联免疫检测仪测定各孔在490 nm处吸光值(A值)。
1.2.5 KC表面抗原的测定 用0.25%胰酶消化和收集未照光及照光24、48、72 h后的细胞于1 mL的EP管中,用PBS洗涤2次,离心弃上清液,每管加入FITC标记的CD40单抗10 μL,重复的两组细胞分别加入CD54和MHC-II单抗各10 μL,常温避光作用20 min,然后再用PBS洗涤3次,离心后加入250 μL含1.5%多聚甲醛的PBS,4℃固定15 min,混匀后进行流式细胞术测定。加有sCD40L孵育的各组只测CD54和MHC-II。
1.2.6 上清液中α-MSH浓度的测定 采用放射免疫法(RIA),样本不与ACTH、β-MSH及γ-MSH交叉。样本分空白组、300 IU/mL IFN-γ组及30 mJ/cm2UVB等3组,分别在0、24、48、72和96 h提取上清。检测时,首先配备α-MSH标准品,浓度按说明书。吸取各浓度标准品、样本及对照各100 μL加入塑料离心管(NSB管的标准品浓度为0),然后加200 μL抗α-MSH抗体于所有管中(NSB和TOT管除外),同时加200 μL稀释液于NSB管中,旋涡混合后4℃存放24 h。各管加入200 μL 125I-α-MSH,再次旋涡混匀后4℃存放24 h。加500 μL的二抗-PEG于除TOT管的所有管中,旋涡后4℃反应45 min,离心弃上清,在γ台检测沉淀物的放射活性。
1.2.7 上清液中IL-6、IL-8、TNF-α浓度的测定 收集各实验组细胞上清液,按照ELISA说明书严格操作,测定上清液中IL-6、IL-8、TNF-α的含量。
1.2.8 统计学方法 采用SPSS 17.0统计软件对实验数据进行t检验和方差分析。
2 结果
2.1 KC的形态学观察 细胞呈鹅卵石状,表面光滑,少数细胞可见微小突起。IFN-γ处理72 h后,细胞密度增高,大部分细胞表面可出现微小突起。弃去含IFN-γ的培养基,再用30 mJ/cm2UVB处理该细胞24 h后发现,细胞逐渐恢复初始形态,细胞密度降低(图1)。
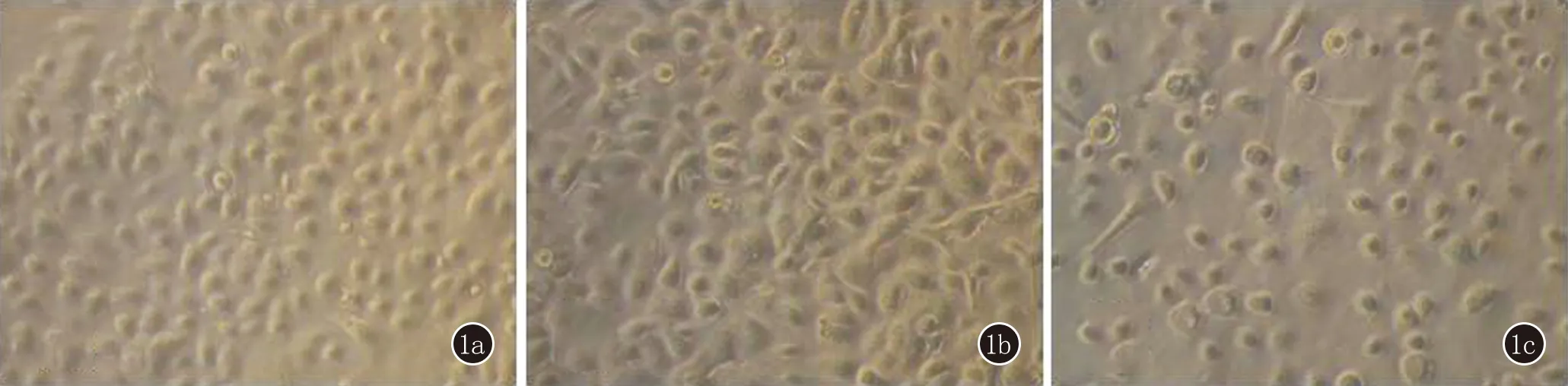
图11a:为正常人角质形成细胞形态;1b:为IFN-γ刺激72 h后的角质形成细胞形态;1c:为IFN-γ刺激72 h后再用30 mJ/cm2UVB处理24 h后的角质形成细胞形态
2.2 MTT测定结果 单用IFN-γ处理KC 72 h后,其活性较对照组明显增强(P<0.05);30 mJ/cm2UVB处理细胞24 h后,细胞活性较空白对照组略低;而IFN-γ处理72 h再用UVB处理细胞24 h后,发现细胞活性急剧下降,A值从4.02降至1.31,差异具统计学意义(P<0.01)。见图2。
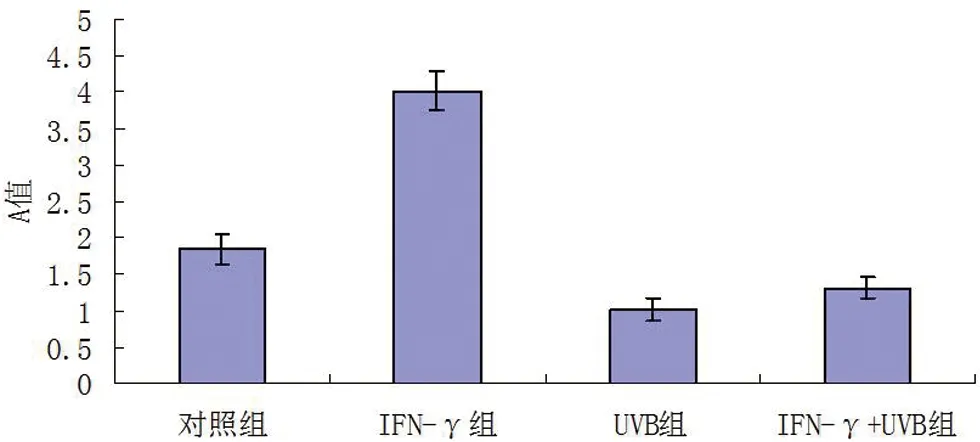
图2 各处理组的角质形成细胞活性(MTT法)
2.3 KC表面抗原测定结果 各处理组KC表面抗原的表达情况见表1。对照组细胞CD40的表达率为(7.68±2.14)%,即KC表面有少量CD40的表达。经IFN-γ刺激72 h后,其表达率显著提高(P<0.01),为(91.36±2.92)%。IFN-γ刺激后的细胞再经30 mJ/cm2UVB照射后,其CD40表达率逐渐下降(图3a),至72 h为(30.84±3.36)%。另外,同时可测得正常细胞CD54表达率为(4.45±0.61)%,IFN-γ刺激72 h后其表达率为(12.07±0.87)%,当IFN-γ刺激72 h再加入sCD40L后,CD54的表达率进一步增高,为(80.47±6.11)%,而IFN-γ刺激72 h后的细胞加用30 mJ/cm2UVB处理24 h后,再加sCD40L孵育48 h,发现CD54的表达率虽仍高于对照组和未经sCD40L配基化的IFN-γ处理组,但较未照光的IFN-γ处理组大为下降(图3b)。加入sCD40L后,细胞表面CD54的表达上调具有CD40特异性,它能被sCD40L特异性抗体所阻断。IFN-γ还能上调KC表面MHC-II分子的表达,UVB亦能下调IFN-γ诱导的MHC-II分子的表达,但加入sCD40L后其表达无明显变化。
表1 各处理组KC 3种表面分子的表达情况
注:N表示未检测。与对照组相比, 1)P<0.01;2)P<0.05。涉及UVB组均在照射后72 h后检测
2.4 上清液中α-MSH测定结果 各组上清液中α-MSH的测定结果见图4。可见,KC能低水平分泌α-MSH,经UVB照射后,其分泌量在24 h内升高,48 h时差异具统计学意义(P<0.05),72 h达高峰(P<0.01),96 h后骤降为基础水平。IFN-γ不影响α-MSH的表达(P>0.05)。
2.5 上清液中细胞因子测定结果 IFN-γ刺激后的KC与sCD40L孵育48 h后,IL-8的释放量最高(P<0.01)。而IFN-γ刺激后的KC用UVB照射后再与sCD40L孵育,IL-8的分泌量大为下降(P<0.05)。而TNF-α、IL-6的浓度无明显变化(P>0.05)。见表2。
表2 各处理组KC IL-8、TNF-α及IL-6的分泌情况
注:与对照组相比, 1)P<0.01;2)P<0.05。涉及UVB组均在照射后72 h后检测

图3各处理组细胞表面CD40、CD54的流式测定结果 3a:峰1示对照组CD40表达,峰2示IFN-γ处理72 h后的CD40表达,峰3示IFN-γ处理后再用30 mJ/cm2UVB 照射后72 h的CD40表达;3b:峰1示对照组CD54表达,峰2示IFN-γ 72 h+sCD40L 48 h 后的CD54 表达,峰3示IFN-γ 72 h+UVB 24 h+sCD40L 48 h后的CD54表达图4各处理组α-MSH浓度变化
3 讨论
在多种免疫性皮肤病,T细胞和KC处于激活状态。激活状态下的KC表面CD40分子和T细胞表面的gp39相结合被认为参与了这类皮肤病的发病。Pasch等[2]采用免疫组化检测了银屑病患者皮损和非皮损部位CD40和gp39的分布。结果显示,皮损和非皮损部位均有CD40+的KC集落。在皮损处可见大量T细胞,gp39+T细胞可见于70%的皮损中,而在非皮损部位,gp39+T细胞只占20%。他们还发现,经IFN-γ处理的KC能释放少量IL-8、RANTES及MCP-1,用可溶性gp39与CD40结合后能大大加强其释放。在特应性皮炎患者,树突状细胞(DCs)表面的CD40配体很可能就是与KC表面的CD40相结合,致使炎症的持续发生[7,8]。在接触性超敏反应中,KC表面CD40分子的专一性结合加剧和延长了皮肤免疫反应,CD40分子能在体内放大皮肤和区域T细胞应答[9]。以上均说明CD40/gp39是炎症启动的重要途径。
本研究证实,正常人KC能低水平表达CD40、CD54、MHC-II分子,IFN-γ能增强KC的活性,并加强其表面这3种抗原的表达,30 mJ/cm2UVB照射对NHK的形态、活性及其表面抗原的表达无明显影响,但能抑制IFN-γ诱导的细胞增殖和活性的增强及其表面抗原的过表达,该抑制效应在照射后72 h达高峰。我们还发现,CD54的表达确实具有CD40特异性,因为加入sCD40L孵育后,CD54的表达进一步升高,而MHC-II没有出现这一情况,这说明CD54的过表达主要是通过CD40/gp39途径所介导。此外,我们定量测得UVB照射能促进KC自分泌产生一种具有免疫抑制作用的神经肽α-MSH,其分泌具有一定时间依赖,在UVB照后24 h开始升高,72 h达高峰,96 h骤降为基础水平。细察可发现,α-MSH分泌水平与细胞表面CD40表达率刚好呈相反趋势,在UVB照后72 h,α-MSH分泌量达高峰的同时,细胞表面CD40的表达率达最低。因此,我们推测UVB很可能是通过诱导KC产生α-MSH,间接地下调了炎症因子诱导的细胞表面CD40等分子的表达,从而干预了CD40/gp39途径对炎症的启动。另外,表1、2的结果还证实CD54的高表达及IL-8的大量释放促使了炎症反应的持续发生,这种情况至少部分由CD40/gp39途径启动,因此,只要细胞处于CD40/gp39激活状态,UVB就能抑制该途径而降低皮损中CD54和IL-8的表达水平。此外,UVB能加强KC IL-8的产生,其实这种产量与前者相比是微乎其微而且是暂时性的。
总之,在一些免疫性皮肤病的炎症反应中,多种炎症细胞因子(如IL、IFN、TNF等)能上调KC表面CD40的表达,同时趋化T细胞和DCs聚集并使其表达CD40配体即gp39,致使CD40/gp39相互作用,引起一系列免疫应答。UVB照射能下调炎症细胞因子诱导的CD40的表达,是CD40/gp39途径的一项重要干预手段。
