miR-709靶向调控IGF 1基因的表达
2020-03-13李常红赵寒冬程云云郝林琳滕肇慧白城师范学院生命科学学院吉林白城7000长春农业博览园吉林长春07吉林大学动物科学学院长春0000大连摩格生物科技有限公司辽宁大连
李常红,赵寒冬,程云云,郝林琳,滕肇慧 (.白城师范学院 生命科学学院,吉林 白城7000;.长春农业博览园 吉林 长春07;.吉林大学 动物科学学院 长春0000;4.大连摩格生物科技有限公司 辽宁 大连
116023)
动物的生长是一个复杂的生物代谢过程,受多种因素的影响,包括环境变化、营养供给、遗传基因、激素调节等。各种因素对生长的调节最终是通过下丘脑-垂体-胰岛素样生长因子1(insulin-like growth factor 1,IGF1)生长轴来调控实现的[1-3]。据报道GH 是1种由垂体合成分泌的单一肽类激素,其呈脉冲式释放后主要与肝细胞表面的GHR 结合,经过JAK2/STAT5途径激活下游信号传导和靶基因转录[4],产生IGF1。IGF1与IGF1R 结合后通过多种信号通路而发挥促进生长和调节代谢的作用。
microRNAs(miRNAs)作为一类在转录后水平调节靶基因表达的非编码小RNA 分子,在动物体内主要是通过靶向m RNA 的3′UTR 发挥作用。它们通过这种方式参与调控大量生物功能和进程,如发育、分化、代谢、生长、增殖和细胞凋亡,近年来它们成为分子和细胞生物学领域研究的热点。miRNAs的研究在各领域都取得了重要的进展,人们对miRNAs的研究也更加深入。哺乳动物miRNAs的研究已经涉及多个组织/器官,关于垂体miRNAs的研究也取得了一些重要进展。
研究表明,大量非编码RNAs参与调控IGFs的表达进而影响机体生理和病理效应。LIU 等[5]研究发现,出生后70 d猪肝脏中IGF1的表达水平是胚胎70 d时的26.6倍,并从miRNA 调控方面探讨了猪不同发育阶段肝源性IGF1差异表达的原因,结果发现miR-18b 和miR-130b-3p 可能是导致IGF1在不同发育阶段肝脏中表达差异的部分原因。KAMRAN 等[6]证实在青少年时期,miR-29的高表达降低了多种促进生长基因(包括肝脏IGF1)的表达,从而导致生长发育缓慢。IGF1 是肝细胞癌中的1个关键基因,也是肝癌组织与正常组织相比上调最多的基因之一,miR-379通过靶向其受体基因IGF1R并抑制其表达,促进肝癌细胞的凋亡[7]。研究发现miR-511通过靶向猪IGF1基因,降低IGF1表达水平及相关通路因子(MAPK/ERK 及PI3K/Akt)的表达,并抑制PK-15细胞的增殖、促进其凋亡[8]。大量研究表明垂体中miRNAs与动物生长调控密切相关,ZHANG 等[9]通过microarray检测了大鼠垂体中的miRNAs,其中miR-709在大鼠垂体中高表达且可能参与生长调控过程。因此,本研究旨在明确垂体miR-709 与关键生长调控因子IGF1的靶向关系及对IGF1基因表达的影响。
1 材料与方法
1.1 细胞系所用HEK-293T 细胞系由吉林大学李占军教授馈赠,大鼠肝癌细胞H4-Ⅱ-E 为本实验室保存细胞系。
1.2 菌株及载体所用E.coli感受态细胞为DH5α,所用载体为psi-CHECKTM-2双荧光素酶报告基因表达载体,由吉林大学动物科学学院欧阳红生课题组馈赠。
1.3 主要试验仪器、试剂及耗材所用主要仪器列表如表1所示。
表1 主要试验仪器
限制性内切酶NotI(Ta KaRa)、XhoⅠ(Ta Ka-Ra),T4DNA 连接酶(TaKaRa),酵母提取物(OXOID),胰蛋白胨(OXOID),琼脂粉(OXOID),NaCl(北京化工),氨苄青霉素,Fu GENE®HD 转染试剂(PROMEGA),F12K 细胞培养基(GIBCO),Opti-MEM 培养 基(GIBCO),胎 牛 血 清(MCE),0.25%胰酶(GIBCO),PBS(博士德),谷氨酰胺(GIBCO),青链霉素双抗(GIBCO),丙烯酰胺(北京化工),N,N-亚甲基双丙烯酰胺(北京化工),过硫酸铵(北京化工),盐酸(北京化工),TEMED(BIOSHARP),甲醇(北京化工),蛋白酶抑制剂Cocktail(MCE),磷酸酶抑制剂Cocktail(MCE),无水乙醇(北京化工),双荧光素酶检测试剂盒(PROMEGA),无内毒素质粒小提试剂盒(Promega),凝胶回收试剂盒(天根),TRIzol(Ta KaRa),反转录试剂盒(Ta KaRa),荧光定量试剂盒(Ta KaRa)。试验所用离心管,移液吸头,细胞培养皿及细胞培养板等耗材均为BIOSHARP品牌。
1.4 细胞培养基配制H4-Ⅱ-E 细胞及HEK-293T 细胞培养基配制体系(表2)。

表2 H4-Ⅱ-E细胞及HEK-293T 细胞培养基配方
1.5 miRNAs合成所研究的miR-709 mimic序列(表3)由苏州吉玛生物公司合成,其中包括所用到的mimic的阴性对照(NC)。

表3 miR-709及NC的核苷酸序列
1.6 靶基因预测及载体构建采用在线软件TargetScan(http://www.targetscan.org)对miR-709的潜在靶基因进行预测,采用mfold(http://unafold.rna.albany.edu)对miR-709 与IGF1 基 因3′UTR 互补配对形成的RNA 二级结构进行预测。
为了检测目标miRNA 与潜在靶基因的靶关系,本试验构建了大鼠IGF1基因野生型(WT)、突变型(MUT)及删除型(DEL)3′UTR 双荧光素酶报告基因表达载体。首先合成了IGF1 基因的3′UTR 序列及对应的miR-709结合靶点突变及删除的3′UTR 序列,然后将其插入到psiCHECKTM-2的XhoⅠ和NotⅠ限制性内切酶酶切位点中间形成IGF1-3′UTR-WT、IGF1-3′UTR-MUT 和IGF1-3′UTR-DEL重组载体。
载体构建过程简述如下:psiCHECKTM-2 载体经XhoⅠ和NotⅠ限制性内切酶双酶切,酶切体系如表4所示,采用凝胶回收试剂盒进行回收,并分别用T4连接酶与合成的IGF1 基因3′UTR 片段在16℃条件下过夜连接,连接体系如表5所示,连接产物转化至大肠杆菌DH5α感受态细胞中,挑取单菌落,采用菌液PCR 法和测序法对连接产物进行鉴定。
1.7 无内毒素质粒提取及细胞转染将转化了IGF1基因3′UTR 重组载体的大肠杆菌于37℃扩大培养后,采用无内毒素质粒提取试剂盒提取质粒,测定质粒浓度后保存于-80℃备用。
本试验中的细胞转染包括miRNA 的转染和miRNA 与双荧光素酶表达载体的共转染。为了验证目标miR-709 与IGF1 基因的靶关系,将miRNAs与构建好的双荧光素酶表达载体共同转染至HEK-293T 细胞中,48 h后通过检测萤火虫荧光素酶及海肾荧光素酶的活性来确定miR-709与IGF1基因的靶关系;为了检测miR-709对IGF1表达的影响,将miR-709 转染至大鼠肝癌细胞H4-Ⅱ-E中,48 h后收集细胞进行总RNA 及总蛋白质的提取。

表4 载体双酶切体系

表5 目的片段与载体连接体系
1.8 双荧光素酶活性检测提前1 d 将4×104cells/well的HEK-293T 细胞接种于96孔细胞培养板,细胞转染之前使用100μL 新鲜的DMEM培养基漂洗细胞1次,并加入80μL DMEM 培养基预处理细胞2 h。psiCHECKTM-2重组质粒与miRNAs分别共转染HEK-293T 细胞,48 h 后按照双荧光素酶活性检测试剂盒说明书分别于多功能酶标仪检测萤火虫荧光素酶活性及海肾荧光素酶的活性。
1.9 总RNA提取、RNA反转录及q RT-PCR本试验采用TRIzol进行RNA 的提取,即将收集的转染后细胞加入至500~1 000μL TRIzol中,室温裂解10 min后,加入0.2倍TRIzol体积的氯仿进行萃取颠倒混匀,室温静置10 min后于4℃离心机中离心10 min,取上清加入0.5倍TRIzol体积的异丙醇进行RNA 的沉淀,室温静置5 min后于4℃离心机中离心10 min,弃掉上清后然后用75%的酒精洗涤沉淀,晾干,加入40μL无RNA 酶dd H2O 进行溶解,测定浓度后对其进行反转录。
对于miR-709,采用特异性颈环结构引物RT primer(表6)对所得总RNA 进行反转录;对于m RNA,则采用Oligod T 反转录引物进行反转录。qRT-PCR 结果采用2-ΔCt法进行分析,β-actin和U6分别作为IGF1和miR-709的内参基因。

表6 反转录及qRT-PCR 引物
以反转录得到的cDNA 为模板,以miR-709、U6、IGF1及β-actin(表6)为引物,以SYBR®Green为染料,进行实时荧光定量PCR。根据Power SYBR®Green PCR 说明书加反应体系:cDNA:2.0μL,2× Master Mix 10.0μL,上、下游引物各0.5μL,dd H2O:7.0μL。反应程序:95℃3 min;95℃15 s,57℃15 s,72℃20 s,40 个循环,在72℃采集荧光信号;溶解曲线程序:55℃,30 s,81个循环。
1.10 总蛋白质提取及浓度测定细胞转染48 h后采用Western blot及IP裂解液进行裂解,将细胞碎片离心后取上清;采用BCA 试剂盒对所提取的总蛋白质浓度进行测定。
1.11 Western blot检测在15%浓度SDS-PAGE分离胶上对总蛋白进行分离,经过转膜、封闭,然后于4℃进行IGF1和β-actin一抗过夜孵育及室温进行辣根过氧化物酶标记的羊抗兔二抗孵育2 h后在多功能分子成像系统中进行成像。
1.12 数据分析采用SPSS17.0进行数据分析,对于组间miR-709及IGF1表达水平差异采用单因素方差(ANOVA)分析,∗表示P<0.05为差异显著,∗∗表示P<0.01为差异极显著。
2 结果
2.1 miRNA mimic转染效率及miR-709表达量检测为了检测miRNA 在细胞中的转染效率,我们将FAM 标记的NC mimic转染至HEK-293T 细胞中,12 h 后在荧光显微镜下对其转染效率进行检测,结果显示,miRNA 在细胞中的转染效率较高(图1A,B),能够满足试验要求。然后为了进一步确定miR-709在大鼠肝脏细胞H4-Ⅱ-E 中的转染效率,本试验在转染miR-709 mimic及NC mimic 48 h后采用qRT-PCR 法对miR-709的表达量进行检测,结果显示miR-709 mimic组细胞中miR-709的表达量极显著高于对照组(图1C)(P<0.01)。

图1 miRNA 转染效率及miR-709表达量检测 A.miRNA在HEK-293T 细胞中的转染效率检测;B.阴性对照组;C.在H4-Ⅱ-E细胞中转染miR-709 mimic后miR-709的表达量检测
2.2 miR-709与IGF 1基因的靶关系鉴定基于生物信息学分析,miR-709的种子序列与IGF1 基因3′UTR 互补(图2A),且结合形成较稳定的二级结构(图2B)。IGF1基因3′UTR 的双荧光素酶重组表达载体(IGF1-3′UTR-WT、IGF1-3′UTR-MUT和IGF1-3′UTR-DEL)与miR-709 或NC 转 染 至HEK-293T 细胞后48 h,采用双荧光素酶活性检测试剂盒分别对萤火虫荧光素酶及海肾荧光素酶的活性进行检测,相对荧光素酶活性结果表明miR-709直接靶向IGF1基因(图2C)。
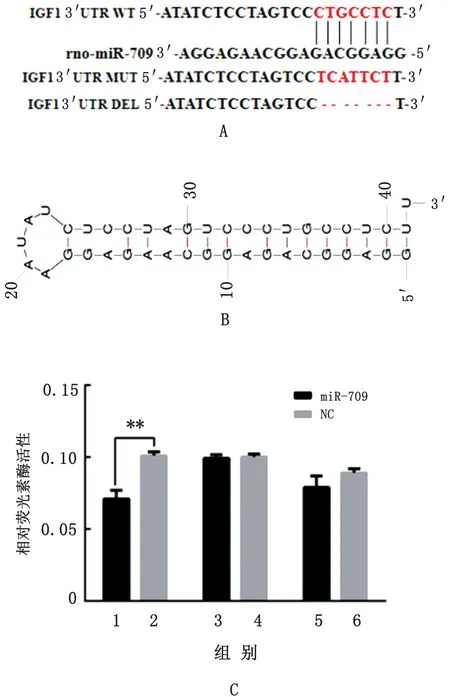
图2 miR-709 靶向IGF 1 基因A.miR-709 种子序列与IGF 1基 因3′UTR 互补配对情况;B.miR-709 与IGF 1基因3′UTR 形成的RNA 二级结构;C.miR-709靶向IGF 1基因的双荧光素酶活性检测结果;1,2.IGF1-3′UTR-WT;3,4.IGF1-3′UTR-MUT;5,6.IGF1-3′UTR-DEL
2.3 miR-709 对IGF 1 基因表达量的影响明确miR-709靶向IGF1基因后,本研究进一步将miR-709转染至大鼠肝脏细胞H4-Ⅱ-E 中,48 h后检测IGF1表达量。qRT-PCR 及Western blot检测结果表明miR-709 显著抑制了IGF1 RNA(图3A)(P<0.05)及蛋白质的表达水平(图3B,C)(P<0.05)。

图3 miR-709对IGF 1基因表达的影响 A.qRT-PCR 检测miR-709 对IGF 1 基因m RNA 表达的影响;B.Western blot检测miR-709对IGF 1基因蛋白质表达的影响;C.Western blot检测结果量化
3 讨论
在动物生长调控过程中,垂体发挥着至关重要的作用,其作用的垂体-IGF1-靶器官生长轴中IGF1是关键的中心环节。在血液循环和局部组织中,绝大部分IGF1 由肝脏提供,研究人员证实过表达IGF1的小鼠与野生型小鼠相比各器官重量显著增加,并表明IGF1参与到机体出生至青春期阶段的生长,且引起各器官体积成比例地增大[10]。反之,缺乏IGF1则会导致病人身材相对矮小[11],而这种现象可通过长期用IGF1治疗明显恢复[12]。此外,缺乏IGF1的胎鼠有短肢侏儒症,矿化延迟,慢性粒细胞凋亡增加的现象[13],表明IGF1的促生长作用贯穿出生前及出生后,也足以见得IGF1在动物生长中的重要性[14]。
miRNA 是1类长度为19~24 nt的非编码单链RNA,通过碱基互补配对的方式与靶基因的3′UTR部分或完全互补,剪切靶基因的转录产物或者抑制转录产物的翻译,从而起到转录后调控靶基因表达的作用。研究表明miRNA 与动物生长密切相关,表现为在肌肉发育的各个环节具有重要的调节作用,以及涉及骨骼肌卫星细胞的迁移、增殖、分化和凋亡,成肌细胞的分化和肌管融合,肌纤维类型转换等多个生物学过程[15]。目前已经在牛、猪、羊等家畜中鉴定到多个参与骨骼肌发育的 miRNAs[16-17]。近年来,组织/器官间的信息交流也逐渐成为研究热点,例如非编码RNA 可能通过外泌体等介质进行组织间的调控[18-19]。随着处于生长轴中心的垂体组织中miRNAs逐渐被挖掘,垂体miRNA 的功能也相继被报道[20-24]。miRNA 在细胞之间以及组织之间的表达具有特异性。有研究证实miRNA 在某一组织中的特异性高表达往往与该组织的一些典型功能相关。其中大鼠垂体中miR-7是表达量最高的miRNA,其可能参与到FSH 的表达调控,与动物繁殖性能相关[25-27]。而目前对于大鼠垂体中第二高表达的miR-709的功能研究较少,基于ZHANG 等[9]的研究结果可以推断miR-709可能参与动物的生长调控。因此,本研究基于生物信息学分析发现miR-709 可能靶向关键生长因子IGF1基因。
本研究通过双荧光素酶报告系统及IGF1表达量检测证实了miR-709 与IGF1 基因的靶关系及miR-709对IGF1表达量的抑制作用。试验结果表明H4-Ⅱ-E细胞中表达较低含量的IGF1,猜测原因可能是此细胞为大鼠肝癌细胞,属于肝脏受损细胞,因细胞功能缺失而导致的IGF1表达量较低。miR-709是在大鼠垂体组织中高表达的miRNA,IGF1在垂体GH 的合成中扮演的是负反馈调控因子。因此,推测miR-709 在调控垂体GH-IGF1 轴发挥的可能是平衡的作用,即维持垂体GH 表达的稳定性。
