铜对中国荷斯坦奶牛泌乳、肝脏铜代谢蛋白及相关酶基因表达的影响
2020-03-13付辑光高艳霞李秋凤曹玉凤张秀江李建国河北农业大学动物科技学院河北保定0700河北农业大学动物医学院河北保定0700保定市农业局河北保定07000
付辑光,高艳霞,李 妍,李秋凤,曹玉凤,张秀江,李建国∗ (.河北农业大学 动物科技学院,河北保定0700;.河北农业大学 动物医学院,河北 保定0700;.保定市农业局,河北 保定07000)
铜参与生物体所必需的许多生化过程,是生物体必需的微量元素[1]。缺铜会对动物的生长、泌乳、结缔组织发育与色素沉着造成影响[2],而饲喂高铜饲粮也会对机体造成损伤[3]。因此,深入研究饲粮铜对奶牛代谢的影响及机理,对泌乳牛饲粮中合理利用铜元素有重要意义。李毓雯等[4]给大鼠饲喂铜水平为1 g/kg的饲料,随着饲喂时间的增长,肝脏中组织凋亡基因Bax的表达量显著性升高,对肝脏造成严重损伤。LEE 等[5]报道,在阉牛饲粮中添加10~20 mg/kg铜能够促进皮下脂肪的脂类代谢,但对特定脂肪基因的表达无影响。SINCLAIR 等[6]提出,在以硫酸铜为铜源的饲粮中添加硫与钼会显著提高抗氧化蛋白1(ATOX1)m RNA 的表达量。HAN 等[7]对犊牛的研究表明,高于正常值的肝脏铜浓度与肝脏铜离子转出蛋白B(ATP7B)、铜-锌超氧化物歧化酶铜伴侣蛋白(CCS)与超氧化物歧化酶1(SOD1)mRNA 的表达呈负相关。高晨[8]研究表明,在鸡饲粮中添加160 mg/kg纳米氧化铜,空肠与回肠ATP7B m RNA 相对表达量显著升高。宋明明等[9]在雏鸡饲粮中添加不同铜源,在160 mg/kg铜添加水平下发现硫酸铜组ATP7B m RNA 相对表达量显著高于微米氧化铜组与纳米氧化铜组。但WARD 等[10]认为,只有饲粮中铜拮抗剂浓度较高时,使用有机铜的才会有作用。综上所述,前人对铜与机体健康、脂肪代谢以及铜相关基因之间的关系进行了研究,但对不同铜水平对奶牛铜相关基因影响的研究甚少,且结果不尽一致,有必要对此进行深入研究。本试验通过在饲粮中添加不同水平的铜,研究其对奶牛泌乳、肝脏铜代谢蛋白及相关酶基因表达的影响,为探讨铜对机体代谢的影响机理提供理论依据。
1 材料与方法
1.1 试验动物与试验设计试验在保定昊宇牧业公司奶牛场进行。选择60头健康无疾病泌乳中期的荷斯坦奶牛,采用单因子随机试验设计,随机分为4组,每组15头牛,各试验组组间平均胎次、产奶量与泌乳天数差异均不显著。以饲料级五水硫酸铜为铜源,各试验组在基础饲粮基础上分别添加0,10,15与20 mg/kg铜(表1),试验Ⅰ组(铜水平8.09 mg/kg)、试验Ⅱ组(铜水平18.09 mg/kg)、试验Ⅲ组(铜水平23.09 mg/kg)与试验Ⅳ组(铜水平28.09 mg/kg)。试验期90 d。
1.2 试验饲粮与饲养管理试验牛采用散栏饲养,自由采食与饮水,试验组将含有不同铜水平的预混料与精料混匀后再与粗饲料进行搅拌,混匀后分别饲喂。试验用预混料定制于北京福维康生物科技有限公司。
1.3 试验数据与样品采集
1.3.1 产奶量及乳样的采集 试验期间,每天记录日产奶量,每月采集1次奶样,早、中、晚各收集乳样60 m L,将1 d中的乳样按4∶3∶3比例混合均匀,用于乳成分的测定。
1.3.2 肝脏样品的采集与处理 试验结束后,每组随机选择3头试验牛,继续饲喂试验饲粮,采用肝脏活体采样法采样。在试验牛右侧倒数第2与3根肋骨间隙与右前肢肘关节至髋结节连线的交点上方2.5~3.5 cm 处,用采样器(长12.0~15.0 cm,内径3.0 mm)采取肝脏组织0.5~1.0 g,采集出的肝脏样品用生理盐水漂洗干净后用锡箔纸包好后迅速置于液氮中,运回实验室后转移到-80℃条件下冻存[12]。
1.4 样品的测定
1.4.1 乳成分的测定 用乳成分分析仪Milko-ScanTMMars(丹麦)检测乳脂率、乳蛋白率、乳糖率、非脂固形物(SNF)、乳总固形物与体细胞数。
1.4.2 引物的设计与合成 根据NCBI中报道的牛铜代谢相关基因序列与引物设计方法来设计引物,将β-actin作为管家基因,所有引物均由上海生工生物技术有限公司合成,其序列与参数见表2。
1.4.2 样品总RNA 的提取与检测 取50~100 mg的样品,按照TRIzol(Ambion,美国)试剂说明书提取肝脏组织中的总RNA,取少量RNA 与染色剂(Thermo,美国)混合,用1.2%琼脂糖凝胶进行电泳,电泳结束后将其放入凝胶成像系统Gel Image Sistem(SIM,美国)内观察结果。
1.4.3 cDNA 合成 根据QuantiTect反转录试剂盒(QIAGEN,德国)说明书对总RNA 进行反转录操作,将合成的cDNA放入-20℃冰箱中储存待测。

表1 基础饲粮组成及营养水平(干物质基础)

表2 基因引物序列
1.4.4 荧光定量PCR 根据试剂盒BIO RAD(美国)说明书进行操作,反应体系为20μL(表3)。

表3 RT-PCR 反应体系
反应条件:95℃预变性3 min,95℃变性15 s,60℃退火延伸,72℃40 个循环。通过RT PCR 仪(Eppendorf,德国)来获得Ct值,以β-actin为内参,用2-ΔΔCt法计算出m RNA 的相对表达量。
1.5 统计分析试验数据采用SPSS 19.0统计软件中ANOVA 过程进行单因素方差分析(one-way ANOVA,LSD),差异显著时用Duncan法进行各组间多重比较。以P<0.05为差异显著,以P<0.01为差异极显著。
2 结果
2.1 不同铜水平对奶牛泌乳性能的影响由图1可知,试验牛的产奶量随着饲粮铜水平的增加呈上升趋势,试验Ⅱ、Ⅲ与Ⅳ组产奶量显著高于试验Ⅰ组(P<0.05),但试验Ⅱ、Ⅲ与Ⅳ组之间的产奶量差异不显著(P>0.05)。
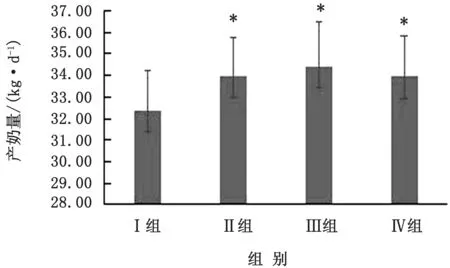
图1 不同饲粮铜水平对泌乳牛产奶量的影响 ∗.表示差异显著(P<0.05);∗∗.表示差异极显著(P<0.01)。下同
由图2可知,随着饲粮铜水平的增加,乳脂率与乳蛋白率呈先增高后降低的趋势,但各试验组之间差异不显著(P>0.05)。不同饲粮铜水平对各试验组乳糖率、SNF与乳总固形物的含量无影响(P>0.05)。
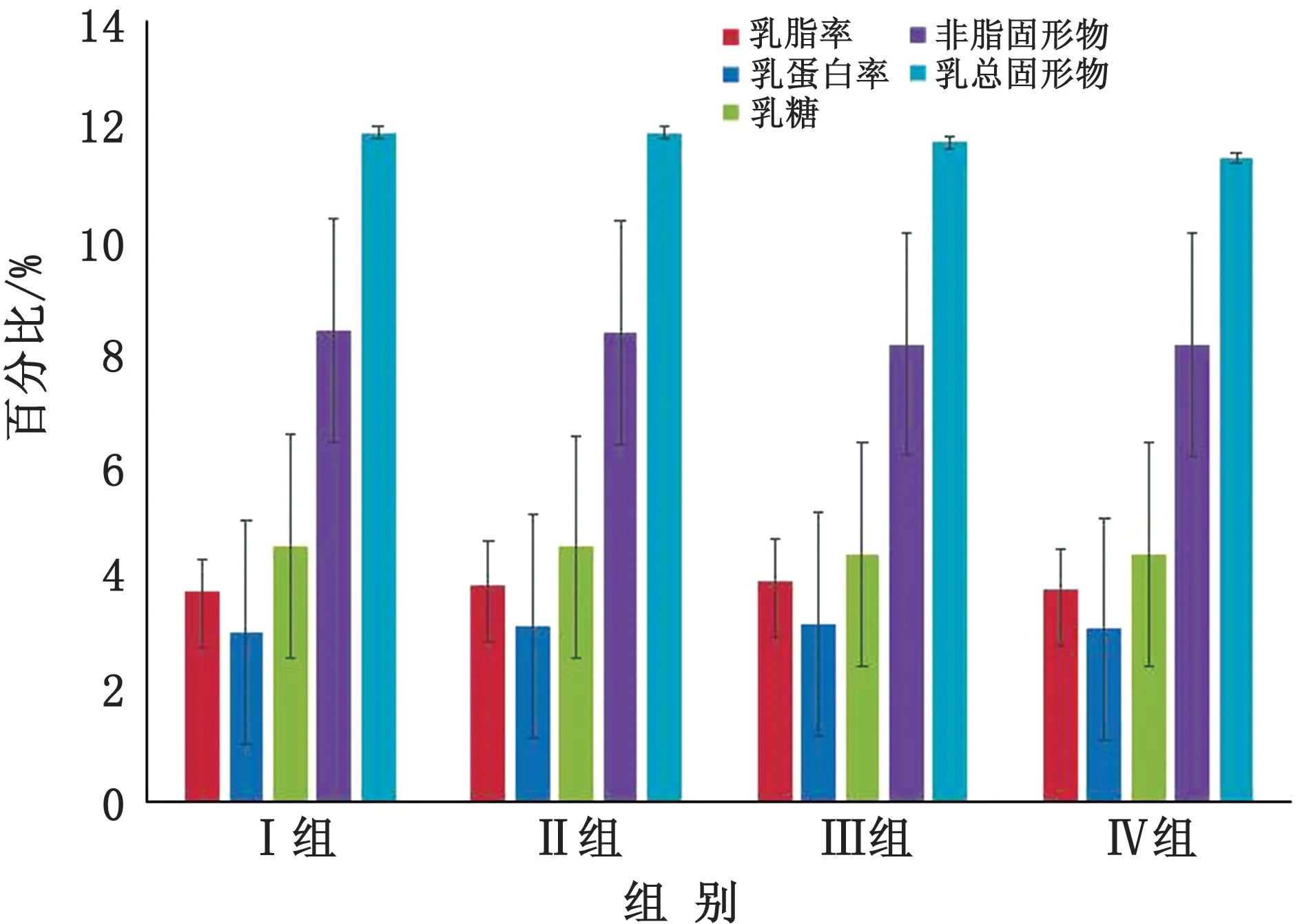
图2 不同饲粮铜水平对泌乳牛乳成分的影响
由图3可知,乳体细胞数随着饲粮铜水平的增加而降低,试验Ⅱ、Ⅲ与Ⅳ组的体细胞数极显著低于试验Ⅰ组(P<0.01),但试验Ⅱ、Ⅲ与Ⅳ组之间差异不显著(P>0.05)。

图3 不同饲粮铜水平对泌乳牛乳体细胞数的影响
2.2 肝脏中总RNA 的纯度与完整性检测奶牛肝脏中提取的总RNA 经NanoDrop2000检测,D260/D280均在1.9~2.1 之间。采用1.2%琼脂糖凝胶电泳检测后RNA 分子条带清晰、无DNA 污染、完整性好(图4)。

图4 泌乳牛肝脏总RNA 提取检测结果 1~3.Ⅰ组;4~6.Ⅱ组;7~9.Ⅲ组;10~12.Ⅳ组
2.3 饲粮铜水平对肝脏铜代谢相关基因相对表达量的影响
2.3.1 饲粮铜水平对铜转运基因相对表达量的影响 由表4可知,ATP7B与CP mRNA 相对表达量随着饲粮铜水平的增加逐渐增高,试验Ⅱ、Ⅲ与Ⅳ组ATP7B m RNA 相对表达量比试验Ⅰ组分别提高36%,63%与95%(P<0.01),CP m RNA 相对表达量的变化规律与ATP7B mRNA 相对表达量的变化规律一致。COMMD1 m RNA 相对表达量随着饲粮铜水平的增加呈先增高后降低的趋势,与试验Ⅰ组相比,试验Ⅱ组的COMMD1 mRNA 相对表达量提高了9%(P>0.05),试验Ⅲ与Ⅳ组分别降低54%与78%(P<0.01)。ATOX1、CCS 与CUTC m RNA 相对表达量各组之间差异不显著(P>0.05)。
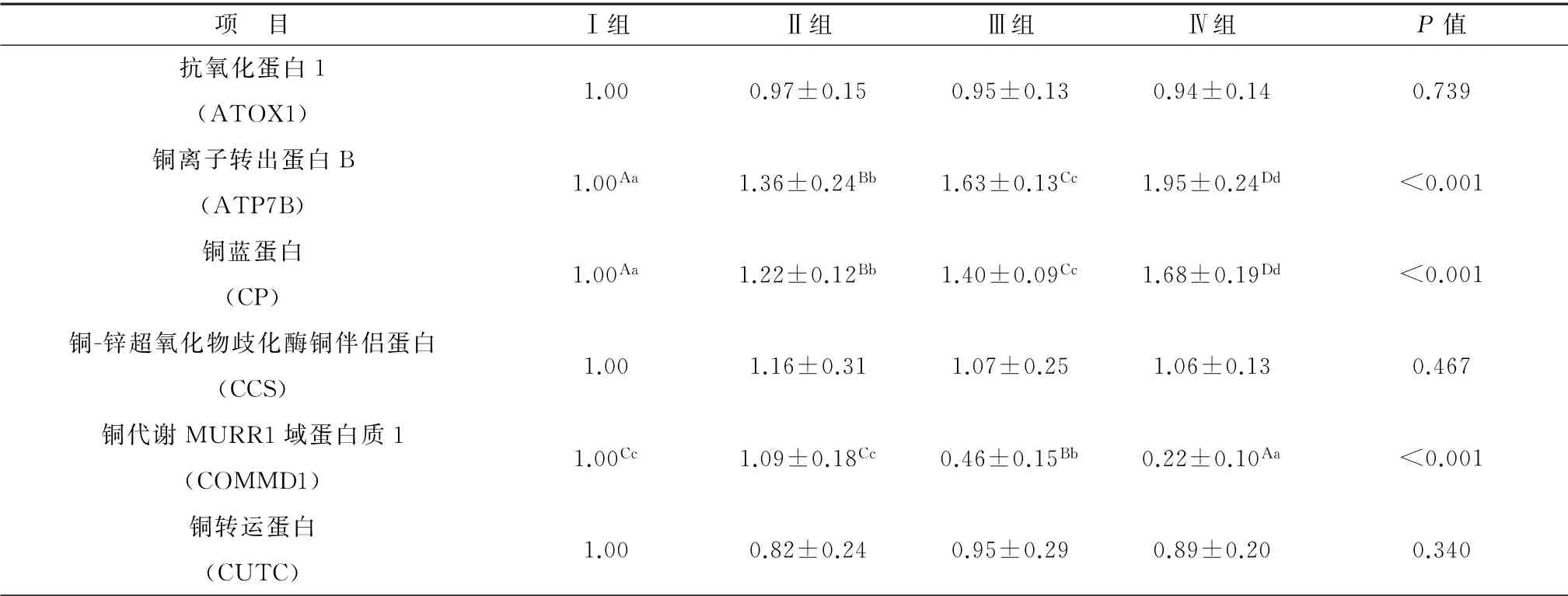
表4 铜对铜转运因子ATOX1、ATP7B、CP、CCS、COMMD1与CUTC m RNA 相对表达量的影响
2.3.2 饲粮铜水平对含铜酶基因相对表达量的影响 由表5 可知,随着饲粮铜水平的增加,SOD1 m RNA 的相对表达量呈上升趋势,与试验Ⅰ组相比,试验Ⅱ、Ⅲ与Ⅳ组分别提高20%,46%与59%(P<0.01)。LOX m RNA 的相对表达量随着饲粮铜水平的增加呈上升趋势,试验Ⅱ、Ⅲ与Ⅳ组比试验Ⅰ组分别提高15%(P<0.05),67%(P<0.01)与72%(P<0.01)。随着饲粮铜水平的增加,MAOA m RNA 的相对表达量呈上升趋势,试验Ⅱ、Ⅲ与Ⅳ组比试验Ⅰ组分别提高33%,38%与59%(P<0.01)。MAOB mRNA 的相对表达量随着饲粮铜水平的增加呈降低趋势,试验Ⅱ、Ⅲ与Ⅳ组比试验Ⅰ组分别降低24%,34%与60%(P<0.01)。
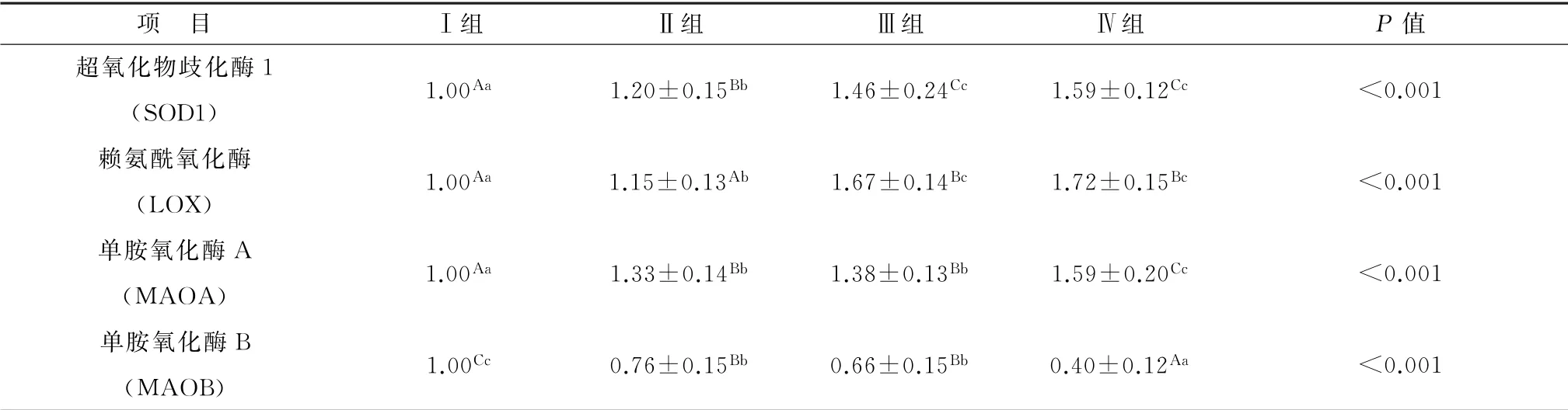
表5 铜对基因SOD1、LOX、MAOA 与MAOB m RNA 相对表达量的影响
3 讨论
铜主要在胃与小肠上段被吸收,经血液送至肝脏及全身,除一部分以铜蛋白形式储存于肝脏外,其余或在肝脏内合成铜蓝蛋白,或在各组织内合成过氧化物歧化酶、细胞色素C 氧化酶、酪氨酸酶与单胺氧化酶等。这些铜蛋白与铜酶在机体内参与清除自由基、电子转移、黑色素形成与神经递质形成等酶促反应,对稳定机体的平衡状态发挥着重要的生理作用[13]。铜虽然是氧化还原反应的辅助因子,但是体内的游离铜离子会催化过氧化氢与超氧化物阴离子转化为羟基自由基,这些羟基自由基会引起DNA、脂质与蛋白质的非特异性氧化[14-15]。铜对机体的两面性是因为铜既可以释放电子又可以接收电子,并负责细胞内超氧化物与其他活性氧的产生,即使在较低浓度的情况下也具有很强的毒性,因此动物机体对铜的吸收、分配与排出都要受到严格调控[16-17]。如果在细胞中进行的氧化还原反应不受控制,铜会对蛋白质、脂质与DNA 造成破坏与不可挽回的损伤[18-19]。
3.1 饲粮铜水平对泌乳性能的影响黄志秋等[20]研究表明,在泌乳牛饲粮中添加7.6 mg/kg铜,能使产奶量提高了4.85%~9.61%,但乳脂率却没有明显变化。刘明祥等[21]对分娩100~120 d的荷斯坦奶牛补饲铜,试验发现,在饲养120 d后,补铜组奶牛的奶产量比对照组提高3.30%。本试验结果显示,随着饲粮铜水平的提高,产奶量、乳脂率与乳蛋白率均有所提高,但饲粮铜水平为28.09 mg/kg 的试验Ⅳ组的产奶量与饲粮铜水平为23.09 mg/kg的试验Ⅲ组的产奶量相比反而有所下降,本试验结果与刘曦[22]的研究结果一致。这可能是因为奶牛对铜的需要量受其自身条件与外部条件的影响[23],在这些条件的约束下,会有一个适宜的铜需要量,而过高的饲粮铜水平会对奶牛机体造成负影响,从而对奶牛的生产性能造成负面影响。
3.2 饲粮铜水平对泌乳牛铜转运基因相对表达量的影响参与铜转运的铜伴侣蛋白之间通过相互协调确保铜离子被运送到特定区域而不被提前释放,这一功能在铜代谢与维持细胞铜稳态中发挥重要作用[24]。铜伴侣蛋白既能结合铜离子并协助运输铜离子至靶蛋白,又能通过完成细胞内铜的转运而维持胞质中铜离子的生理浓度。若铜伴侣蛋白合成不足,必定会引起铜代谢异常,导致疾病。ATOX1,CCS,ATP7B,COMMD1,CP与CUTC 都是重要的铜转运基因,这些铜伴侣基因的表达介导了细胞内铜的稳态。
ATOX1在细胞铜稳态中起着至关重要的作用。ATOX1捕获胞质中的铜,与铜结合后将铜转运到ATP酶上,随后在ATP酶的作用下将铜转移到反式高尔基网络的铜泵中,从而促使铜供应到靶细胞,用于铜依赖性酶的生成[25]。细胞内的铜浓度过高会诱导ATP 酶迁移,在ATP酶的作用下将多余的铜转运出细胞以维持胞内铜水平的稳定[26]。ATOX1蛋白不仅具有运输铜的作用,还有抗氧化损伤的功能[27]。SINCLAIR 等[6]研究表明,在以硫酸铜为铜源的饲粮中添加铜拮抗剂能提高肝脏ATOX1 mRNA 的表达量,但差异不显著;MULLER 等[28]在大鼠试验中发现,高铜对ATOX1 m RNA 表达量没有影响。本试验研究表明,ATOX1 m RNA 的相对表达量随着饲粮铜水平的增加有下降趋势,但各组差异不显著。这可能是因为随着饲粮铜水平的增加,铜代谢的其他途径被激活[29]。韩胜旗[30]通过对猪小肠上皮细胞进行体外培养试验发现,随着硫酸铜添加量的增加,ATOX1 m RNA表达量显著降低,与本试验结果不一致。这可能是因为不同铜水平下,体外培养细胞的基因表达情况与体内试验机体的基因表达情况存在差异,但需进一步研究证实。
CCS是铜伴侣蛋白家族中的一员[31],是将铜特异性地传递到胞液中抗氧化酶SOD1 上的专一蛋白[32],促使SOD1形成二硫键并将其激活[26]。CCS蛋白的这一特异性功能是因为其具有Ⅰ与Ⅱ2个结构域,在向SOD1传递铜时,结构域I的作用在铜充足条件下是微不足道的,但是在铜缺乏条件下却会发挥重要作用,这表明结构域I在有限铜的竞争中起着至关重要的作用。结构域Ⅱ是SOD1异二聚化所必需的,能够促进铜插入SOD1[33]。在对牛的研究中发现,铜缺乏可以引起牛的十二指肠、肝脏与红细胞中CCS蛋白含量显著提高[34]。本试验结果显示,饲粮中铜水平与CCS m RNA 相对表达量没有相关性。BERTINATO 等[35]对大鼠的研究表明,缺铜越严重CCS蛋白含量越高,而CCS m RNA 含量没有变化,与本试验结果一致。这可能是因为CCS蛋白水平增加是由于26S蛋白酶抑制了蛋白降解,而非由于m RNA 的高表达引起的[36]。
ATP7B 编码一种参与铜运输的P 型ATP酶[37],肝脏铜的输出主要经由2个途径:(1)ATP7B将肝脏细胞内的铜转运给血清CP,形成全CP 后,将铜分泌到血液中[38-39];(2)胞质内的铜由功能完整的ATP7B 基因产物转运给溶酶体,通过胞吞作用将铜排到胆汁中[40],由此可见,ATP7B在铜代谢通路上扮演重要角色[41]。MINGHETTI等[42]研究发现,饲粮中添加铜可显著提高金头鲷体内ATP7B m RNA 的表达。李俐华[43]通过对Wistar雄性大鼠进行硫酸铜(0.02与0.04 mg/kg)圆窗给药后,发现大鼠耳蜗内ATP7B m RNA 表达量与ATP7B蛋白呈现升高的趋势。本试验证实,随着饲粮铜水平的提高,ATP7B m RNA 相对表达量显著提高,说明随着饲粮铜水平的提高,机体为了自身保护,通过增加胆汁的分泌与肠道排泄等途径将多余的铜离子排出体外[43]。另据报道,当肝脏铜浓度较高时会下调ATP7B的基因表达量[44]。这种差异可能是因为当机体内铜含量较高时,二价铜离子会与细胞膜的巯基结合而使细胞膜脂质过氧化[45],还可能是因为铜能够使氧化还原剂构象重排而使其活性受到抑制,导致抗氧化酶活性降低[46-47]。在本试验中,饲粮中铜水平为28.09 mg/kg时,ATP7B m RNA 相对表达量最高,对于更高铜水平对ATP7B m RNA 表达量的影响尚需进一步研究。
COMMD1是第1个被发现的COMMD 蛋白,代表了家族的原型,是家族里最具特色的一员[48],参与调节许多细胞的生理过程[49-51]。ATP7B 基因在转录与翻译过程中的突变会导致转运蛋白的错误折叠与功能失调,COMMD1 促进突变与错误折叠的转运蛋白降解,这使得COMMD1参与新合成的ATP7B蛋白质的质量控制,从而调节机体的铜稳态[52]。若COMMD1合成不足会导致肝脏细胞中铜超载与铜的胆汁排泄障碍,这会导致肝硬化,造成肝脏与脑的损伤[53]。本试验结果显示,在饲粮铜水平为18.09 mg/kg时,COMMD1 m RNA 相对表达量较铜水平为8.09 mg/kg的Ⅰ组有所上升,说明饲粮铜水平为18.09 mg/kg时能更好的调控机体铜稳态。当饲粮铜水平达到23.09 mg/kg时COMMD1 m RNA 相对表达量显著降低,但ATP7B m RNA 相对表达量随着饲粮铜水平的提高显著升高,这可能是因为COMMD1基因既能诱导没有达到完全折叠的ATP酶降解,又能稳定与促进新合成的ATP酶的折叠。正是这种双重作用使得COMMD1下调后ATP酶水平不一致。
CP是一种含铜的糖蛋白,是由肝脏合成的具有氧化酶活性的蛋白质,属于多铜氧化酶[54]。在血液循环中铜蓝蛋白可视为铜的没有毒性的代谢库[55],是细胞获取铜的最优先来源,并且CP 中的铜转运到细胞的速度比其他途径都要快[56],这是因为细胞表面存在有CP受体,该受体可诱导CP发生构象变化并释放出铜原子[57]。乔晶晶等[58]研究表明,铜浓度越高黄河鲤CP mRNA 表达量最高峰出现的越早。本试验结果也证实,随着饲粮中铜水平的提高CP m RNA 表达量极显著提高,这与LIN 等[59]研究结果一致。而王春秀[60]研究表明,在CP m RNA 表达最高峰的出现后,随着铜刺激时间的延长,黄河鲤CP mRNA 表达量会适度降低,这可能是因为高铜会对肝脏与胰脏造成中毒性损伤,影响了CP 的合成效率。
CUT 基因家族与铜动态平衡的调控有关,它主要在铜的摄取、储存、运输与排出过程中发挥作用,CUTC是该家族中的一员[61]。LATORRE 等[62]在培养基中加入硫酸铜研究证实,粪肠球菌长时间处于高铜环境下会使CUTC m RNA 的表达水平显著增加近3倍。在植物病原体中的转录分析显示,铜浓度增加会诱导CUTC的表达[63],所有这些研究都表明CUTC参与调节铜稳态。本试验结果表明,随着饲粮中铜水平的提高,各试验组CUTC m RNA相对表达量之间没有差异,但CALAFATO 等[64]在线虫中观察到相反的结果,该基因的表达会在铜浓度升高时被抑制,这可能是与不同试验对象对铜的需要量与耐受程度不同有关。
3.3 饲粮铜水平对含铜酶基因相对表达量的影响SOD1 是一种广泛存在于生物中的酶。HANSEN 等[65]在对牛的试验中发现,铜元素缺乏会导致SOD1 mRNA 表达量下降。韩胜旗[30]通过体外试验发现,当纳米氧化铜质量浓度达到5 mg/L 时猪小肠上皮细胞内SOD1 m RNA 表达量最高,当质量浓度达到10 mg/L时,SOD1 m RNA 表达量开始显著降低,而硫酸铜对SOD1 mRNA 表达量没有影响。SUAZO 等[66]利用人的单核细胞证明高铜会使机体内血清铜的含量增加,而SOD1 m RNA 表达量下降。本试验研究表明,饲粮中添加铜可以显著提高SOD1 m RNA 的相对表达量,对于进一步提高饲粮铜水平对奶牛SOD1 m RNA 表达量的影响尚需进一步研究。总之,提高饲粮铜水平可以提高奶牛SOD1 m RNA 相对表达量,从而增强机体的抗氧化能力,但并非饲粮铜水平越高抗氧化能力就越强。
LOX 功能广泛,不仅能够将细胞外基质胶原与弹性蛋白的赖氨酸残基脱氨形成分子间的交联,稳定细胞外基质,保持细胞外基质内环境稳定,还能够抑制原癌基因家族中的Ras癌基因诱导的细胞表型的转变,从而抑制肿瘤的形成[67]。LOX 氧化弹性蛋白与胶原中的赖氨酸残基,生成肽基α-氨基己二酸-δ-半醛,这个残基会与相邻的醛或氨基缩合形成共价席夫碱交联[68],正是这种交联结构为结缔组织提供了弹性,并且能够抵抗非特异性蛋白酶对胶原或弹性蛋白的降解[69-70]。所有生物中胶原结缔组织发育迟缓都与铜缺乏有关[71]。当体内铜缺乏时,LOX 活性下降,会对胶原的发育造成阻碍[72],增加饲粮中的铜含量会增加鸡肌腱中的赖氨酰氧化酶活性[73]。本试验结果表明,随着饲粮中铜水平的提高,LOX mRNA 相对表达量显著提高,饲粮中铜含量为23.09与28.09 mg/kg时,LOX m RNA 相对表达量差异不显著。说明饲粮中添加铜能显著提高结缔组织弹性,随着饲粮铜水平的提高,LOX m RNA表达趋势逐渐平缓。
MAO 是重要的含铜酶类,铜缺乏会引起神经系统递质代谢紊乱,可造成神经细胞的损伤[74]。根据MAO 对底物的亲和力与对抑制物特异性的不同,MAO 分为单胺氧化酶A(MAOA)与单胺氧化酶B(MAOB)2个亚型,这2个亚型由不同的基因编码[75]。MAOA 是一种含黄素的线粒体酶,它能够催化多种胺类神经递质的降解过程[76]。MAOA不足会增加血清素、去甲肾上腺素与多巴胺的浓度,MAOB不足会增加苯乙基胺的浓度[77]。血清素作为MAOA 代谢的一种底物,其含量的增加会使动物的行为具有攻击性[78]。MAOB 可以通过激活内、外源的神经毒素或是提高H2O2的水平来加速大脑的老化,随着年龄的增大,MAOB的浓度升高,这会引起脑内儿茶酚胺含量紊乱,生理活动失调,从而导致衰老的发生[79]。单胺氧化酶还是几种神经递质代谢过程中的关键酶[80]。赵丽等[81]研究表明,饲喂高铜日粮能显著提高雏鸭肝脏中单胺氧化酶活性。本试验证实,随着饲粮中铜水平的提高,MAOA m RNA 相对表达量显著升高,而MAOB m RNA 相对表达量显著降低,这与柴春彦等[74]研究结果一致。这可能是因为机体的铜状况可直接影响单胺氧化酶这种神经肽的生物合成过程[82],即通过影响MAO 的转录过程使MAOA m RNA 的表达量升高,MAOB mRNA 的表达量降低;也可能是因为饲粮中添加铜能够使神经细胞膜的流动性与受体功能正常,使得单胺类神经系统的递质正常代谢,从而抑制动物的攻击性行为,减缓机体衰老[83],反馈性地影响MAO m RNA 的表达,更深入的机理有待进一步研究。
在本试验条件下,饲粮中添加铜能够提高奶牛泌乳性能,促进机体内铜的代谢与含铜蛋白的合成,增强机体的抗氧化能力。泌乳牛饲粮适宜铜水平为18.09~23.09 mg/kg,既能确保奶牛有较高的生产性能,又能有效上调泌乳牛肝脏铜代谢蛋白及相关酶基因的表达。
