猪塞尼卡病毒Taq Man探针荧光RT-PCR方法的建立和应用
2020-03-13张丽丽吴发兴董雅琴李晓成中国动物卫生与流行病学中心山东青岛266032青岛农业大学动物医学院山东青岛26609
张 志,张丽丽,2,吴发兴,刘 爽,董雅琴,张 慧,张 峰,崔 进,李晓成∗ (.中国动物卫生与流行病学中心,山东 青岛266032;2.青岛农业大学 动物医学院,山东 青岛26609)
塞尼卡病毒(Senecavirus A,SVA)为单股正链不分节段的RNA 病毒,是小RNA 病毒科(Picornaviridae)的塞尼卡病毒属的唯一成员[1]。与其他小RNA 病毒科的病毒类似,其直径约为27 nm,基因组大小约为7.3 kb,SVA 的基因组由5′端、3′端和1个大的开放阅读框架(ORF)组成,ORF编码形成1个由2 181氨基酸组成的多聚蛋白前体,多聚蛋白前体可进一步水解形成VP4~1等4个结构蛋白和2A~2C、3A~3D 等7个非结构蛋白[2]。2012年有学者发现SVA 可引起猪的水泡样病变,感染猪的鼻吻部、蹄部冠状带等出现明显水泡[3],自此以后,人们对SVA 逐渐重视,美国、加拿大、巴西、中国、泰国、哥伦比亚等养猪业比较发达的国家陆续也从出现水泡病的猪病料中检测到SVA[4-8]。但是SVA 感染引起的病变在临床上与口蹄疫(FMD)、猪水泡性口炎、猪水疱病、猪水泡性疹等疾病的病变十分相似[9],仅依靠临床病变很难做出确诊,迫切需要新的实验室诊断方法。荧光RT-PCR 方法因其特异性强、敏感性高、重复性好的特点在兽医领域广为应用,本研究在前期分离到1株SVA 的基础上,设计不同的探针和引物,并经过临床应用,建立了一种检测SVA 的TaqMan探针荧光RT-PCR 方法。
1 材料与方法
1.1 样品和病毒来源48份猪SVA 临床样品,采自我国部分屠宰场。SVA 病毒株GXT91,由本实验室分离鉴定和保存。口蹄疫O 型RNA 提取自FMDV O 型灭活苗,猪瘟病毒、猪繁殖与呼吸综合征病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒等均由本实验室保存。
1.2 主要试剂Premix 实时RT-PCR(探针法)试剂盒、Premix RT-PCR 一步法扩增试剂盒、p MD-18T vector和DH5α感受态细胞为宝生物工程(大连)有限公司产品,病毒RNA 提取试剂盒(TRIzol)为Life公司产品。
1.3 引物设计和合成选择GenBank上公布的我国SVA 流行毒株序列(KY419132)为参考序列设计引物,用于构建SVA 的荧光RT-PCR 方法。上游引物为SVA-F:ctgcgctgggaccgtatctca;下游引物为:SVA-R:cgccgcgccacctcatt;荧光引物为SVA-P:5′-FAM-tcgccgtaagcgtgcaccgagacag-3′-BHQ1,引物由宝生物工程(大连)有限公司合成。
1.4 样品的处理和RNA 的提取将样品称重后加入4倍体积的PBS(0.01 mol/L,PH 7.2)进行研磨,待样品全部乳化后,以8 000 r/m 离心5 min,取上清液提取RNA。RNA 提取步骤按照TRIzol试剂盒的操作说明书进行,最后加入适量无RNA 酶水溶解,置-70℃备用。同时用SVA 病毒GXT91作为阳性对照,用PBS作为空白对照同步提取RNA。
1.5 阳性标准品的制备以引物SVA-F 和SVAR 作为扩增引物,以SVA 流行病毒株GXT91提取的RNA 作为模板进行RT-PCR 扩增,然后将RTPCR 扩增产物克隆到p MD-18T 载体中,再转化DH5α感受态细胞,蓝白斑筛选,挑取阳性克隆测序、提取质粒和测定浓度,并将此质粒作为SVA 的阳性标准品,命名为pSVA-GXT91,用于后续荧光RT-PCR 试验。
1.6 荧光RT-PCR 方法的建立用Premix 实时RT-PCR(探针法)试剂盒进行SVA 的荧光RTPCR 扩增,反应体系为:12.5μL 2×Premix,1μL SVA-F 引 物(10 μmol/L),1 μL SVA-R 引 物(10μmol/L),1μL SVA-P 引物(5μmol/L),2μL样品RNA 模板或阳性标准品,加水至25μL。RTPCR 的反应程序为:42℃5 min,95℃预变性3 min,95℃8 s、60℃16 s,45个扩增循环,60℃读取荧光。
1.7 标准扩增曲线的建立和敏感性试验将pSVA-GXT91阳性质粒标准品从起始浓度为1.74×1010个分子/μL 开始,分别进行10 倍倍比稀释,然后以10-3~10-9等7个稀释度作为模板进行荧光RT-PCR 扩增,确定荧光RT-PCR 的敏感性和最小检测极限。并以各浓度得到的Ct值为纵坐标,以稀释倍数的负对数作为横坐标,制作标准曲线,评价本方法的检测效果。
1.8 特异性试验以猪口蹄疫病毒、猪瘟病毒、猪呼吸与综合征病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒等提取的RNA 作为模板,用已经建立好的SVA 荧光RT-PCR 方法进行扩增,观察本方法检测其他病原时是否出现非特异性荧光反应,以评价本方法的特异性。
1.9 重复性试验将已知浓度的pSVA-GXT91阳性标准品分别稀释至10-5,10-6,10-7共3个梯度,分别进行组间和组内重复性试验。组内重复性试验时,每个浓度分别用本方法重复检测3次;组间重复性试验时,分别在3次不同的时间用本方法重复检测3次,最后对检测结果进行统计学分析,评价本方法的重复性。
1.10 荧光RT-PCR方法的应用采用建立的荧光RT-PCR 方法对从临床采集的48份猪样品进行检测,评价本方法在实际生产应用中的可行性。
2 结果
2.1 pSVA-GXT91 阳性标准品的制备和浓度测定以本实验室分离到的SVA 病毒株GXT91 提取的RNA 作为模板,用引物SVA-F 和SVA-R 进行扩增,可以扩增到1 条大小为120 bp 的特异性条带,该特异性条带与p MD18-T 载体连接和转化DH5ɑ感受态细胞后,经蓝白斑筛选和测序验证,获得了含有SVA 部分基因的阳性质粒pSVAGXT91,调整质量浓度为58.1 g/L,作为阳性标准品,同时将质粒p MD18-T 空白载体也稀释成58.1 g/L 作为阴性标准品。
2.2 荧光RT-PCR 方法的建立以提取的SVA RNA 为模板,用推荐的荧光RT-PCR 程序进行扩增,第1次扩增即得到特异性的S 曲线,在此基础上,对引物浓度、退火温度和时间等逐步进行组合比对,最后得到了最佳的反应条件,即42℃7 min,95℃预变性2 min30 s,95℃8 s、60℃16 s;45个扩增循环,60℃读取荧光,这时获得的反应结果最好。
2.3 SVA荧光RT-PCR 方法的特异性试验在本方法建立的荧光RT-PCR 中,以SVA 病毒株GXT91提取的RNA 作为模板可以扩增出1条特异性的“S”形曲线,而猪口蹄疫病毒、猪瘟病毒、猪呼吸与综合征病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒等提取的RNA 模板均不能扩增出特异性的条带,表明本方法对SVA 具有较好的特异性(图1)。
2.4 SVA荧光RT-PCR 方法的标准曲线和敏感性试验将质量浓度为58.1g/L 的pSVA-GXT91阳性标准品10倍倍比稀释后作为模板进行荧光PCR扩增,以10-3,10-4,10-5,10-6,10-7,10-8等不同浓度的反对数作为横轴,以对应的Ct值作为纵轴制作标准曲线(图2),可以得到相关的回归方程:Y=3.630 9X+5.130 3,相关系数R2=0.999 1,这说明扩增的Ct值与病毒的拷贝数之间呈现非常强的线性关系,表明本方法适应范围广,不同浓度的模板使用本方法检测都可以得到较好的试验结果。
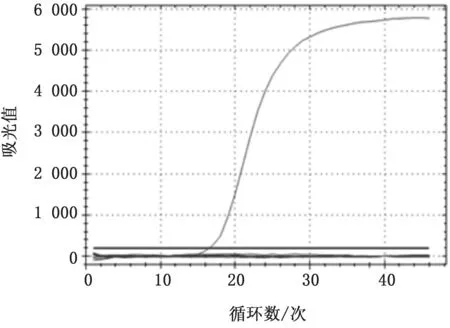
图1 SVA 荧光RT-PCR 方法的特异性试验结果
敏感性试验中,当模板的浓度稀释为原始模板浓度的10-3,10-4,10-5,10-6,10-7,10-8和10-9时,对应扩增的Ct值分别为15.91,19.53,23.41,27.21,30.64,33.90和35.99,扩增曲线仍然为1 条典型的“S”形扩增曲线,但当模板浓度稀释为原始模板浓度的10-10时,荧光PCR 扩增不出典型的“S”型曲线。这表明,本方法的检测极限是样品的10-9稀释倍数(图3)。
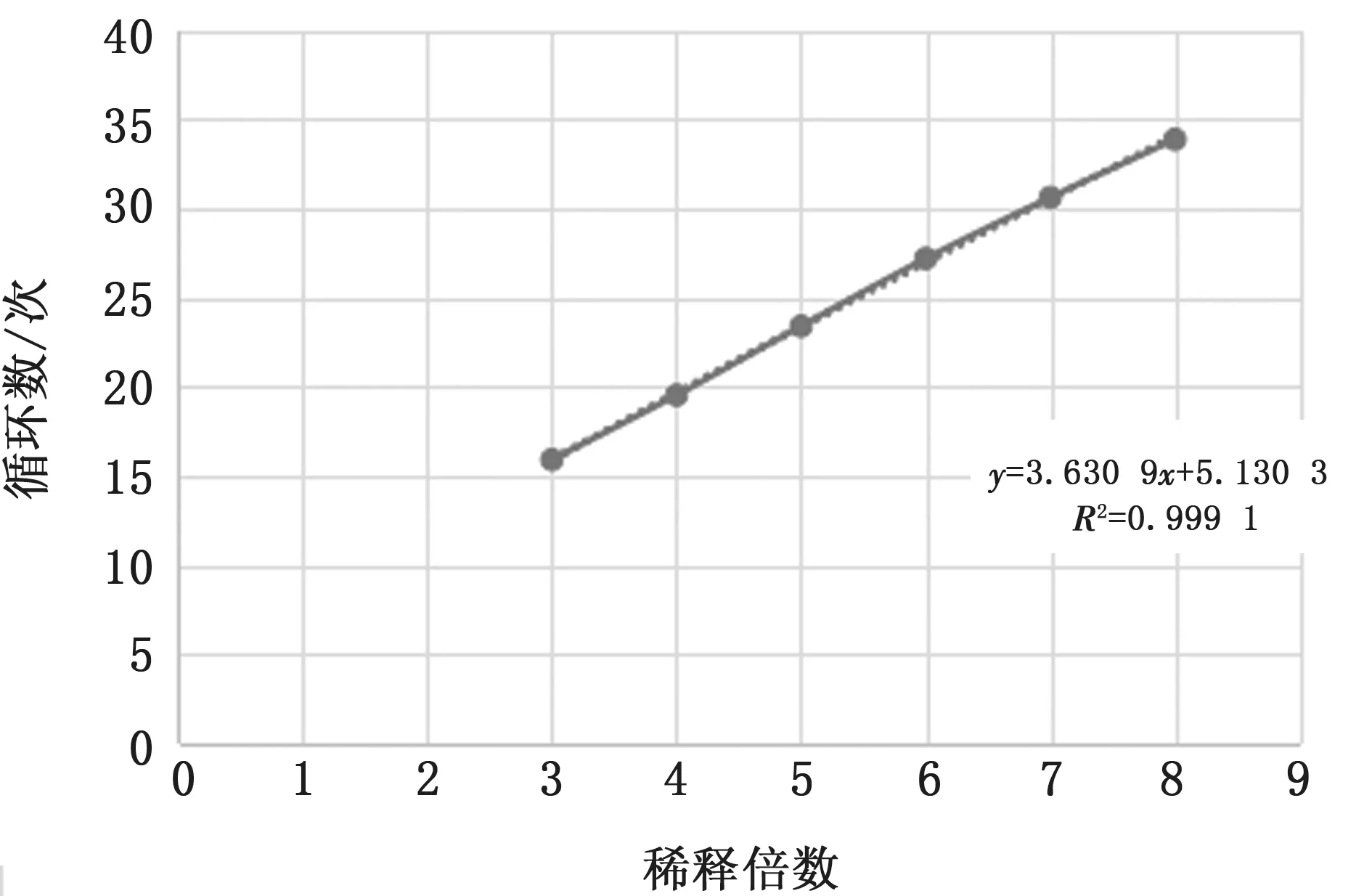
图2 SVA 荧光RT-PCR 方法的标准曲线

图3 SVA 荧光RT-PCR 方法的敏感性试验结果
2.5 SVA荧光RT-PCR 方法的重复性用上述稀释倍数为10-5,10-6,10-7的标准品作为模板进行组间和组内重复性试验,统计分析显示,3种不同浓度的样品、3 次组间和组内重复试验的变异系数(CV)均小于2%,表明本方法的重复性较好(表1,图4)。

表1 SVA 荧光RT-PCR 方法份重复性试验结果
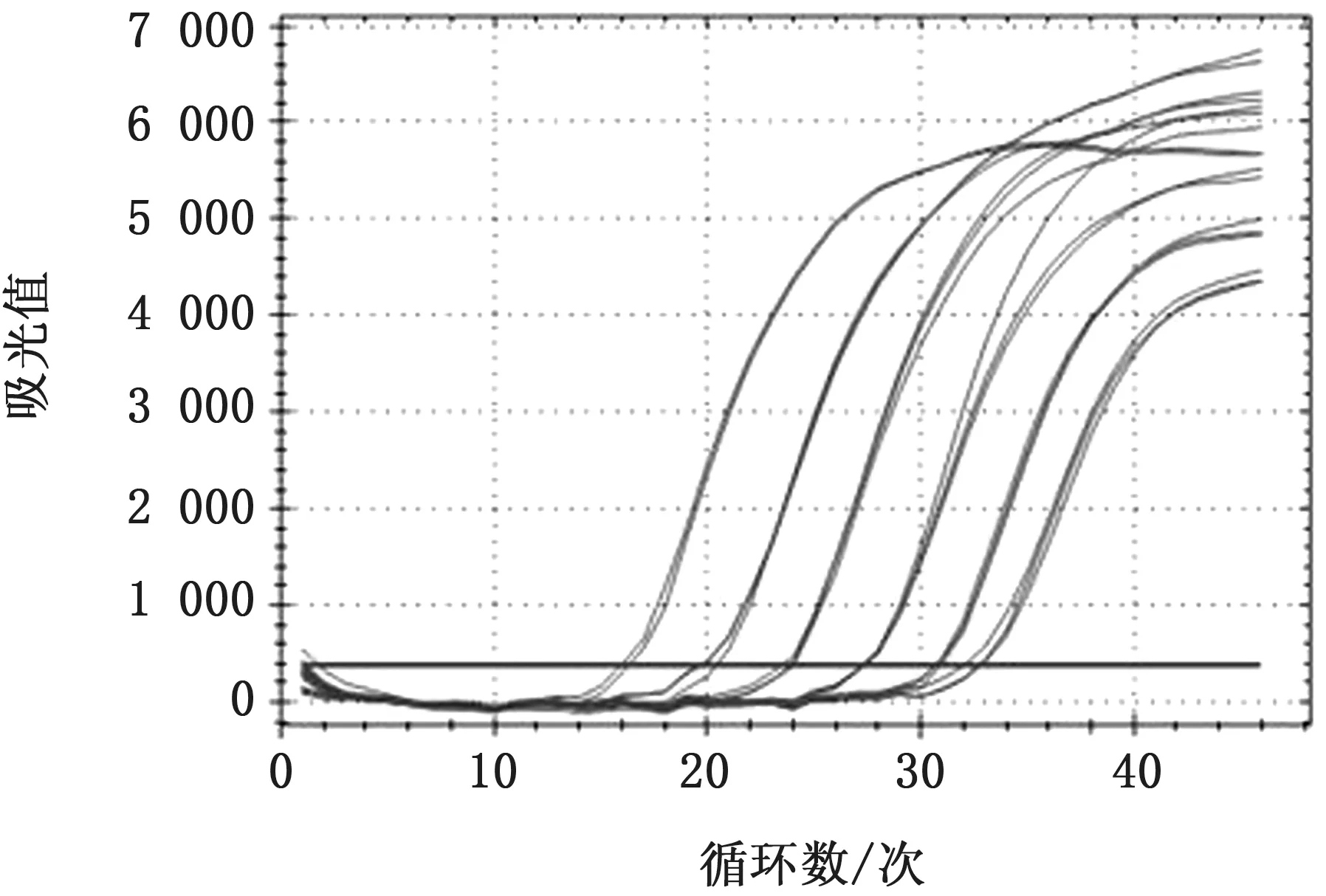
图4 SVA 荧光RT-PCR 方法的重复性试验结果
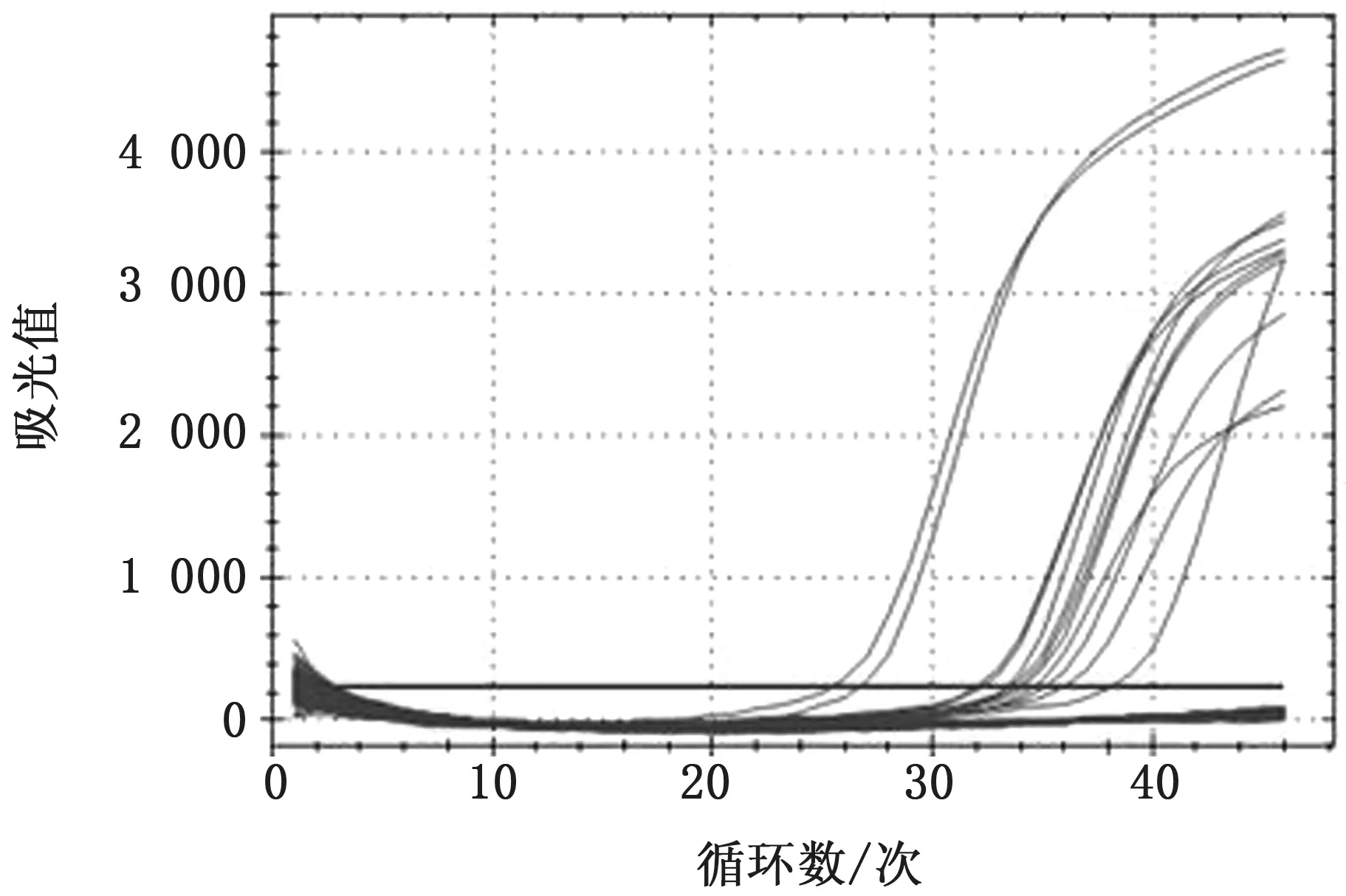
图5 SVA 荧光RT-PCR 方法检测临床样品的结果
2.6 荧光探针方法的应用用本试验建立的荧光方法对48份猪样品进行检测,共有12份样品扩增出典型的“S”型曲线(图5),与阳性样品的结果一致,阳性率为25%,表明本方法完全可以用于临床样品的检测。
3 讨论
荧光PCR 方法是检测核酸常用的方法,它具有敏感性高、特异性强、可重复性好的特点,在医学、兽医学以及生物学领域广为应用。本研究建立的用于检测SVA 的TaqMan探针荧光RT-PCR 方法同样具有上述特点,且本研究设计引物时选取的靶基因是SVA 的3D 基因,该基因编码非结构蛋白,属于SVA 病毒株中最保守的区域,针对该区域建立的荧光PCR 方法覆盖的毒株范围更广,检测到的SVA病毒株更全面。在敏感性方面,本方法的检测极限病毒拷贝达到了17.4个/μL,与其他病毒的检测敏感性一致。特异性方面,由于条件所限,本实验室没有保存猪水泡性口炎、猪水疱病、猪水泡性疹等疫病的病原,因此仅选择了口蹄疫病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒等常见的几种RNA 病毒作为参考病毒进行特异性试验,试验结果显示本研究建立的荧光RT-PCR 方法可以将SVA 与上述几种猪病的病原鉴别开,表明本方法具有较强的特异性。组间和组内的变异系数均小于2%,显示本方法的重复性良好。以上研究表明,本研究建立的荧光RT-PCR 方法是一种较好的诊断SVA 的方法。
SVA 感染猪以后,有的毒株致病性较强,可引起猪发生水泡样病变、跛行和新生仔猪的突然死亡,其临床表现与口蹄疫病毒、猪水泡性口炎病毒、猪水疱病病毒等引起的病变类似,仅靠临床表现很难与这几种病原进行区别。而有的毒株致病性较弱,引起的临床症状不典型。因此,SVA 的确诊必须依靠实验室诊断技术[10]。国内外已经用于SVA 诊断的实验室技术包括病毒的分离培养、病毒中和、ELISA、普通的RT-PCR 方法和荧光PCR 方法等[11-14],这些方法在SVA 的诊断中发挥了重要作用。
同时,国内也陆续发表了SVA 的诊断方法,樊晓旭等[15-18]先后建立了TaqMan荧光定量PCR 方法、重组酶聚合酶扩增方法(RDA)及配套的侧流层析试纸条检测方法。本方法与其建立的TaqMan探针的荧光PCR 方法类似,而他们是以SVV-001参考毒株作为靶序列进行引物设计的,但SVV-001已经与目前的SVA 流行毒株存在一定的差异。因此用SVV-001作为靶序列建立的检测方法在应用中可能会存在假阴性的结果。另外,RDA 和侧流层析试纸条的变异系数范围分别为2.44%~14.95%和4.49%~9.73%,表明这些方法的稳定性尚待进一步改进。而本研究的荧光RT-PCR 方法基于最近的SVA 流行病毒株,即本实验室分离鉴定的SVA 流行病毒株GXT91的基础上,不但弥补了该方法的不足之处,而且进一步用48份临床样品进行复核,结果表明该方法可以从中检测出12份阳性样品,表明本方法完全可以用于SVA 的流行病学调查和监测等。到目前为止,对SVA 的传播途径、致病机制、组织分布等了解不多,本试验建立的荧光RTPCR 方法对于了解SVA 的发病机制和流行病学研究具有重要意义。
