牦牛血低聚肽对小鼠抗疲劳能力和缺氧H9c2细胞的影响
2020-03-13刘妍佳
肖 岚 李 诚 杜 昕 刘妍佳
(1四川农业大学食品学院,四川 雅安 625014;2 四川旅游学院食品学院,四川 成都 610100)
牦牛(Bos mutus或Bos grunniens)是生长在海拔3 000 米以上的特殊家畜。经过世代的自然选择,牦牛对低氧环境有着极好的适应性,这可能与牦牛血液富含血红蛋白有关[1-3],这为利用牦牛血红蛋白制备生物活性肽奠定了物质基础。本试验在前期研究中采用菌酶联合发酵制备出牦牛血低聚肽[4];郝刚等[5]采用胰蛋白酶水解牦牛血,Sephadex G-15 凝胶柱分离,再经反相高效液相色谱(eversed high performance liquid chromatography,RP-HPLC) 反复纯化,制得2个色谱纯的抗菌肽YakB-1和YakB-2;孙骞等[6]采用AS1.398 中性蛋白酶水解制备牦牛血红蛋白活性肽;韩学燕等[7]利用中性蛋白酶水解牦牛血红蛋白制备蛋白多肽粉;姚星辰等[8]报道牛血活性蛋白具有显著延长小鼠抗缺氧时间的作用。然而,关于牦牛血低聚肽是否具有抗缺氧作用却鲜见报道。研究表明,机体抗缺氧能力提高,运动能力也随之提高[9]。目前,关于大豆肽[10]、花生肽[11-12]和猪血多肽[13]缓解疲劳的作用已有报道,而有关牦牛血低聚肽是否具有抗疲劳作用却鲜见报道。
H9c2 心肌细胞株是一种从大鼠胚胎心脏分离出来的心肌细胞[14],具有心肌细胞的特征且性质稳定[15]。动物缺氧可导致心肌供氧减少,进而发生一系列病理变化[16],故常用此细胞来研究缺氧诱导心肌细胞损伤、缺氧/复氧心肌损伤、氧化应激心肌损伤、心肌退行性疾病等[17-18]。此外,本试验前期研究发现[19]牦牛血低聚肽的体外抗氧化活性优于商品化大豆低聚肽,将这2种低聚肽按比例组合后,复合低聚肽在DPPH 模型和脂质过氧化抑制能力模型中表现出拮抗作用;在ABTS 模型中表现协同作用。因此,本试验通过体外培养H9c2 心肌细胞建立缺氧损伤模型探讨牦牛血低聚肽的抗缺氧作用,并通过小鼠游泳抗疲劳试验进一步验证复合低聚肽的互作关系,并探究其抗疲劳作用。本研究以期为有效提高牦牛血附加值提供理论依据,同时对保护藏区环境、牧民脱贫增收也有积极的意义。
1 材料与方法
1.1 材料与试剂
H9c2 心肌细胞株,生工生物工程(上海)股份有限公司;SPF 级KM 小鼠,雄性,动物合格证号:SCXK(川)2015-030,体质量18~22 g,成都达硕实验动物中心。
牦牛血低聚肽(氨基酸含量85.25 g·100g-1,平均分子量<1 kDa),自制[4];大豆低聚肽[肽含量(以干基计)≥80%,相对分子质量<2 kDa,蛋白质水解物所占比例≥80 g·100g-1)],中食都庆(山东)生物技术有限公司;DMEM 高糖培养基(Dulbecco′s modified eagle medium)(GIBCO,货号:1670291)、大鼠心肌细胞完全培养基、胎牛血清(GIBCO,货号:10099-141),赛默飞世尔(苏州)仪器有限公司;0.25% Trypsin(GIBCO,货号:15050065),赛默飞世尔(苏州)仪器有限公司;红景天苷标准品(货号:SS8080),索来形容词生物科技有限公司;CCK-8细胞增殖及细胞毒性检测试剂盒(Beyotime,货号:C0037),上海碧云天生物技术有限公司;肝糖原试剂盒、血乳酸试剂盒、血清尿素氮试剂盒、总蛋白测试盒,南京建成生物工程研究所。

表1 牦牛血低聚肽的氨基酸组成Table1 Amino acid composition of yak blood oligopeptides

表2 牦牛血低聚肽的分子量分布Table2 Molecular weight distribution of yak blood oligopeptides
1.2 仪器与设备
HF-100型三气培养箱,上海力申科学仪器有限公司;5702R 低速离心机,Eppendorf 艾本德中国有限公司;IX51 倒置显微镜,奥林巴斯(中国)有限公司;MCO-15AC CO2恒温培养箱,SANYO 三洋中国有限公司;SW-CJ-1FD 超净工作台,苏州集团安泰空气技术有限公司;UV-1800 紫外分光光度计,日本岛津公司;Multiskan MK3 全自动酶标仪,赛默飞世尔(苏州)仪器有限公司。
1.3 试验方法
1.3.1 牦牛血低聚肽抗缺氧活性的测定
1.3.1.1 细胞株与分组 H9c2细胞置于含有10%胎牛血清(fetal bovine serum,FBS)的DMEM 高糖培养基中复苏并培养融合至80%~90%后,将H9c2细胞随机分组。
1.3.1.2 不同浓度牦牛血低聚肽细胞毒性的评估 H9c2细胞复苏与培养后,待细胞密度达到80%时对细胞进行传代。用0.25%胰酶消化细胞,终止消化后收集细胞;用无菌磷酸盐缓冲液(phosphate buffer solution,PBS,0.01 mol·L-1,pH值7.2~7.3)将细胞润洗2次,1 200 r·min-1离心3 min;加入大鼠心肌细胞完全培养基,吹打细胞,制成单细胞悬液,按1 ∶3的比例传代,37℃、5%CO2饱和湿度条件下扩大培养。取对数生长期的H9c2细胞,用培养基(10%FBS+1%双抗)调整细胞密度至5×104mL-1,接入96 孔板,每组3个复孔,每孔100 μL细胞悬液,并设置空白孔,在细胞孔周围孔内加入100 μL 无菌PBS,于37℃、5%CO2条件下培养过夜;低聚肽按照0.025、0.050、0.100、0.200、0.400、0.800、1.600、3.200 mg·mL-1加入96 孔板,同时设置正常对照组,每组5个复孔,于37℃、5% CO2饱和浓度条件下培养4 h[19]。
1.3.1.3 H9c2细胞缺氧模型建立细胞正常培养24 h后更换为缺氧培养基(含2% FBS),对照组继续常氧培养,缺氧组置于含2%氧气的三气培养箱中培养,分别培养24、36、48、72、96 h,确定最佳培养时间。试验分组:正常对照组、缺氧组、低聚肽低剂量组(0.05 mg·mL-1)、低聚肽中剂量组(0.40 mg·mL-1)、低聚肽高剂量组(3.20 mg·mL-1)、阳性对照组(200 μg·mL-1红景天苷组)。其中,正常对照组常氧条件培养,加药组加药预处理4 h后换为缺氧培养基(含2%FBS)并置于三气培养箱缺氧培养48 h。
1.3.1.4 细胞存活测定细胞处理结束后,按CCK8细胞增殖及细胞毒性检测试剂盒操作说明书进行试验,用酶标仪测定各孔吸光值OD450,重复测定3次。
1.3.2 牦牛血低聚肽抗疲劳活性的研究
1.3.2.1 动物喂养 将小鼠随机分为5 组,灌胃4周,1次/d,对照组(等体积生理盐水,10 mL·kg-1)、牦牛血低聚肽组(1 500 mg·kg-1),混合低聚肽A 组(1 500 mg·kg-1,牦牛血低聚肽与大豆低聚肽质量比9 ∶1)、混合低聚肽B 组(1 500 mg·kg-1,牦牛血低聚肽与大豆低聚肽质量比1 ∶9)、混合低聚肽C 组(1 500 mg·kg-1,牦牛血低聚肽与大豆低聚肽质量比5 ∶5)。自由摄食和饮水,并在灌胃后观察小鼠的精神状态、活动、觅食量等情况。
1.3.2.2 小鼠负重游泳试验 参考查圣华[20]的方法,末次给抗疲劳组小鼠受试物30 min后,置于游泳箱中游泳,水深约35 cm,水温保持在25±1℃,小鼠尾根部负荷5%体重的铅丝。记录小鼠自由泳开始至死亡的时间,作为小鼠负重游泳时间。
1.3.2.3 生化指标测定 末次灌胃30 min后,每组随机取出10 只小鼠,在25±1℃的水中无负重游泳30 min,取出后休息60 min,拔眼球采全血,当试验小鼠停止呼吸,处理小鼠取其肝脏组织,于-80℃保存,按照试剂盒操作书说明测定肝糖原(hepatic glycogen,HG)、血乳酸(blood lactic acid,BLA)含量以及血清尿素氮(blood urea nitrogen,BUN)含量。
1.4 数据处理
试验数据以平均数±标准差表示,采用单因素方差分析处理数据,P<0.05表示存在显著差异,P<0.01表示存在极显著差异。使用Microsoft Office Excel 2017、SPSS 19.0和Origin Pro 2017 等软件分析数据并制图。
2 结果与分析
2.1 牦牛血低聚肽对H9c2细胞缺氧的保护作用
2.1.1 不同浓度牦牛血低聚肽对H9c2细胞毒性的评估 由图1可知,不同浓度牦牛血低聚肽对H9c2细胞存活均未产生显著差异(P>0.05),说明牦牛血低聚肽在试验浓度内无显著细胞毒性。
2.1.2 牦牛血低聚肽对缺氧H9c2细胞存活率的影响
2.1.2.1 不同缺氧时间对H9c2细胞存活率的影响 由图2可知,当细胞缺氧时间超过24 h时,与常氧对照组相比,其对应缺氧组细胞存活率均极显著降低(P<0.01)。细胞缺氧48 h时,常氧对照组的细胞存活率为254.3%,而缺氧组的细胞存活率仅为85.0%。因此,细胞缺氧模型的暴露时间以48 h为宜。

图1 不同浓度牦牛血低聚肽对H9c2细胞活力的影响Fig.1 Effects of different concentrations of yak blood oligopeptides on H9c2 cell viability

图2 不同缺氧时间对H9c2细胞存活率的影响Fig.2 Effect of different hypoxia time on survival rate of H9c2 cells
2.1.2.2 牦牛血低聚肽对缺氧H9c2细胞存活率的影响 由图3可知,与正常对照组相比,缺氧H9c2细胞存活率均呈现一定程度的下降。与缺氧组相比,中、高剂量牦牛血低聚肽组以及红景天苷组均极显著提高H9c2 缺氧细胞的存活率(P<0.01)。然而,中、高和低剂量组干预的缺氧细胞存活率均极显著低于红景天苷组(P<0.01)。表明,牦牛血低聚肽具有改善缺氧H9c2细胞存活率的作用,且存在剂量依赖性。与常用的抗缺氧药物红景天苷比较,高剂量组细胞存活率为75.1%,而红景天苷组为88.0%,表明牦牛血低聚肽改善缺氧细胞存活率的作用弱于红景天苷。
2.2 牦牛血低聚肽对小鼠的抗疲劳作用
2.2.1 牦牛血低聚肽对小鼠体重的影响 由表4可知,各组小鼠经灌胃4 周后,其体重均有不同程度的增加,但各给药组小鼠的体重涨幅均低于对照组,但差异不显著(P>0.05)。且在喂养4 周未发现小鼠异常或死亡,表明灌胃低聚肽对小鼠无毒副作用。
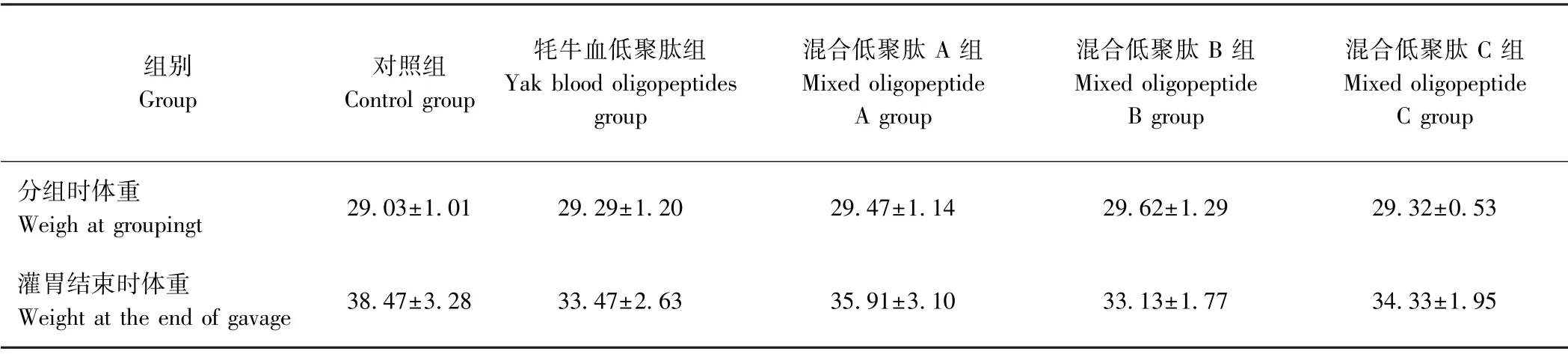
表4 牦牛血低聚肽对小鼠体重的影响(n=10)Table4 Effect of yak blood oligopeptides on body weight in mice(n=10)/g
2.2.2 牦牛血低聚肽对小鼠负重游泳时间的影响 由表5可知,与对照组相比,低聚肽干预小鼠均能延长小鼠的负重游泳时间。牦牛血低聚肽组、混合低聚肽C 组小鼠负重游泳时间极显著高于对照组(P<0.01),混合低聚肽A 组显著高于对照组(P<0.05),表明低聚肽可能具有抗疲劳的作用。与牦牛血低聚肽组相比,混合低聚肽C 组小鼠的负重游泳时间最长,增加近41%;混合低聚肽A 组、B 组小鼠的负重游泳时间均不及牦牛血低聚肽组。表明牦牛血低聚肽与大豆低聚肽按照5 ∶5 混合组成复合肽的抗疲劳能力最好。
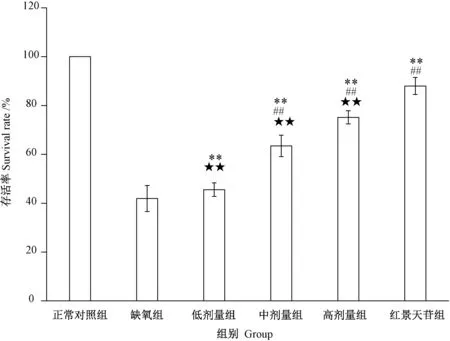
图3 牦牛血低聚肽对缺氧H9c2细胞存活率的影响Fig.3 Effect of yak blood oligopeptide on survival rate of hypoxia H9c2 cells

表5 牦牛血低聚肽对小鼠负重游泳时间的影响(n=10)Table5 Effect of yak blood oligopeptides on swimming time in mice(n=10)/min
2.2.3 牦牛血低聚肽对BUN含量的影响 BUN是反映机体疲劳程度的重要指标[21]。长时间运动后,机体不能通过糖代谢和脂肪代谢产生足够能量,蛋白质、氨基酸等含氮化合物降解脱氨基形成尿素[22],导致参与肝脏鸟氨酸循环的氨增多,使得BUN含量升高[23]。由表6可知,与对照组相比,混合低聚肽C 组小鼠肝脏内BUN含量最低,之后依次是牦牛血低聚肽组、混合低聚肽A 组和B 组。表明低聚肽干预可降低小鼠BUN含量。
2.2.4 牦牛血低聚肽对BLA含量的影响 机体高强度运动使细胞处于相对缺氧状态,糖酵解加快[24],大量乳酸在肌肉堆积,加重机体疲劳,肌乳酸会渗入血液,使BLA含量上升,直至二者平衡。因此,运动后BLA含量的变化是衡量抗疲劳效果的重要指标[25]。由表7可知,低聚肽各组小鼠运动后BLA含量均显著或极显著低于对照组,混合低聚肽C 组的BLA含量最低,之后依次是混合低聚肽A 组、牦牛血低聚肽组和混合低聚肽B 组。表明牦牛血低聚肽及其混合低聚肽均能有效降低运动疲劳物质BLA的产生,其与提高乳酸脱氢酶活性,加速BLA 循环及其清除速率有关,从而增强机体抗疲劳的能力。
2.2.5 牦牛血低聚肽对HG含量的影响 HG 作为机体供能的重要能量来源之一,运动越剧烈消耗越大。为维持稳定的血糖浓度,HG 会不断转化成血糖[26],进而抑制HG 合成[27],因此HG含量可衡量机体抗疲劳能力[28]。由表8可知,低聚肽各组均能提高小鼠HG含量,表明低聚肽可以增加小鼠机体HG的储备。与对照组相比,牦牛血低聚肽极显著增加小鼠的HG含量(P<0.01),上调小鼠HG的效果最好;其次是混合低聚肽C 组,显著增加小鼠HG含量(P<0.05);混合低聚肽B 组效果最差,仅能提高小鼠HG含量15.4%。结果表明,牦牛血低聚肽对维持疲劳小鼠HG 稳定效果最好。

表6 牦牛血低聚肽对小鼠BUN含量的影响(n=10)Table6 Effect of yak blood oligopeptides on serum urea nitrogen content in mice(n=10)/(mmol·L-1)

表7 牦牛血低聚肽对小鼠BLA含量的影响(n=10)Table7 Effect of yak blood oligopeptides on blood lactic acid in mice(n=10)/(mmol·L-1)

表8 牦牛血低聚肽对小鼠HG含量的影响(n=10)Table8 Effect of yak blood oligopeptides on liver glycogen content in mice(n=10)/(mg·g-1)
3 讨论
本研究选用H9c2 大鼠心肌细胞建立缺氧损伤心肌细胞模型,研究牦牛血低聚肽对缺氧H9c2 大鼠心肌细胞的保护作用,结果发现,与常氧对照组相比,缺氧48 h H9c2 大鼠心肌细胞存活率极显著降低(P<0.01),表明缺氧介导了心肌细胞的损伤。而高、中、低剂量的牦牛血低聚肽均能提高缺氧损伤的H9c2细胞的存活率,表明牦牛血低聚肽对心肌细胞H9c2 具有保护作用,关于其作用机制将进一步研究。
运动性疲劳是一个综合的症状[29],机体高强度运动后产生过多自由基[30-31],大量研究证实[32-34],外源性抗氧化物质能与内源性自由基相互作用,增强机体抗氧化防御能力、减轻疲劳。本研究前期对高、中、低剂量(365、700、1 500 mg·kg-1)牦牛血低聚肽的体内抗氧化能力进行研究,确定牦牛血低聚肽对小鼠的抗氧化能力呈现剂量耐性,高剂量组的抗氧化能力最佳。因此,本研究选择高剂量牦牛血低聚肽研究其对小鼠抗疲劳能力的影响,结果发现,低聚肽抑制小鼠体重的
增长,但无统计学意义;这与尹军杰[10]和胡滨等[13]的研究结果不一致,可能与牦牛血低聚肽、大豆低聚肽呈现一定的苦味有关,从而导致给药组小鼠的摄食量减少,体重增长缓慢;另外,也可能与本研究选用的是高剂量有关。因此,后续开发牦牛血低聚肽功能食品,需考虑包埋、微胶囊等技术解决低聚肽苦味的问题。本研究结果表明,牦牛血低聚肽能够极显著提高小鼠负重游泳时间,提高运动后小鼠体内HG含量,降低运动后小鼠BLA含量和BUN含量,判定牦牛血低聚肽具有一定的抗疲劳能力[20]。
牦牛血低聚肽与大豆低聚肽组合后的复合肽具有良好的抗疲劳作用。本研究发现,混合低聚肽C 组的抗疲劳效果最优,对提高小鼠负重游泳时间、降低运动后小鼠BLA含量和BUN含量的效果均优于单独使用牦牛血低聚肽,但牦牛血低聚肽对提高运动后小鼠体内HG含量的效果优于混合低聚肽C 组。关于食源性低聚肽的抗氧化、抗缺氧、抗疲劳的互作作用鲜有相关报道。本研究还发现,不同比例组合的复合低聚肽对不同的抗疲劳指标的影响不一样;复合低聚肽需有适当的比例才能表现出较单一低聚肽更好的抗疲劳能力,且同一比例组合的复合低聚肽在不同的代谢途径中发挥的互作作用存在差异。
4 结论
本研究发现牦牛血低聚肽具有抗疲劳的能力,且牦牛血低聚肽与大豆低聚肽按5 ∶5进行组合后小鼠的抗疲劳能力优于单独使用牦牛血低聚肽组,表明功能性低聚肽按照适当比例组合后具有协同作用。牦牛血低聚肽能够在一定剂量条件下提高缺氧(37℃,2%O2)条件下大鼠H9c2 心肌细胞的存活率,表现出良好的缺氧细胞损伤防护功效,表明牦牛血低聚肽具有抗缺氧的能力,关于其抗缺氧能力的作用机制将在后续进行深入研究。
