苜蓿根腐病菌(Fusarium solani )的LAMP快速检测方法
2020-03-11兰成忠阮宏春代玉立卢学松
兰成忠,阮宏春,甘 林,代玉立,卢学松
(福建省作物有害生物监测与治理重点实验室/福建省农业科学院 植物保护研究所,福建 福州 350013)
苜蓿(Medicagosativa)是世界和我国最主要的优良豆科牧草之一,被誉为“牧草之王”。目前苜蓿栽培面积已占我国多年生牧草面积的30%以上,占全部牧草面积的25%[1]。根腐病是苜蓿生产上一种毁灭性的病害,常导致产量和品质大幅下降。随着苜蓿新品种的不断引进,栽培技术、水肥水平的不断提高,苜蓿根腐病的发生也日趋严重,田间发病率一般达5%~7%,重病地达15%~21%,更严重的发病率达92%,严重影响了苜蓿的广泛应用,给苜蓿生产构成了一定的威胁,成为限制苜蓿产业健康发展的主要因素之一[2-4]。
引起苜蓿根腐病的病原菌大致有以下几种:苜蓿疫霉菌(Phytophthoramegasperma)、镰刀菌属真菌(Fusariumspp.)、立枯丝核菌(Rhizoctoniasolani)和腐霉属卵菌(Pythoumspp.)等[4],其中茄镰刀菌(Fusariumsolani)为优势病原菌之一[5]。病原菌的准确鉴定与检测是病害防控的基础,研究人员通常依据病原菌所致的症状和菌物形态特征对苜蓿根腐病原菌进行鉴定和检测[6-7],这种应用形态学方法进行鉴定不仅困难且耗时费力,不能满足病害快速准确鉴定、诊断的需求。随着分子生物学技术的发展,常规PCR技术被成功地应用于苜蓿根腐病菌的准确鉴定和快速检测中[8]。PCR技术虽然提升了病原菌鉴定的准确性和检测的快速性,但仍存在需要依赖精密的PCR仪、凝胶成像系统等贵重仪器设备和操作繁琐等问题。因此,很有必要建立新的检测技术以期实现对苜蓿根腐病菌的快速、简便检测。
环介导等温扩增(Loop-mediated Isothermal Amplification, LAMP)技术是由日本荣研公司开发的一种简便、快速、准确及廉价的核酸高效扩增技术,该技术可在60~65 ℃恒温条件下,利用高活性的链置换DNA聚合酶(BstDNA polymerase)对目的DNA片段进行特异性扩增,在1 h内即可观察结果[9]。LAMP技术具有特异性强、设备要求低、操作简单、灵敏度高、反应时间短等优点,因而被广泛应用于多种病原菌检测中[10-12]。截至目前,关于苜蓿根腐病菌的LAMP检测国内外均未见报道。本研究基于LAMP技术建立了苜蓿根腐病菌(F.solani)检测体系,并对该体系的特异性、灵敏度及实际检测应用进行了一系列的研究,以期为苜蓿根腐病的准确诊断和及时防治提供技术支持和理论依据。
1 材料与方法
1.1 供试菌株
供试菌株包括苜蓿根腐病菌(F.solani,茄镰刀菌)及其近缘种、其它植物病原真菌和卵菌,菌株的名称和来源等信息详见表1。供试紫花苜蓿品种为阿尔冈金,由西北农林科技大学草业实验室赠送。

表1 供试的病原菌菌株
1.2 菌株培养及DNA提取
将供试的镰刀菌和其它真菌培养于PDA(马铃薯葡萄糖琼脂培养基)平板上,于25 ℃黑暗培养7 d后刮取平板上的菌丝,经冷冻抽干研磨成菌丝粉,保存于-20 ℃备用。将供试疫霉菌培养于CA(胡萝卜琼脂培养基)平板中,于25 ℃黑暗培养5 d后,从菌落边缘切取大小约为3 mm×3 mm的菌丝块,转移至胡萝卜液体培养基中,于25 ℃、180 r/min、黑暗条件下培养7 d,用双层纱布过滤收集菌丝,经冷冻抽干研磨成菌丝粉,保存于-20 ℃备用。
参照Murray和Thompson的方法[13],采用CTAB方法提取供试菌株基因组DNA,具体步骤如下:取少量菌丝粉于1.5 mL离心管中(菌丝粉刚盖过半圆形底部为宜),加入900 μL 2%CTAB(十六烷基三甲基溴化铵)提取液(2% CTAB;100 mmol/L Tris-HCl, pH 8.0;20 mmol/L EDTA, pH8.0;1.4 mol/L NaCl)和90 μL SDS(十二烷基苯磺酸钠)(CTAB和SDS需在60 ℃下预热),使用振荡器振荡混匀,于60 ℃水浴1 h,使DNA释放至缓冲液中,再以12000 r/min离心15 min;取上清液700 μL,加等体积酚、氯仿、异戊醇(25∶24∶1),轻轻振荡混匀,以12000 r/min离心9 min;取上清液500 μL,加入等体积氯仿再抽提1次,以12000 r/min离心5 min;取上清液350 μL,加入1/10体积的3 mol/L NaAc和2倍体积的无水乙醇,在-20 ℃下沉淀30 min,以12000 r/min离心5 min;弃去上清液,加入700 μL冰的70%乙醇进行洗涤(稍离心;倾掉上清液),在超净工作台上晾干至无酒精味,加入30~60 μL TE溶液(10 mmol/L Tris-HCl,0.1 mmol/L EDTA, pH 8.0)进行溶解,得到DNA溶液,用紫外分光光度计检测DNA的浓度,并稀释至100 ng/μL待用。
1.3 引物设计与筛选
应用BioEdit软件对苜蓿根腐病菌(F.solani)的TEF-1α基因序列(GenBank No: MN602077)和其它镰刀菌(Fusariumspp.)的相应基因序列进行比对分析。选取F.solani种内不同来源菌株间序列高度保守,并与其它种镰刀菌差异较大的区段,利用在线LAMP引物设计软件Primer software Explorer V5(https://primerexplorer.jp/lampv5/index.html; Eiken Chemical Co., Japan)进行LAMP引物设计,所设计的多组引物经特异性和灵敏度试验筛选,获得1组对F.solani具有种的特异性且灵敏度高的LAMP引物,该引物在TEF-1α基因序列中的位点和序列见图1和表2。该引物由上海生工生物工程技术有限公司合成,用ddH2O溶解后分装,于-20 ℃保存备用。
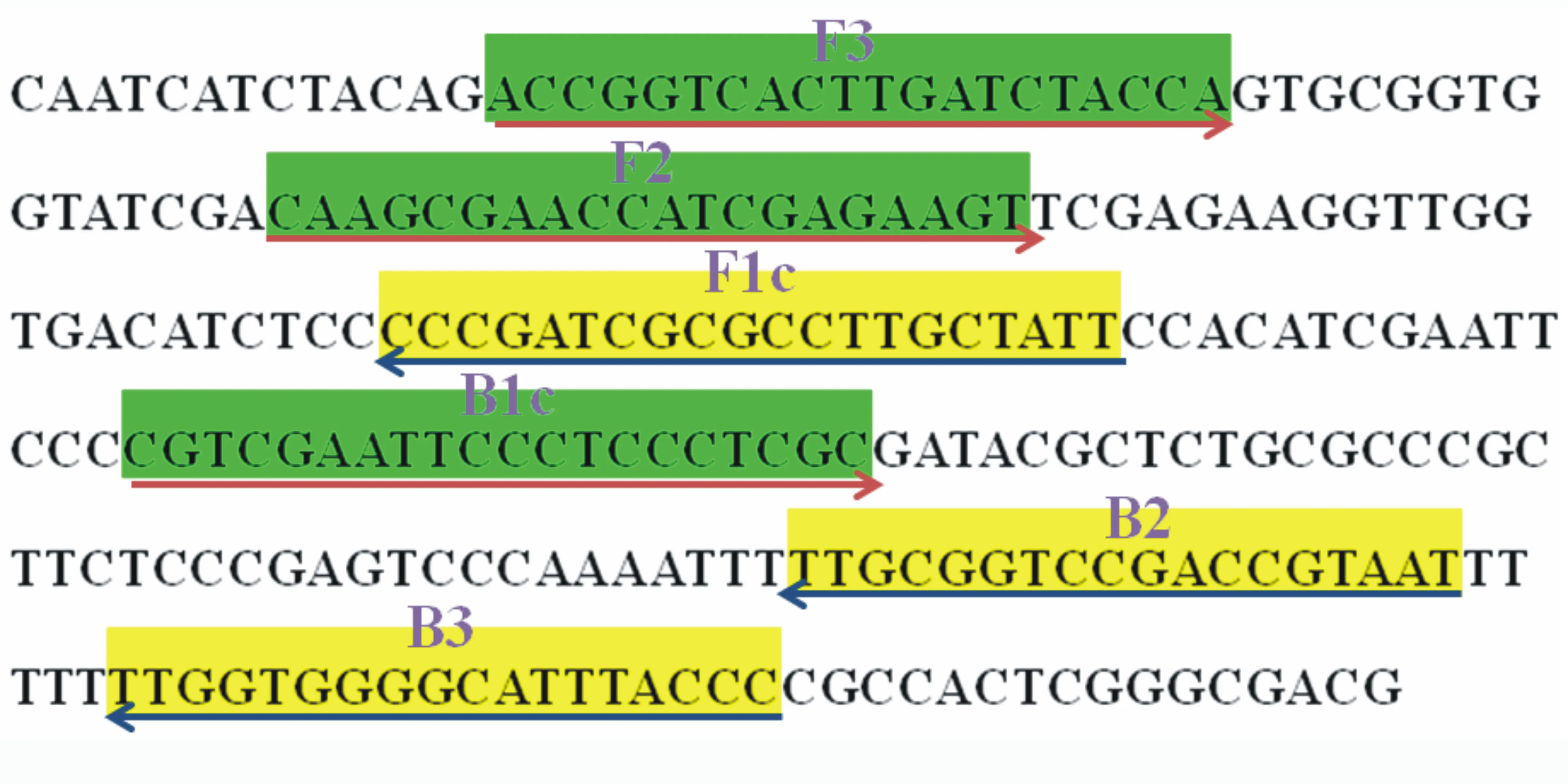
图1 LAMP引物在TEF-1α序列中的位点
表2 用于FusariumsolaniLAMP检测的引物

引物名称序列(5′-3′)F35′-ACCGGTCACTTGATCTACCA-3′B35′-GGGTAAATGCCCCACCAA-3′FIP5′-AATAGCAAGGCGCGATCGGG-CAAGCGAACCATCGAGAAGT-3′BIP5′-CGTCGAATTCCCTCCCTCGC-ATTACGGTCGGACCGCAA-3′
1.4 LAMP反应体系
LAMP检测反应体系为25 μL,包括5 μmol/L外引物F3和B3各1.0 μL、40 μmol/L内引物FIP和BIP各1.0 μL、LAMP反应混合液[40 mmol/L Tris-HCl、20 mmol/L (NH4)2SO4、20 mmol/L KCl、16 mmol/L MgSO4、1.6 mol/L甜菜碱(Betaine)、2.0 mmol/L dNTPs、0.2% Trion X-100]12.5 μL、8 UBst聚合酶1.0 μL、DNA模板1.0 μL,用灭菌超纯水补足至25 μL;以荧光染料SYBR green Ⅰ为显色指示剂,于反应前在PCR管内盖上加入1.0 μL SYBR green Ⅰ,然后轻轻地盖上PCR管盖。LAMP反应条件:64 ℃温育60 min;采用荧光染料目测观察法判定反应结果,待LAMP反应结束后,瞬时离心PCR管,将染料与LAMP反应液混匀后观察颜色变化,避免因开盖检测而导致的气溶胶污染。若反应管中有目的DNA扩增,则反应液颜色呈现绿色,反之为橙色。实验至少重复3 次。
1.5 LAMP检测体系的特异性验证
取2.0 μL不同地区来源的苜蓿根腐病菌(F.solani)DNA作为模板,进行LAMP反应,以ddH2O替代目标菌的DNA模板为阴性对照。同时分别取2.0 μL其它供试菌株的DNA为模板进行LAMP反应,以苜蓿根腐病菌(F.solani)DNA为阳性对照。以反应后溶液颜色的变化对LAMP的特异性进行评估。实验至少重复3次。
1.6 LAMP检测体系的灵敏度验证
用ddH2O将已知浓度的苜蓿根腐病菌(F.solani)基因组DNA进行稀释,配制成10倍数量级的系列浓度(1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL、100 ag/μL和10 ag/μL),备用;分别取2.0 μL不同浓度的DNA作为模板进行LAMP反应。根据反应后溶液颜色的变化对LAMP的灵敏度进行判断。实验至少重复3次。
1.7 人工接种发病组织中苜蓿根腐病菌(F. solani)的LAMP检测
参照郭玉霞等[14]的方法将供试紫花苜蓿种子催芽后播种于装有灭菌土壤的花盆(高9.0 cm,底径7.5 cm,口径11.0 cm)中,待苜蓿苗长至约5 cm高时,按辛宝宝等[15]的方法将供试苜蓿根腐病菌接种于苜蓿苗上。将已接种的苜蓿苗置于(28±3)℃温室中,每天浇两次水,保持土壤湿润。7 d后,分别取接种发病和空白对照的苜蓿根部组织,按照DNA secure Plant Kit(Tiangen)说明书提取DNA,将其作为模板用于LAMP扩增。以从苜蓿根腐病菌(F.solani)纯培养菌丝提取的基因组DNA作为阳性对照,以ddH2O作为阴性对照。反应结束后根据溶液颜色变化判定结果。
2 结果与分析
2.1 苜蓿根腐病菌(F. solani)LAMP检测的特异性
LAMP对供试菌株的特异性验证结果显示,只有苜蓿根腐病菌(F.solani)反应管中溶液呈现绿色,其余镰刀菌、真菌、卵菌和空白对照的反应液的颜色均保持不变,为橙色(图2),表明所建立的LAMP能对F.solani的DNA进行扩增,而不能使其余菌株发生扩增反应,因此LAMP检测体系可以将苜蓿根腐病菌与其它病原菌区分开来,具有种的特异性。

1~3:苜蓿根腐病菌。4~5:非苜蓿根腐病菌。6:空白对照。图2 LAMP方法的特异性检测结果
2.2 LAMP检测的灵敏度
LAMP扩增灵敏度检测结果表明,浓度为1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL的苜蓿根腐病菌基因组DNA显色结果可观察到绿色荧光,其余浓度及阴性对照显色结果为橙色,说明所设计的苜蓿根腐病菌外引物F3/B3和内引物FIP/BIP通过了LAMP扩增,对苜蓿根腐病菌的检测灵敏度可达10 fg/μL(图3)。
2.3 人工接种发病苜蓿根部组织中F. solani的LAMP检测
提取接种苜蓿根腐病菌7 d后发病的苜蓿根部组织DNA进行LAMP扩增,结果显示,所有发病的苜蓿根部组织DNA均通过了LAMP扩增,显色可观察到绿色荧光;而空白对照的健康根部显色结果为橙色(图4)。表明所建立的LAMP检测体系可用于苜蓿根腐病菌快速可靠的检测和鉴定,同时还可直接用于苜蓿根腐病发病组织中病原菌的检测。
3 结论与讨论
根腐病是苜蓿生产上一种常见、易发和传播迅速的重要土传真菌病害[16]。因此,建立准确、快速、高效的检测方法,对阻止根腐病病原菌的传播蔓延具有重要意义,是有效防控该病的基础。
本研究以TEF-1α为靶标,建立了一种基于颜色判定的可快速、准确和灵敏地检测苜蓿根腐病菌(F.solani)的LAMP技术体系。TEF-1α基因作为镰刀菌PCR分子鉴定中的种特异性鉴定靶标,已被国内研究人员广泛地应用于镰刀菌的鉴定和快速分子检测中[17]。因此,以该基因为靶标序列设计镰刀菌的种特异性引物,可保证引物的高度特异性和广泛通用性。

1~9:分别为1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL、100 ag/μL、10 ag/μL。10:空白对照。
图3 LAMP方法的灵敏度检测结果

1:阳性对照。2:阴性对照。3、5、7:发病的根部组织。4、6、8:健康的根部组织。图4 植物组织中根腐病菌的LAMP检测结果
目前,检测植物根腐病原镰刀菌的主要步骤是从发病植物组织中分离菌株,利用传统形态学特征结合某些保守基因序列对分离物进行鉴定[18];另外,还有许多研究人员利用一些看家基因序列在镰刀菌不同种之间的保守性,针对镰刀菌不同种看家基因的特有位点设计种特异性引物并建立PCR检测体系[19-20]。这些方法虽然存在耗时长或需要特殊贵重仪器等缺点,但在镰刀菌鉴定和检测中得到了广泛的应用。与上述镰刀菌鉴定和检测方法相比,本研究所建立的LAMP检测方法具有如下优势:高效快捷,整个扩增反应可于1 h内完成,并可通过颜色对结果进行可视化判断;灵敏度高,对目标病原菌的检测灵敏度可达10 fg/μL,是常规PCR检测体系检测灵敏度的1000倍;运行环境硬件条件低,不需要PCR仪、凝胶成像仪等贵重设备,仅用水浴锅或加热套等简单恒温加热设备即可;适用范围更广,可对发病植物组织中的病原菌进行检测,可以克服植物组织中一些化学物质对病原目标DNA扩增的抑制。本研究所建立的LAMP检测方法可直接应用于田间苜蓿根腐病菌的快速检测,适用于仪器设备简单的科研单位和基层农技推广部门使用,具有较广阔的应用前景。
