青钱柳鲨烯合成酶(CpSS)全长基因的克隆、分析与表达
2020-03-06许小向尹忠平刘泽波严国荣陈继光上官新晨
许小向 尹忠平* 刘泽波 严国荣 陈继光 上官新晨,3
(1 江西省天然产物与功能食品重点实验室 江西农业大学食品科学与工程学院 南昌330045
2 江西农业大学动物科学与技术学院 南昌330045
3 江西省食品药品监督管理局 南昌330045)
青钱柳[Cyclocarya Paliurus(Bata1)Iljinsk]又名摇钱树、麻柳,为我国特有的双子叶植物纲胡桃科青钱柳属珍稀植物,主要分布于我国长江中下游地区,是江西省的特色资源。青钱柳中含有三萜、黄酮、多糖、皂甙、有机酸、甾醇和生物碱等多种活性成分,具有抗氧化、抗癌、抗炎、降糖降脂等多种生理活性和药理功能[1-5],也可以作为甜味剂。由于青钱柳繁育困难,且自然资源紧缺,所以严重制约了对其的综合开发利用。本实验室研究人员利用植物组织培养的方法诱导出疏松且稳定的青钱柳愈伤组织,并建立了稳定的细胞悬浮体系生产三萜酸[6],有效解决了青钱柳资源匮乏导致的开发利用难题。为提高青钱柳悬浮培养细胞中的三萜产量,郭春梅等[7]研究发现青钱柳悬浮培养细胞在接种后第8天添加150μmol/L硝普钠,持续作用4 d后总三萜酸产量达1 228.74mg/L,为对照组的2.14倍。熊琼琼等[8]在青钱柳悬浮培养细胞接种后的第4天加入质量浓度为200μg/mL的黑曲霉真菌诱导子,作用3 d后总三萜产量达到对照组的10.21倍。上述研究表明,外源添加诱导子可以有效促进青钱柳悬浮培养细胞生产三萜酸,有助于实现三萜酸的工业化生产。
三萜是青钱柳悬浮培养细胞的主要活性成分,为五环三萜类化合物,如熊果酸、齐墩果酸等。该类物质是由异戊二烯焦磷酸(IPP)经法尼基二磷酸合酶(FPS)催化形成法尼基焦磷酸(FPP),然后在鲨烯合成酶(SS)的作用下尾尾连接形成具有C30骨架的角鲨烯,角鲨烯再通过环化作用合成五环的三萜类化合物[9]。角鲨烯是所有三萜类化合物的共同前体,由鲨烯合成酶催化两分子的法烯基焦磷酸(FPP)生成,因此鲨烯合成酶是三萜类化合物生物合成途径中的一个重要调控酶和限速酶[10]。其含量和活性决定三萜化合物的产量,对调控三萜类物质的合成具有重要作用。
目前研究人员从拟南芥、葡萄、甘草、烟草、水稻、人参、西洋参和柴胡等植物中克隆到相应的鲨烯合成酶基因[11-14],且发现添加外源诱导物质可以影响鲨烯合成酶的表达水平,如茉莉酸甲酯(Me-JA)能够显著提高鲨烯合成酶基因的表达量[15]。以真菌诱导子处理烟草愈伤组织,可以减少愈伤组织中甾醇的合成量与积累量[16]。本文根据实验室前期获得的青钱柳转录组数据,以青钱柳悬浮细胞RNA为模板,采用RT-PCR和RACE技术克隆鲨烯合成酶(CpSS)基因的全长cDNA序列,并对其进行生物信息学分析,可为进一步研究和调控三萜代谢提供分子生物学依据。
1 材料与方法
1.1 材料与试剂
青钱柳愈伤组织,由本实验室以青钱柳幼叶为外植体诱导获得。
黑曲霉(编号CGMCC3.0453),购于中国普通微生物菌种保藏管理中心。
SMARTer RACE试剂盒、EasyPureRPlant RNA Kit、cDNA逆转录试剂盒、质粒DNA小量提取试剂盒、琼脂糖、胶回收试剂盒、TaqDNA聚合酶和DNA Marker,北京全式金生物有限公司;无水乙醇(分析纯),天津永大化学试剂有限公司。
1.2 仪器与设备
全自动凝胶成像及分析系统,美国Syngene公司;电泳仪,美国Bio-Red公司;S1000-PCR仪,美国Bio-Red公司;超微量蛋白核酸测定仪,英国Biodrop Ulite公司;荧光定量PCR仪,美国Bio-Red公司;5417R型台式高速冷冻离心机,德国Eppendorf公司;DYCP-31BM型水平电泳槽,北京市六一仪器厂;电热恒温培养箱,美国Bio-Red公司;恒温摇床,上海智诚分析仪器有限公司。
1.3 方法
1.3.1 青钱柳细胞的悬浮培养及诱导 青钱柳细胞的悬浮培养和黑曲霉诱导子的制备参照熊琼琼等[8]的方法。在细胞的对数期中期(第4天)添加质量浓度为200μg/mL的黑曲霉真菌诱导子进行诱导,分别采集新鲜的未添加诱导子、诱导10,20,30,40 h和60 h的悬浮培养细胞样本,经液氮速冻后于-70℃贮存备用。
1.3.2 总RNA提取和cDNA第1链的制备 采用植物RNA试剂盒提取青钱柳悬浮细胞的总RNA,检测其浓度、纯度及完整性。用试剂盒中的反转录试剂及自备引物5’CDS Primer A和3’CDS Primer A合成青钱柳5’和3’cDNA第1链。
1.3.3 CpSS全长基因的克隆 根据本实验室转录组测序的青钱柳CpSS基因的cDNA序列分别设计5’和3’RACE引物(见表1),采用Clontech公司SMARTerTM RACE cDNA Amplification试剂盒,以合成的5’和3’RACE cDNA为模板进行PCR扩增,分别获得CpSS的5’-RACE片段和3’-RACE片段。PCR扩增体系(50μL):5’和3’RACE cDNA,2.5μL;2×SeqAmp Buffer,25μL;SeqAmp DNA Ploymerase,1.0μL;PCR-Grade H2O,15.5μL;10×UPM,5μL;5’和3’GSP,1μL。反应条件:94℃预变性5min;94℃变性30 s,68℃退火30 s,72℃延伸3min,35次循环;72℃终延伸10min。应用凝胶回收试剂盒对PCR特异性扩增产物回收纯化,将纯化产物与pUC19载体连接,转化克隆进入感受态细胞,送生工生物工程(上海)股份有限公司测序。采用DNAstar软件将获得的5’和3’序列进行拼接,得到青钱柳CpSS全长基因序列。根据拼接的CpSS的全长基因序列设计全长克隆引物(引物见表1),克隆CpSS的全长基因,以验证拼接的序列。

表1 引物设计表Table1 Design of primer
1.3.4 CpSS全长基因的生物信息学分析 根据CpSS基因的克隆结果,利用NCBI中的ORF Finder预测CpSS基因的开放阅读框,并推导出氨基酸序列;利用Prot Param在线分析软件对推导的氨基酸序列进行基本理化特性分析;利用Prot Scale进行氨基酸序列的疏水性和亲水性分析;利用SignalP4.1分析潜在信号肽剪切位点;利用SOPMA在线软件对CpSS蛋白质二级结构进行分析;利用SWISS MODEL在线软件对蛋白质三级结构进行预测;利用GenBank数据库中的Blastp程序对氨基酸进行保守域预测及同源性分析;利用DNAMAN软件对同源氨基酸进行多重比对,用Clustalx和MEGA 5.02软件构建系统进化树。
1.3.5 CpSS基因的实时荧光定量PCR检测 利用Primer 5.0设计CpSS基因的特异性引物。以GAPDH基因为内参引物,通过RT-PCR技术对CpSS基因进行实时荧光定量分析,检测该基因在黑曲霉诱导青钱柳悬浮细胞不同时间的表达量。
2 结果与分析
2.1 青钱柳悬浮培养细胞总RNA提取及CpSS基因全长cDNA的克隆
为获得CpSS基因的全长cDNA序列,以转录组测序数据中CpSS的序列为模板设计引物,利用RACE-PCR技术分别得到5’-RACE和3’-RACE产物片段,凝胶电泳和成像分析结果如图1所示。5’-RACE和3’-RACE产物条带单一明亮,将该两条带分别进行切胶、回收、纯化、克隆和测序,5’-RACE和3’-RACE产物长度分别为1 332 bp和896 bp。采用DNAstar软件将5’-RACE和3’-RACE序列进行拼接,得到CpSS基因全长cDNA序列,其长度1 667 bp。以拼接所得的CpSS序列为模板,利用Primer Premier 5.0设计基因特异性引物。以青钱柳cDNA为模板克隆CpSS全长序列,结果(图2)表明,克隆得到的CpSS序列与拼接的序列长度一致。
2.2 CpSS基因序列分析
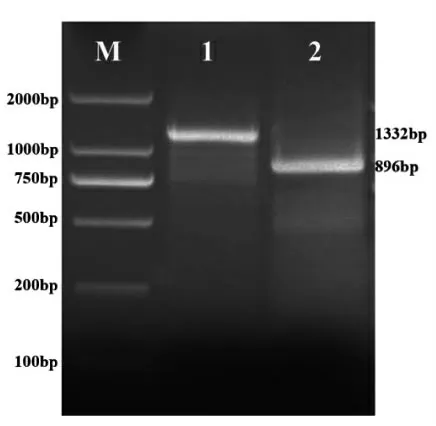
图1 CpSS基因5'RACE和3'RACE产物凝胶电泳成像图Fig.1 Gel electrophoresis image of 5'RACE and 3'RACE fragment of CpSS
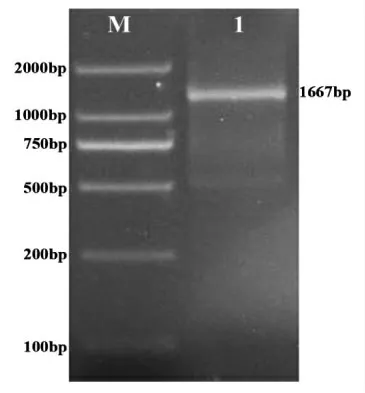
图2 CpSS基因全长克隆电泳图Fig.2 Gel electrophoresis image of full length CpSS gene
ORF Finder预测结果表明,克隆得到的长度为1 667 bp的CpSS基因全长序列中包含一个1 245 bp的完整ORF,该ORF编码414个氨基酸,如图3所示。与NCBI中已收录的序列进行同源比对,发现青钱柳鲨烯合成酶基因与胡桃的相似度最高,达97%,与白桦、葡萄、大豆、甘草、可可5种植物的相似度都达到85%。将CpSS所编码的蛋白与其它植物相对比,发现与胡桃、白桦、葡萄、大豆的鲨烯合成酶基因所编码的蛋白同源性在85%以上(如表2)。挑选8个同源性较高的物种,采用Cluster对CpSS的氨基酸序列进行比对分析,发现CpSS基因的氨基酸序列与其它物种有较高的同源区,该区的氨基酸残基的保守性较高。由此推测该区域可能是鲨烯合成酶的功能结构域。
在线软件ProtParam分析结果表明,CpSS编码的多肽的原子组成为C2141H3377N571O596S28,含有6 713个原子,分子质量为47 550.5 u,等电点p I为8.86,脂肪系数93.26,不稳定系数为42.03,属于不稳定蛋白。在组成CpSS蛋白的20种氨基酸中,无酪氨酸和缬氨酸,亮氨酸(Leu)所占比例最高,达到10.4%,色氨酸含量最低,为1.0%,含有45个带负电荷氨基酸残基,54个带正电荷氨基酸残基。利用ExPASy中的ProtScale分析可知,CpSS蛋白质的氨基酸残基中351位的亲水性最强(MIN:-2.478),395位的疏水性最强(MAX:3.722),且亲水性的氨基酸数量多于疏水性的氨基酸数量,推断该蛋白为亲水性蛋白。经SignalP-4.1预测,CpSS编码的氨基酸序列中没有信号肽,不存在剪切位点,表明该蛋白翻译后无需跨膜转运。利用PSORT Prediction预测蛋白质的亚细胞定位,结果表明:该蛋白可能存在于内质网膜中。
采用Smart在线软件分析CpSS蛋白的跨膜结构域,结果表明该蛋白具有两个跨膜结构,分别位于第282~304位和387~409位氨基酸区域。经BLAST保守结构域预测,CpSS蛋白含有典型的萜类代谢途径酶的5个保守区功能,如图4所示,分别为酶的底物结合域、底物-Mg2+结合位点、活性残基位点、氨基酸残基和两个富含天冬氨酸域,与预测的香鳞毛蕨鲨烯合成酶基因的保守结构域一致[17]。

图3 CpSS核苷酸序列及氨基酸序列Fig.3 Nucleotide sequence and amino acid sequence of CpSS
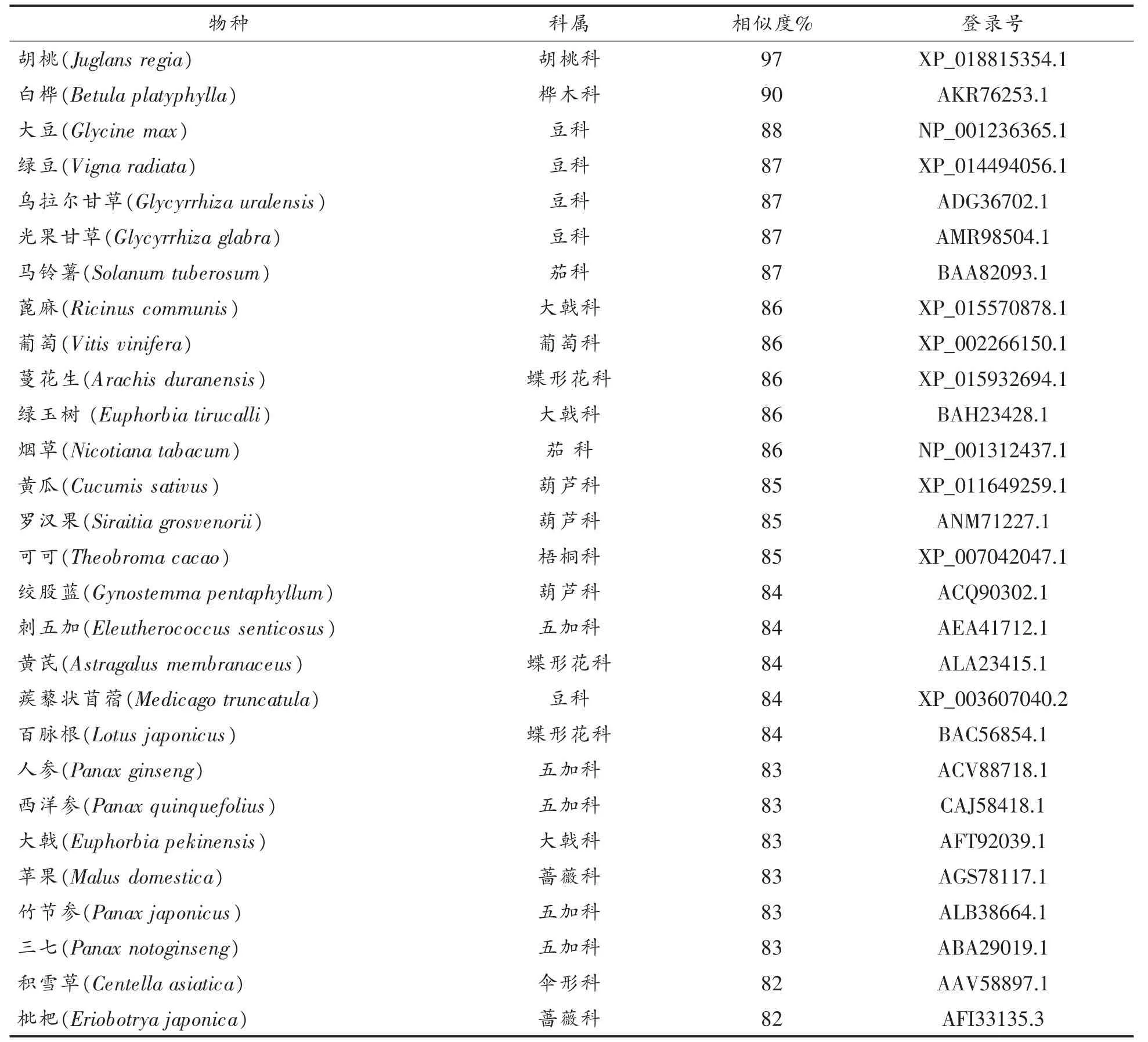
表2 青钱柳与其它物种同源性比对结果Table2 The homology between Cyclocarya paliurus and other plants
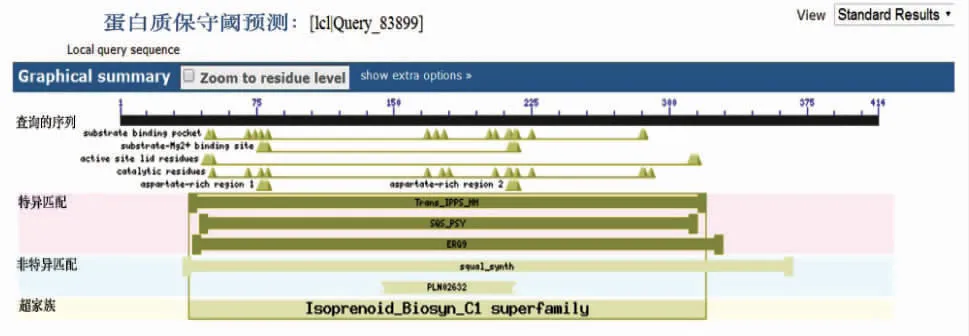
图4 预测的CpSS蛋白保守结构域Fig.4 The forecasted conservative domins of CpSS
2.3 CpSS蛋白结构分析
采用SOPMA预测了CpSS蛋白的二级结构,结果如图5所示。图中上行为氨基酸序列,下行为其所对应的二级结构,其中h代表α-螺旋(alpha helix)、e代表延伸链(extended strand)、t代表β-转角(beta turn)、c代表无规则卷曲(random coil)。预测结果表明,CpSS蛋白二级结构组分中,h占66.18%,e占8.70%,t占5.07%,c占20.05%。由此可推测,α-螺旋和无规则卷曲是CpSS的大量结构元件,而延伸链和β-转角则散布于整个蛋白质中。以SWISS MODEL对CpSS编码氨基酸的三级结构进行预测,结果(图6)表明,该蛋白由多个α螺旋组成空穴状结构,进而形成底物结合域与催化位点,这与大多数植物鲨烯合成酶的结构相似。

图5 CpSS蛋白的二级结构Fig.5 Secondary structure of CpSS
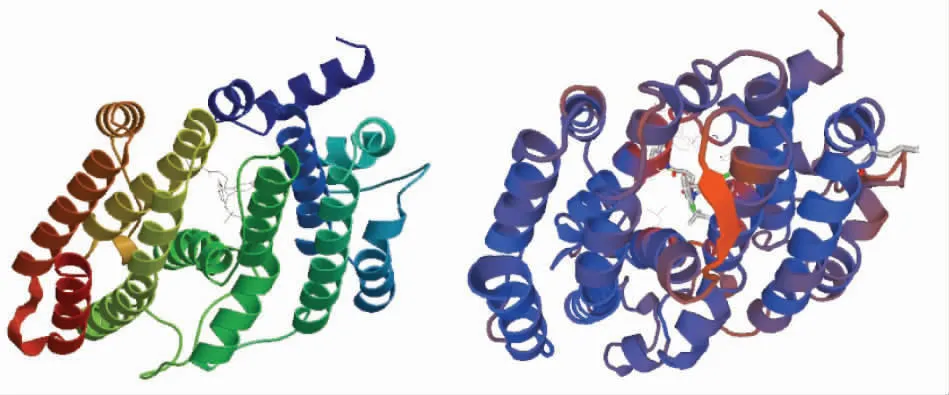
图6 CpSS蛋白的三级结构Fig.6 Three dimensional structure of CpSS
2.4 系统进化树的构建
根据CpSS编码的蛋白序列在NCBI中的比对结果,下载30条同源性较高的蛋白序列,采用MEGA 6.0软件分析其编码的蛋白与其它物种的同源性,并选择邻接法构建进化树(图7),结果表明CpSS基因的蛋白序列与白桦、胡桃聚为一类,表明与它们的亲缘关系较近。
2.5 黑曲霉诱导子作用下青钱柳悬浮培养细胞CpSS的表达
实时荧光定量PCR检测结果表明,青钱柳悬浮培养细胞在黑曲霉诱导子的作用下,从诱导时开始到60 h内,CpSS的表达量显著增加,且随着时间的延长其表达量呈现持续升高的趋势(如图8所示)。与对照组相比,诱导后60 h时CpSS的表达量为对照组5.62倍。本文发现的CpSS在黑曲霉诱导子诱导后的表达变化情况与熊琼琼等[8]研究的青钱柳悬浮培养细胞中总三萜含量的变化情况一致,说明黑曲霉诱导子通过促进青钱柳悬浮培养细胞CpSS的表达量来提高三萜的合成量。

图7 基于鲨烯合成酶分析的青钱柳系统进化树Fig.7 Phylogenetic tree of Cyclocarya paliurus based on the CpSS analysis
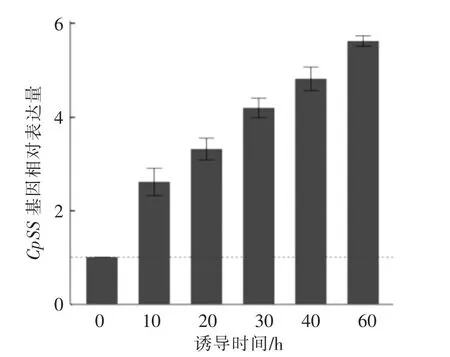
图8 黑曲霉诱导子作用下青钱柳悬浮培养细胞鲨烯合成酶基因的表达变化Fig.8 Relative expression changes of CpSS in Cyclocarya paliurus suspension cells induced by Aspergillus niger elicitor
3 讨论
采用RACE-PCR技术首次从青钱柳悬浮培养细胞中克隆到一个鲨烯合成酶基因,命名为CpSS。该基因包含一个1 245 bp的完整ORF。通过BLAST比对分析,发现其与许多已克隆物种的SS基因序列有很高的同源性,且该基因编码的蛋白与已报道的多种植物的SS具有相同的活性保守区,表明在植物进化中SS蛋白的催化功能结构域是高度保守的。
三萜类物质是青钱柳悬浮培养细胞的主要活性成分,为五环三萜类化合物。鲨烯合成酶(SS,EC 2.5.1.21)是三萜类化合物生物合成途径中的一个重要调控酶和限速酶,可以催化两分子法尼基二磷酸(FPP)缩合形成角鲨烯二磷酸(PSPP),而后在NADPH和Mg2+的辅助下[18],PSPP经过重排反应转化为角鲨烯,这是生物合成三萜的必要途径[19]。鲨烯合成酶对三萜的合成具有重要作用,其含量和活性决定了三萜的产量,因此研究该酶的结构和表达对于探索植物三萜代谢机制和调控三萜合成具有重要意义。研究发现,通过外源添加诱导子调节合成途径中相关酶的表达,可以有效调控次生代谢产物的合成。Suzuki H等[20]研究表明,在蒺藜苜蓿悬浮培养细胞中添加一定浓度的MeJA可以促进SS基因的表达。在甘草细胞中加入MeJA诱导后,不仅提高了SS酶的活性,而且提高了终产物大豆皂苷的积累量[21]。本文qRTPCR检测结果表明,CpSS基因的表达量在黑曲霉诱导子作用下显著提高,诱导60 h时表达量达到最大,诱导作用下CpSS表达量的变化与悬浮培养细胞中总三萜含量的变化相一致[8]。综上所述,通过各种诱导技术来调控CpSS的表达量,进而达到提高三萜产量的目的。
