绿豆皮黄酮对H2O2诱导人脐静脉血管内皮细胞损伤的保护作用
2020-03-06姬青华马丽苹樊金玲朱文学杜冠尚
罗 磊 姬青华 马丽苹 樊金玲 朱文学 杜冠尚
(河南科技大学食品与生物工程学院 河南省农产品干燥装备工程技术研究中心 河南洛阳471023)
血管内皮细胞是指衬于心、血管以及淋巴管内表面单层扁平上皮细胞,能够起到调节血管张力,维持其正常功能的作用[1]。动脉粥样硬化、脑缺血、心肌梗死等心血管性疾病常与血管内皮细胞的损伤和功能失调有关[2]。自由基的氧化作用导致细胞内脂质、核酸和氨基酸的过氧化损伤,破坏细胞结构并引发功能紊乱,甚至导致细胞衰老、癌变和死亡[3-5]。氧化应激产生的活性氧是参与血管内皮损伤的主要病理因素。H2O2是体内常见活性氧,能够与细胞内Fe2+生成活性更强的羟自由基,并作用于细胞膜脂质,造成脂质过氧化反应,从而引发细胞膜损伤[6]。现今抗氧化物质终止自由基作用的相关研究备受重视[7],从天然产物中提取抗氧化剂成为新型药物研发的重要内容,而黄酮类化合物正是重要的来源。
绿豆是我国传统饮食的重要原料之一,中医认为绿豆及花、叶、种皮均可入药,其味甘性寒,可清热解毒、消肿利尿[8]。研究发现,绿豆的抗氧化能力通常被认为是种皮中的多酚类物质提供的,而酚类物质主要来源于绿豆皮中,其抗氧化成分占到整个绿豆的87%[9]。牡荆素和异牡荆素是绿豆皮中主要的黄酮类物质,分别占绿豆皮总黄酮的51.99%和45.42%,并被认为是主要的抗氧化剂成分[10]。对于绿豆皮黄酮物质的抗氧化作用已引起研究者的重视。有研究发现从绿豆皮干粉中提取的黄酮的自由基清除率与VC相当[11-12]。张竞竞等[13]研究表明,高温处理后灌胃绿豆皮水提液对大鼠血清抗氧化能力提高效果明显;Jang等[14]研究发现绿豆皮能够明显改善Ⅱ型糖尿病小鼠的高血糖和抗氧化状态。目前,国内外对于绿豆皮黄酮物质的抗氧化研究主要集中在体外抗氧化及动物实验等方面,有关绿豆皮黄酮对H2O2诱导所致血管内皮细胞损伤的保护作用的报道较少。本试验采用体外细胞培养方法,建立H2O2诱导血管内皮细胞损伤模型,研究绿豆皮黄酮对HUVEC细胞的SOD、GSH-Px、LDH活力及GSH、MDA含量的影响,探讨绿豆皮黄酮物质对抗细胞损伤作用及其机制,为绿豆皮应用于心血管疾病提供试验依据。
1 材料
1.1 材料与试剂
牡荆素(CAS号:29702-25-8)和异牡荆素(CAS号:3681-93-4),上海源叶生物科技有限公司;人脐静脉血管内皮细胞(HUVECs),舜冉(上海)生物科技有限公司;DMEM高糖培养基,Hyclone公司;噻唑蓝,sigma公司;双抗(青霉素-链霉素)、胎牛血清、胰酶,Gibco公司;SOD、GSHPx、GSH、MDA及LDH试剂盒,南京建成;其它药品均为生化试剂或分析纯试剂。
1.2 仪器与设备
CKX41倒置显微镜,OLYMPUS公司;酶标仪,Bio-Rad公司;旋涡仪,上海沪西;UV2400紫外-可见分光光度计,上海舜宇恒平;Agilent 1260型高效液相色谱仪,安捷伦;E191IR型CO2细胞培养箱,金西盟公司;LDZX-50KB压力蒸汽灭菌器,上海申安医疗器械厂;SCIENTZ-10N冻干机,新芝生物科技公司;SW-CJ-2FD净化工作台,苏州净化设备有限公司;HL-2D恒流泵,上海圣科。
1.3 试验方法及内容
1.3.1 绿豆皮黄酮的提取及含量测定 绿豆皮粉末和70%的乙醇按1∶20混匀,540W功率微波提取80 s,提取液4 800 r/min离心10min,40℃下旋蒸除醇,然后加4倍体积乙醇除蛋白质、多糖,经过滤、离心、浓缩。采用醋酸-醋酸钠-三氯化铝显色法[15]进行全波长扫描,最大吸收峰在270 nm处。以芦丁为标样,所得回归方程:y=25.405x+0.1285(x:黄酮质量浓度(mg/mL);y:吸光度),相关系数R2为0.9963。移取0.4mL黄酮提取液至10 mL具塞刻度试管中,在270 nm处测吸光度,按下面公式计算绿豆皮黄酮含量。

式中,C——提取液黄酮质量浓度(mg/mL);V——提取液体积(mL);N——稀释倍数;M:原料质量(g)。
1.3.2 绿豆皮黄酮的纯化 根据文献[16]做适当修改,通过优化得到纯化条件。将预处理完毕的树脂NKA-9装入1.6 cm×60 cm玻璃层析柱,柱床体积(1 BV)80mL。将2 BV质量浓度为0.45mg/mL的绿豆皮黄酮提取液(pH 3)上树脂柱吸附,待充分吸附后,先用2 BV的蒸馏水洗脱除杂,再用2.3 BV 70%的乙醇溶液(pH 5)为洗脱剂,以2.5 BV/h洗脱,收集洗脱液,浓缩冷冻干燥得到绿豆皮黄酮粗提物。
1.3.3 HPLC分析 标样制备:精密称取牡荆素、异牡荆素标准样品,用甲醇溶解定容10mL,所得混合标样质量浓度分别为210μg/mL和220μg/mL[17]。
供试液制备:将1.3.1节中制备的绿豆皮黄酮0.0036 g用甲醇溶解并定容10mL,过0.45μm滤膜,得样品溶液。
高效液相色谱工作条件:色谱柱:安捷伦SBC18反相色谱柱;柱温:25℃;检测器:二极管阵列检测器;检测波长:268,335 nm;进样量:10μL;流动相:A甲醇,B 1%PBS缓冲液;洗脱梯度:0~15 min,25%A,75%B;15~20min,100%A,0%B;流速:0.6mL/min;后运行时间:5min。
1.3.4 细胞抗氧化
1.3.4.1 HUVEC细胞的培养 配制DMEM高糖培养基,其中含1%双抗和10%胎牛血清,并将适量培养基加入细胞培养瓶,然后进行细胞接种,在37℃、5%CO2的条件下培养[18]。当细胞覆盖率70%~80%时传代,按照细胞生长速度按时更换培养液。
1.3.4.2 HUVEC细胞氧化损伤模型的建立 以每孔200μL的量将对数生长期HUVEC细胞接种于96孔板,使其细胞密度达到2.0×105个/mL。在37℃、5%CO2细胞培养箱中培养24 h,在观察到细胞贴壁时,弃上清,加入不同浓度梯度的H2O2溶液,每个梯度6个平行。培养24 h弃上清,缓冲液洗涤2次,每孔加入200μL培养基和10μL质量浓度5mg/mL的MTT,在CO2培养箱中培养4 h后弃上清,每孔加入150μL DMSO,室温放置10min,放入酶标仪,在490 nm处测定其吸光度。按照下列公式来计算细胞存活率。

式中,A0——空白组;A1——不同浓度H2O2组。
1.3.4.3 绿豆皮黄酮质量浓度的筛选 方法同
1.3.4.2 节,仅将所加入的“不同浓度梯度H2O2溶液”替换为不同浓度的绿豆皮黄酮溶液。
1.3.4.4 SOD、GSH-Px、GSH、MDA、LDH测定将HUVEC细胞(密度2.0×105个/mL)接种于6孔板中,每孔加入2.0mL,在37℃、5%CO2条件下培养24 h,当观察到细胞完全贴壁,立即吸弃细胞培养液。对空白组和H2O2损伤组分别加入培养基2.0mL;对试验组分别加入2.0mL不同质量浓度绿豆皮黄酮培养液;VC对照组中加入质量浓度为250 g/mL的VC培养液2.0mL,在培养箱中培养24 h后吸弃上清液,每孔加入2.0mL 750mol/L H2O2溶液,培养4 h后分离细胞和细胞培养液。离心(4℃,1 500 r/min,5min)细胞培养液,取上清,待测。细胞用磷酸盐缓冲液清洗2次,离心(4℃,1 000 r/min,10min),留细胞团块。加入0.5mL磷酸盐缓冲液,在冰水浴中超声破碎,超声条件为400W,3~5 s/次,间隔30 s,重复3次。按照试剂盒说明书方法测定细胞及细胞培养液中SOD、GSHPx、GSH、MDA、LDH水平。
1.3.5 数据处理 统计分析所用软件为DPS 7.5,采用ORIGIN85软件作图,数据采取平均值±标准差。进行单因素方差分析,采用LSD法作多重比较,用不同小写字母显示组间差异显著性(P<0.05)。
2 结果与分析
2.1 HPLC结果
对经NKA-9大孔吸附树脂纯化的绿豆皮黄酮进行液相分析,与标准品对比,由图1可知,绿豆皮提取物中主要含有牡荆素和异牡荆素两种碳苷类黄酮,占提取物总黄酮的90%以上。
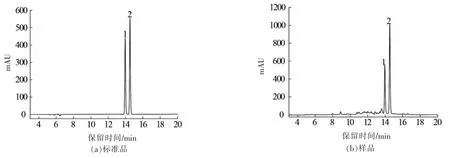
图1 标准品、样品HPLC图Fig.1 The HPLC chromatogram of reference substances and sample
2.2 细胞抗氧化结果
2.2.1 H2O2浓度对HUVEC细胞增殖的影响如图1所示,在一定浓度范围内,HUVEC细胞存活率随H2O2浓度的升高而降低。当H2O2质量浓度低于500μmol/L时,细胞存活率在90%以上;当质量浓度在500~1 000μmol/L范围时,细胞存活率显著下降,在质量浓度为1 000μmol/L时有54.49%的存活率;当H2O2浓度大于1 000 μmol/L时,细胞的存活率在30%以下。综合考虑后选用1 000μmol/L H2O2作用24 h作为最佳造模条件。
2.2.2 绿豆皮黄酮浓度对HUVEC细胞增殖的影响从图2可以看到,绿豆皮黄酮质量浓度在0~80μg/mL范围时,能够显著促进HUVEC细胞的增殖分化;在绿豆皮黄酮质量浓度0~20μg/mL范围,对细胞的增殖作用不明显,而当质量浓度为20,60,80μg/mL时,细胞的存活率分别达到108.98%,118.41%和128.33%,大大促进细胞的生长;当绿豆皮黄酮的质量浓度大于80μg/mL时,显著抑制HUVEC细胞的增殖(P<0.05),其存活率显著下降,达到77.32%。选择质量浓度为20,60,80μg/mL的绿豆皮黄酮做后续试验。

图2 不同浓度H2O2对HUVECs增殖的抑制作用Fig.2 Inhibition effect of hydrogen peroxide on the viability of HUVECs
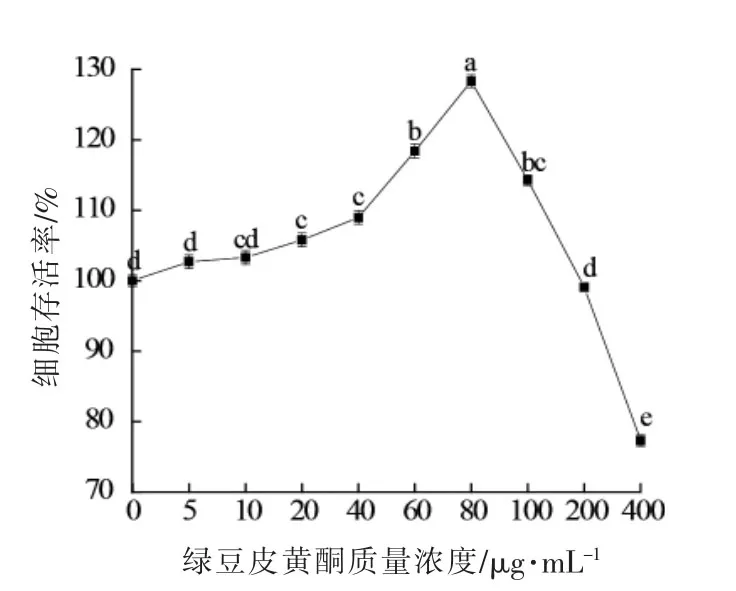
图3 不同浓度绿豆皮黄酮对HUVECs增殖作用的影响Fig.3 Dose-dependent effects of flavonoids from mung bean hull on the viability of HUVECs
2.2.3 HUVEC细胞和细胞培养液SOD活性研究SOD是机体内清除自由基的第一道防线,主要清除O2-,催化其发生歧化反应,将超氧化物转化为H2O2和H2O,从而达到清除自由基的目的[19-20]。SOD活力的高、低间接反映机体清除氧自由基的能力。从图2可以看到,相对于空白组细胞和细胞培养液中的SOD活性,H2O2损伤组显著降低(P<0.05),绿豆皮黄酮各剂量组呈剂量依赖性地提高细胞和培养液中SOD活性。与VC对照组细胞中的SOD活性相比,绿豆皮黄酮各剂量组均有显著差异(P<0.05),而低剂量除外。其它剂量组与VC对照组无显著差异(P>0.05)。
2.2.4 HUVEC细胞和细胞培养液GSH-Px活性研究 GSH-Px是一种有机体内广泛存在的能特异催化还原性谷胱甘肽(GSH)还原H2O2的酶,表现出对细胞膜结构及其功能显著的保护作用,能够延缓衰老[21]。从图4可以看到,相对于空白组细胞和细胞培养液中GSH-Px活性,模型组呈显著下降(P<0.05),而绿豆皮黄酮各剂量组与模型损伤组相比,细胞和培养液中GSH-Px的活性得到显著提升(P<0.05),呈一定的量效依赖关系。其中各剂量组细胞中GSH-Px的活性差异显著。高剂量组在细胞和培养液中的GSH-Px活性与VC组相比差异不显著(P>0.05),这表明绿豆皮黄酮起到催化GSH对氢过氧化物的还原反应,阻断体内脂质过氧化,保护细胞免受氧化损伤的重要作用。
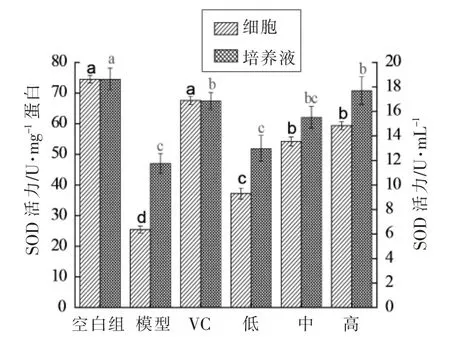
图4 HUVEC细胞及细胞培养液的SOD活性Fig.4 SOD activities in HUVEC cells and cell culture medium
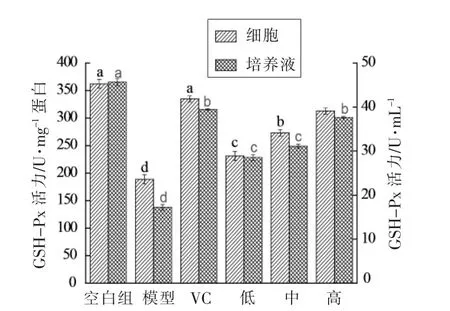
图5 HUVEC细胞及细胞培养液中GSH-Px活性Fig.5 GSH-Px activities in HUVEC cells and cell culture medium
2.2.5 HUVEC细胞及细胞培养液中LDH活性LDH是细胞损伤的重要标志,LDH一种细胞内的糖酵解酶,广泛存在于细胞浆内,当细胞受损或细胞膜通透性发生改变时,LDH由细胞渗透至培养液中的量明显增多,因此,细胞和细胞培养液中LDH的活性可以客观衡量细胞受损程度[22-23]。如图5所示,与空白组相比,终浓度为1 000μmol/L的H2O2作用24 h后,模型组细胞LDH活力明显下降,而细胞培养液LDH含量较高,说明细胞受H2O2损伤后发生LDH泄露,使培养液中含量增加。相对于H2O2损伤组,绿豆皮黄酮各剂量组细胞中LDH活性明显升高,而细胞培养液中LDH活性有所下降(P<0.05),表明绿豆皮黄酮对H2O2诱导的细胞膜受损有预防或减缓作用,能够阻止细胞内LDH向细胞外扩散。与VC对照组相比,绿豆皮黄酮高剂量组细胞中LDH含量差异不显著(P>0.05),而各剂量组在培养液中LDH活性差异显著,高于VC对照组(P<0.05)。
2.2.6 HUVEC细胞及细胞培养液中GSH活性GSH是细胞内源性巯基抗氧化剂,能有效防止脂质过氧化,从而减轻氧化应激造成的损伤[24-27]。如图6所示,H2O2模型组在细胞和培养液中的GSH含量显著低于空白组(P<0.05),与H2O2模型组相比,绿豆皮黄酮各剂量组对由H2O2引起的细胞及细胞培养液GSH含量下降起到明显的抑制作用(P<0.05),呈剂量依赖性。绿豆皮黄酮高剂量组在细胞中的GSH含量与VC对照组无显著差异(P>0.05),而在培养液中GSH含量与VC对照组差异显著(P<0.05),相对于与VC组细胞和培养液中的GSH含量,低、中剂量组呈现显著差异(P<0.05)。
2.2.7 HUVEC细胞和细胞培养液的MDA含量MDA是脂质过氧化过程中的代谢产物,是极其活泼的交联剂,能引起DNA、蛋白质、核酸等大分子的交联聚合,影响细胞的分裂,破坏蛋白和酶的结构与功能,从而反映机体内脂质过氧化程度和细胞受损程度[28-30]。从图7可以看到,H2O2损伤24 h后,相对于空白组细胞和细胞培养液中的MDA含量,H2O2模型组均显著升高(P<0.05)。相对于H2O2模型组细胞和细胞培养液中MDA含量,绿豆皮黄酮各剂量组均能够显著抑制由H2O2引起的MDA含量增加(P<0.05),同时表现出剂量依赖性,且当绿豆皮黄酮在高剂量即质量浓度为80μg/mL时,与VC对照组的MDA含量差异不显著(P>0.05)。

图8 HUVEC细胞和细胞培养液的MDA含量Fig.8 MDA content in HUVEC cells and cell culture medium
以体外培养的人脐静脉血管内皮细胞进行H2O2诱导,建立HUVEC氧化应激损伤模型,探究绿豆皮黄酮对H2O2损伤HUVEC的保护作用及可能的机制。研究结果表明,H2O2能够诱导血管内皮细胞的损伤,并显著降低细胞存活率,当H2O2浓度达到1 000μmol/L,细胞存活率约为50%,造成细胞损伤;绿豆皮黄酮的质量浓度在20~80μg/mL范围时,能够促进HUVEC细胞的增殖。HUVEC细胞经H2O2损伤,细胞与细胞培养液中的有害物质MDA含量显著升高,SOD、GSH-Px、LDH活性降低较为显著,而添加不同剂量绿豆皮黄酮时,损伤细胞抗氧化活性均表现出显著增强,并存在剂量依赖性。绿豆皮黄酮能提高细胞和细胞培养液中各种抗氧化活性指标,降低MDA含量,增加GSH活性,减轻LDH向细胞外的扩散。
3 结论
综上所述,绿豆皮黄酮可以显著减缓H2O2诱导的HUVEC损伤而导致抗氧化活性下降,提高细胞内各类抗氧化酶的活性,降低机体内氧活性和有害物质含量,维持细胞稳定。绿豆皮黄酮的保护作用机理是:抑制脂质过氧化并清除氧自由基,提高机体抗氧化酶活性,修复受损内皮细胞。
