苯酚胁迫下多刺裸腹溞实时定量PCR内参基因的筛选
2020-03-04刘文秀
王 茜 刘文秀 高 菲 王 兰
(山西大学生命科学学院, 太原 030006)
枝角类是生态毒理学中常用的化学物质生态毒性评价模型之一[1]。多刺裸腹溞(Moina macrocopa)作为常见的枝角类, 是除大型溞(Daphnia magna)和蚤状溞(Daphnia pulex)之外的又一理想材料, 是山西省水体中的优势物种, 全身透明、繁殖率高、对农药等化学品具有高的敏感性[2], 常被用于水环境的生物监测。目前关于多刺裸腹溞分子生物学方面的研究较少, 相关分子生物学信息匮乏,限制了外源化学物质对其毒性效应的分子机制的研究。
实时定量PCR(Quantitative Real-Time PCR,qRT-PCR)是在传统聚合酶链式反应(Polymerase chain reaction, PCR)的基础上发展起来的一项新的核酸定量技术[3], 操作快速灵敏、具有特异性强、定量准确、检验范围广等特点, 随着技术的不断成熟, 广泛应用于多个领域[4]。qRT-PCR主要有绝对定量和相对定量两种方法, 其中相对定量不需要已知的标准品, 相对简便因而被大量采用[5], 但前提是需要稳定的内参基因。
内参基因是指在对某一个目的基因进行定量研究时, 在实验条件下待测样品中表达相对恒定的一类基因, 其作用是校正目的基因的定量过程[6]。常用的内参基因大多是管家基因(House-keeping gene), 包括编码组蛋白基因、线粒体蛋白基因、编码核糖体蛋白基因、生物代谢途径中各种关键酶的基因等, 如rRNA、β-actin、cyclophilin、hsp、gapdh、rpl13等[7]。这些管家基因大多参与了生物体基本代谢活动, 因而具有稳定表达的特性[8]。但内参基因并非在所有生理条件下都能稳定表达, 在特定实验条件或某些组织细胞中各基因的表达稳定性有差异[9], 至今还未发现一个适合所有条件下基因表达分析的内参基因[10]。镉胁迫斑马鱼(Danio rerio)后,ef1a、rpl13a、gapdh和rplp2分别是在肾脾脏、肝脏、鳃和肠道中稳定表达的内参基因[11]。弧菌免疫后拟穴青蟹(Scylla paramamosain)的血细胞选择ef1a、UPQ作为内参基因, 但其他组织选择18S rRNA和ef1a作为内参基因[12]。因此, 在进行目的基因相对定量分析中, 不同的实验条件甚至同一实验条件不同组织都需要进行内参基因的筛选。目前对多刺裸腹溞进行实时定量PCR分析研究的报道较少[13], 有关内参基因的信息缺乏。鉴于此, 本研究设计合成了多刺裸腹溞β-actin、16S rRNA和12S rRNA的特异性引物, 利用内参基因表达水平(Ct值)[11,14]、GeNorm[15]、NormFinder[16]和BestKeeper[17]四种方法分析了苯酚胁迫下各基因的表达稳定性, 从中筛选出最佳内参基因, 为进一步研究苯酚胁迫下多刺裸腹溞相关目的基因的表达奠定基础。
1 材料与方法
1.1 实验动物
多刺裸腹溞(Moina macrocopa)采自山西省太原市小店区北张村, 在本实验室经过三代以上孤雌生殖培养, 其敏感度达到GB/T 13266—91的要求[18]。
1.2 实验方法
苯酚处理及样品采集选取健康状况良好的一日龄幼溞, 分别接种到盛有不同浓度苯酚(0、0.25、0.75、1.25、1.75和2.25 mg/L)的烧杯中, 水温控制在(25±1)℃, 光照周期为光:暗=16h:8h。培养期间不喂食。在苯酚染毒处理后, 将存活的多刺裸腹溞过滤、用DEPC水清洗、吸掉多余水分, 称量0.1 g置于提前装有1 mL Trizol的无RNA酶的EP管中, 于-80℃保存。实验重复3次, 每次2个平行。
总RNA提取和cDNA合成用Trizol法[19]提取总RNA, 经凝胶电泳和分光光度计检测总RNA的质量。利用5×All-In-One RT MasterMix试剂盒(镇江ABM公司提供)将总RNA合成cDNA并置于-20℃保存备用。
引物设计、内参基因的扩增及PCR产物纯化从NCBI数据库获得多刺裸腹溞三个内参基因β-actin、16S rRNA和12S rRNA的CDS序列, 并利用Primer 3软件设计了特异性引物(表1)。以不同浓度苯酚处理样品的cDNA等量混合物为模板,扩增反应条件为94℃预变性3min, 94℃变性30s,60℃退火30s, 72℃延伸1min, 35个循环, 72℃延伸8min。将PCR扩增产物按照SanPrep柱式DNA胶回收试剂盒(上海生工提供)方法进行两轮回收, 得到三个纯化的PCR产物作为标准品, 用分光光度计检测标准品浓度, 并送公司测序(上海生工)。
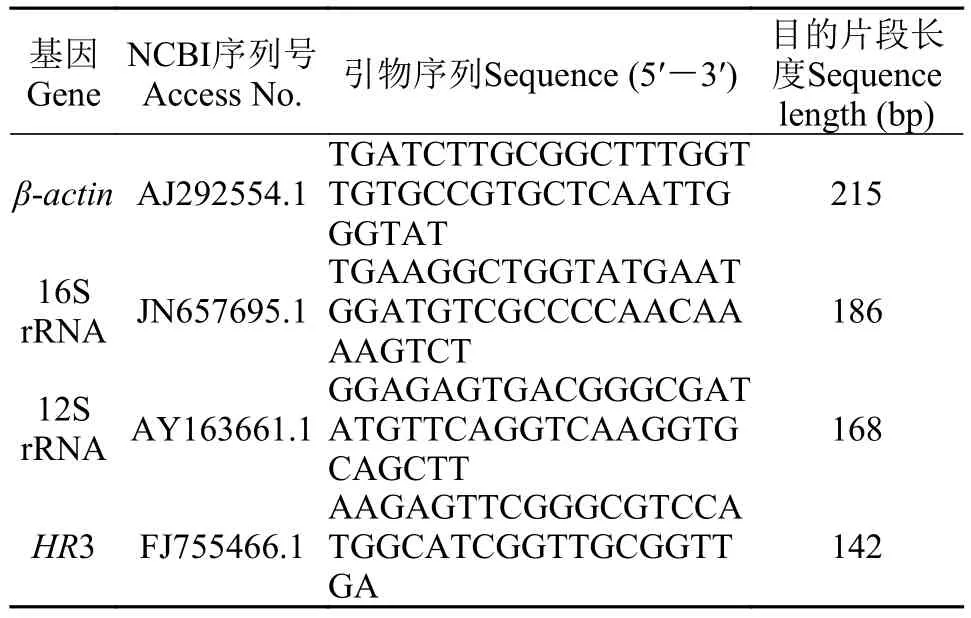
表1 候选内参基因的引物序列Tab. 1 Primer sequences of candidate reference genes
实时定量PCR分析参照EvaGreen 2×qPCR MasterMix试剂盒(镇江ABM公司提供)说明书,将纯化的三个基因标准品分别稀释101—107倍为标准溶液作为模板, 利用ABI 7500实时定量PCR系统对三个内参基因进行实时定量PCR分析。反应体系为15 μL, 反应条件: 50℃ 2min, 94℃ 10min; 40个循环: 95℃ 15s, 60℃ 1min。根据循环Ct值和拷贝数制作标准曲线。
标准曲线的建立: 通过标准溶液的浓度, 计算出拷贝数。
拷贝数/μL=6.02×1023(copies/mol)×模板浓度(g/μL)/平均分子量(g/mol)
其中: 平均分子量(MW g/mol)=碱基数(bp)×660 (D/bp)
以拷贝数的对数为横坐标,Ct值为纵坐标, 制作标准曲线。
以不同浓度苯酚胁迫下的多刺裸腹溞cDNA作为模板, 将三个内参基因和目的基因蜕皮激素接受子3(Hormone receptor 3,HR3)按照以上方法实时定量PCR。HR3基因在多刺裸腹溞中的相对表达量(R)的计算公式如下:R=2-∆∆Ct。
数据处理与分析利用琼脂糖凝胶电泳技术对总RNA质量和内参基因目的片段进行检测, 所得结果采用SPSS 17.0软件进行单因素方差分析(One-Way-ANOVA), 采用Waller-Duncan进行非参数检验, 呈现显著性差异(P<0.05)的整体数据, 继续采用Tukey HSD检验两组数据之间的统计学差异,所得结果用平均值±标准误差表示(Mean±SD)。GeNorm根据M(平均表达稳定值)的大小进行稳定性比较,M值越小稳定性越好[15]。NormFinder根据运算出内参基因S(稳定性)分析内参基因表达稳定性,S值越小表示稳定性越好[16]。BestKeeper用于比较内参基因表达稳定性和基因表达水平的软件,Geo mean (几何平均数)、SD(标准变异系数)越小稳定性越好[17]。
2 结果
2.1 总RNA质量检测和内参基因目的片段的扩增
图1显示, 在不同浓度的苯酚处理后多刺裸腹溞总RNA样品条带清晰, 无降解, 28S rRNA与18S rRNA的亮度比值至少为1:1。定量检测结果显示各样品A260/A280值均在2.0左右, 说明多刺裸腹溞总RNA较完整且纯度高, 可以进行后续实验。用不同浓度苯酚处理后的样品cDNA等量混合, 分别扩增了β-actin、16S rRNA和12S rRNA的目的DNA片段,琼脂糖凝胶电泳分析显示三个内参基因条带与预期大小一致, 且均为单一条带(图2), 而且测序结果也正确。这表明各内参基因的目的条带正确, 引物具有较好的特异性, 可以用于后续实时定量PCR分析。
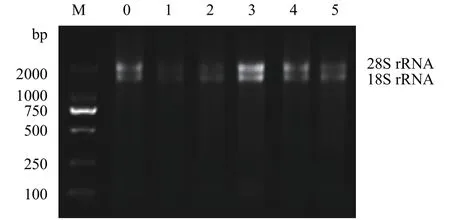
图1 多刺裸腹溞总RNA琼脂糖凝胶电泳图Fig. 1 Agarose gel electrophoresis of total RNA extracted from M. macrocopa
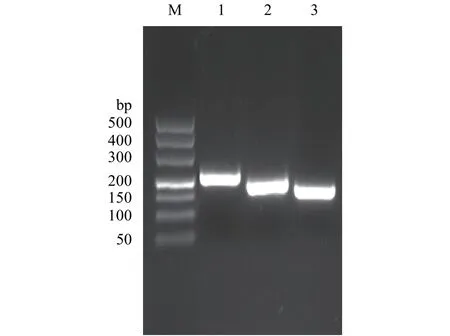
图2 候选内参基因的表达Fig. 2 PCR products of candidate reference genes
2.2 实时定量PCR分析
图3为β-actin、16S rRNA和12S rRNA三个内参基因的标准曲线, 相关系数R2分别为0.996,0.998和0.995, 线性关系好, 可靠性高。引物的扩增效率在97.43%—105.54%(表2), 符合实时定量PCR对扩增效率的要求。各个内参基因的熔解曲线有明显的单一信号峰, 样品间的重复性高, 在阴性对照中未检测到荧光信号。表明实时定量PCR反应中模板与引物结合良好, 具有高的特异性。
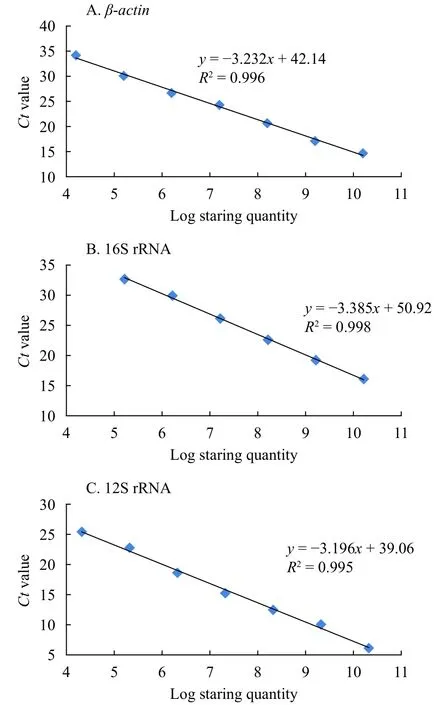
图3 候选内参基因的标准曲线Fig. 3 Standard curve equation of the candidate reference genes

表2 三个内参基因的相关系数及扩增效率Tab. 2 Correlation coefficient and amplification efficiency of three internal reference genes
2.3 内参基因表达的稳定性分析
内参基因在样品中的表达水平(Ct值)图4利用比较Ct值的方法评估各候选内参基因在所有样本中的表达水平。结果显示不同苯酚浓度下的β-actin、16S rRNA和12S rRNA的表达无显著性差异(β-actin,P=0.163; 16S rRNA,P=0.490; 12S rRNA,P=0.165), 表明三个基因均可以作为多刺裸腹溞的内参基因, 并且三个基因的稳定性依次为16S rRNA>12S rRNA>β-actin。
内参基因的GeNorm分析图5利用GeNorm软件比较M值确定稳定的内参基因, 结果显示在苯酚胁迫下, 三个内参基因在多刺裸腹溞中表达稳定性由高到低的顺序为16S rRNA=β-actin>12S rRNA。
内参基因的NormFinder分析利用NormFinder软件对内参基因的稳定性(S值)进行分析(表3), 在苯酚胁迫下, 三个内参基因在多刺裸腹溞中表达稳定性由高到低的顺序为16S rRNA>β-actin>12S rRNA。
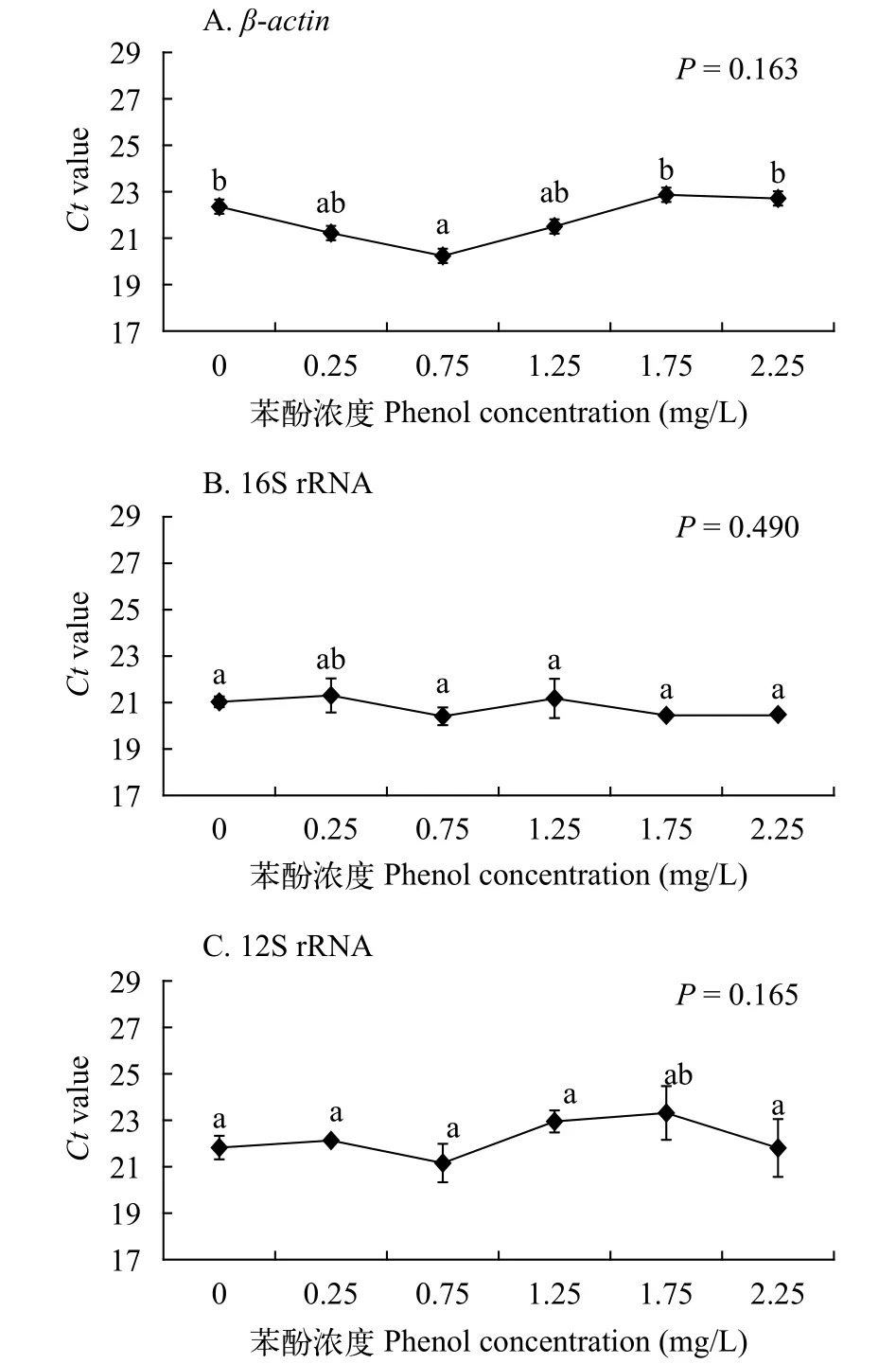
图4 苯酚胁迫下多刺裸腹溞候选内参基因表达水平(Ct值)Fig. 4 Transcript levels of candidate reference genes of M.macrocopa exposed to phenol
内参基因的Bestkeeper分析Bestkeeper软件通过参数的大小反映内参基因稳定性差异。该软件默认的SD值大于1时, 内参基因的稳定性较差。从表4中可以看出, 苯酚胁迫下多刺裸腹溞16S rRNA的SD、Geo Mean、CV、Min和Max在三个内参中值都最小,β-actin的SD次之, 12S rRNA的SD值最大, 所以三个内参基因在多刺裸腹溞中表达稳定性由高到低的顺序为16S rRNA>β-actin>12S rRNA, 故16S rRNA为表达最稳定的内参基因。
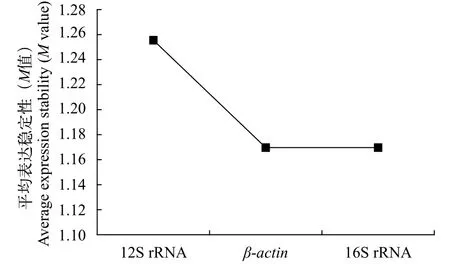
图5 GeNorm软件分析候选内参基因稳定性Fig. 5 Stability of candidate reference genes analyzed by GeNorm

表3 NormFinder软件分析候选内参基因稳定性Tab. 3 Stability of candidate reference genes analyzed by NormFinder

表4 Bestkeeper软件分析候选内参基因稳定性Tab. 4 Stability of candidate reference genes analyzed by Bestkeeper
苯酚处理后多刺裸腹溞HR3的表达本研究选择HR3基因评估选定的内参基因对分析目的基因相对表达量的影响。如图6所示, 随着苯酚浓度的升高, 多刺裸腹溞的HR3 mRNA水平逐渐下降。在苯酚浓度1.75和2.25 mg/L时,HR3 mRNA的表达量显著低于对照组(P<0.05)。
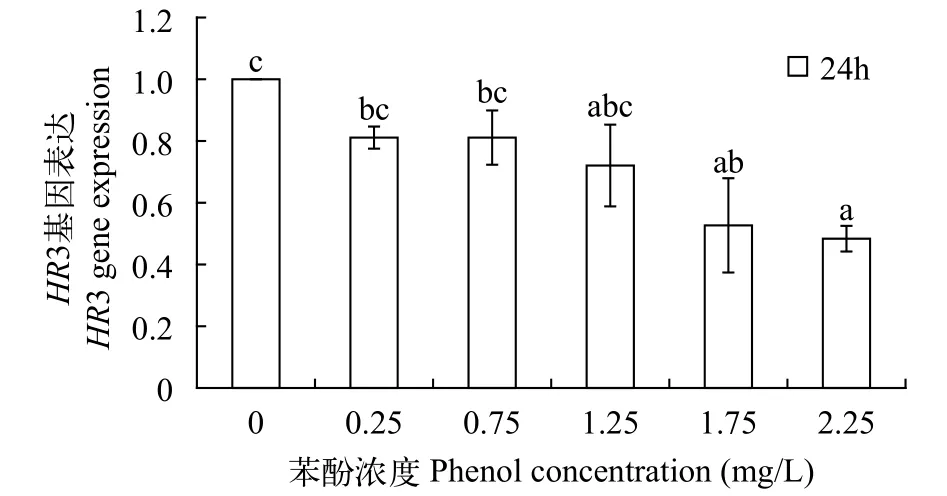
图6 不同浓度的苯酚胁迫下, 多刺裸腹溞HR3相对于16S rRNA的表达变化Fig. 6 The effect of phenol exposure on the HR3 level of M.macrocopa
3 讨论
实时定量PCR技术具有强特异性、高准确性和灵敏度成为转录水平检测目标基因表达的有效方法之一, 因此内参基因的相关研究越来越多[20]。在进行目标基因的相对定量分析中, 稳定的内参基因可以消除因不同样本引起的RNA提取质量和反转录效益上的误差, 因此, 筛选最适内参基因极为重要, 不稳定的内参基因会直接影响结果的可靠性[21,22]。筛选内参基因需要参考前人研究结果, 然后再筛选稳定表达的常用内参基因, 并做进一步的实验验证[23,24]。
本研究选用内参基因的表达水平Ct值、Ge-Norm、NormFinder和Bestkeeper四个常用的分析方法对β-actin、16S rRNA和12S rRNA基因进行稳定性分析。Ct值分析结果显示苯酚胁迫多刺裸腹溞三个内参基因的稳定性顺序为16S rRNA>12S rRNA>β-actin, GeNorm软件分析的稳定性结果为16S rRNA=β-actin>12S rRNA, NormFinder的结果同Bestkeeper软件分析结果一致, 稳定性顺序为16S rRNA>β-actin>12S rRNA。因此确定16S rRNA作为苯酚胁迫下多刺裸腹溞实时定量PCR最适内参基因。在此基础上进一步了探讨了蜕皮级联反应中的关键因子HR3基因来评估16S rRNA作为内参基因对分析目标基因的相对表达量。研究表明, 节肢动物的生长发育过程中受到污染物胁迫后,HR3表达被抑制, 致使机体不能正常完成蜕皮过程,甚至导致幼虫死亡[25]。在本研究中, 随着苯酚浓度的升高,HR3基因表达显著下调(P<0.05), 与Tao[25]的结果一致。验证了16S rRNA可以作为苯酚胁迫下多刺裸腹溞实时定量PCR的内参基因。
目前, 在大型溞(Daphnia magna)、蚤状溞(Daphnia pulex)、隆线溞(Daphnia carinata)、剑水蚤(Tigriopus japonicus)等枝角类中筛选出了在不同实验条件下表达最为稳定的内参基因[26—29]。研究结果表明, 内参基因β-actin在中华拟同形溞(Daphnia similoides sinensis)中表达较稳定[30], 而在隆线溞中的表达稳定性较差[28]; 18S rRNA在蚤状溞中能稳定表达[26], 而在大型溞中稳定性较差[29]。在研究三丁基锡对大型溞的毒性作用时, 选择β-actin和gapdh作为最适内参基因来评估目标基因HR3的表达情况[31]。本研究中16S rRNA为苯酚胁迫下的多刺裸腹溞最适内参基因, 与大型溞、蚤状溞等的结果不一致, 表明内参基因在不同物种中没有绝对的通用性。因此, 在相对定量分析目标基因的表达时,内参基因的筛选是十分必要的[32]。
四种方法对三个内参基因的稳定性分析时,Ct值的筛选结果和其他三种方法有部分结果不一致, 这种差异的原因可能是分析的统计学原理不一致造成的[33]。本研究利用实时定量PCR技术, 采用四种常用内参基因稳定性分析法研究了苯酚胁迫下多刺裸腹溞β-actin、16S rRNA和12S rRNA三个基因的表达稳定性, 确定了16S rRNA作为苯酚胁迫下多刺裸腹溞实时定量PCR的最佳内参基因。为后续多刺裸腹溞相关基因的定量表达分析提供了参考依据。
致谢:
感谢实验室李少钦老师、张左兵老师、刘娜老师和井维鑫老师以及郎朗博士等对实验的帮助和文章的修改。
