免疫检查点抑制剂相关自身免疫性垂体炎的研究进展
2020-03-04李佳忆
李佳忆,幸 兵
(中国医学科学院 北京协和医学院 北京协和医院 神经外科, 北京 100730)
免疫检查点抑制剂(immune checkpoint inhibitor)是一种新型的通过激活机体对肿瘤的免疫应答起作用的抗肿瘤药物。而这类药物所诱导的自身免疫性不良反应也受到越来越多的关注,如免疫检查点抑制剂诱导的垂体炎(immunotherapy induced hypophysitis, IH)。
1 背景
免疫检查点抑制剂是一种通过激活机体的免疫反应达到抗肿瘤的效果的一种抗肿瘤药物。免疫检查点是通过CTLA4-B7和PD-1/PD-L1等通路防止T细胞过度激活来维持机体的免疫耐受的一种负性调节分子。肿瘤细胞在机体内的增殖是通过瘤细胞表面的免疫检查点的激活来逃避机体的免疫监视。免疫检查点抑制剂则通过抑制这些免疫检查点活性,重新启动T细胞对肿瘤的免疫应答,达到抗肿瘤的目的。临床上常用的免疫检查点抑制剂包括:CTLA-4、 PD-1和PD-L1单抗等。这些药物虽然具有良好的抗肿瘤活性,但由于其对免疫反应的再激活,可出现免疫相关不良事件(immune-related adverse events,irAE),IH就是一种典型的irAE。
2 流行病学
根据免疫检查点抑制剂的种类不同,IH的发病率从0.2%到16.4%不等[1-3](表1)。截至2018年11月4日,共有689例IH的报告[4]。CTLA-4单抗和PD-1单抗联合治疗导致的IH发病率最高,而单药治疗导致的IH发病率依次为:CTLA-4抑制剂、PD-1抑制剂和PD-L1抑制剂[1-2]。
IH在男性中多见,平均年龄为63岁(20~88岁)。从最初接触免疫检查点抑制剂到确诊IH的中位时间是76 d(46~116 d),IH最常见于免疫检查点抑制剂3次治疗后[4]。虽然有证据表明其他irAE的风险似乎是剂量依赖性的,但是IH不是剂量依赖性的,标准剂量(3 mg/kg)与累积剂量或高剂量(10 mg/kg)免疫检查点抑制剂导致的IH无显著差异[5-6]。
3 作用机制
CTLA-4单抗和PD-1单抗诱导的IH的机制有所不同。CTLA-4单抗诱导的IH与Ⅱ型和Ⅳ型免疫反应相关,而PD-1抗体诱导的IH与IgG4相关垂体炎的发病机制相似。
CTLA-4抗原在接受CTLA-4阻滞治疗的患者尸检的垂体组织中表达,其表达程度与IH临床症状呈正相关[7]。在IH的小鼠模型以及合并IH的晚期黑色素瘤或前列腺癌患者中也存在抗垂体细胞抗体[8]。因此,对垂体中表达高水平CTLA-4抗原的患者给予CTLA-4阻断剂治疗可能会通过Ⅳ型(T细胞依赖性)和Ⅱ型(IgG依赖性)免疫反应产生抗垂体细胞抗体,导致IH[9]。
因为PD-1抗体如nivolumab、pembrolizumab是基于IgG4的IgG-4κ和IgG4单克隆抗体,所以推测PD-1抗体相关垂体炎的发病机制与IgG4相关的垂体炎相似,但具体机制还需进一步探究[9]。
4 临床特点
IH临床表现多表现为头痛、乏力、恶心、厌食、意识模糊、幻觉、记忆力减退等非特异症状。IH多累及垂体前叶功能,而垂体后叶受累导致的中枢性尿崩症则少见。有研究提出,垂体源性甲状腺功能减退和肾上腺功能减退最为常见,垂体源性性腺功能减退、低泌乳素血症和生长激素缺乏次之,因垂体增大压迫视交叉导致的视物模糊、视野缺损则比较罕见[5-6]。内分泌激素检查可显示为TSH(thyroid stimulating hormone,促甲状腺激素)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、生长激素(growth hormone,GH)和泌乳素(prolactin,PRL)降低[10-11]。根据疾病的严重程度,IH被分为1-4级(1级:无症状或轻度症状;2级:中度症状,日常活动不受限;3级:重度症状,影响日常活动;4级:严重症状,危及生命,不能进行日常活动)[12]。
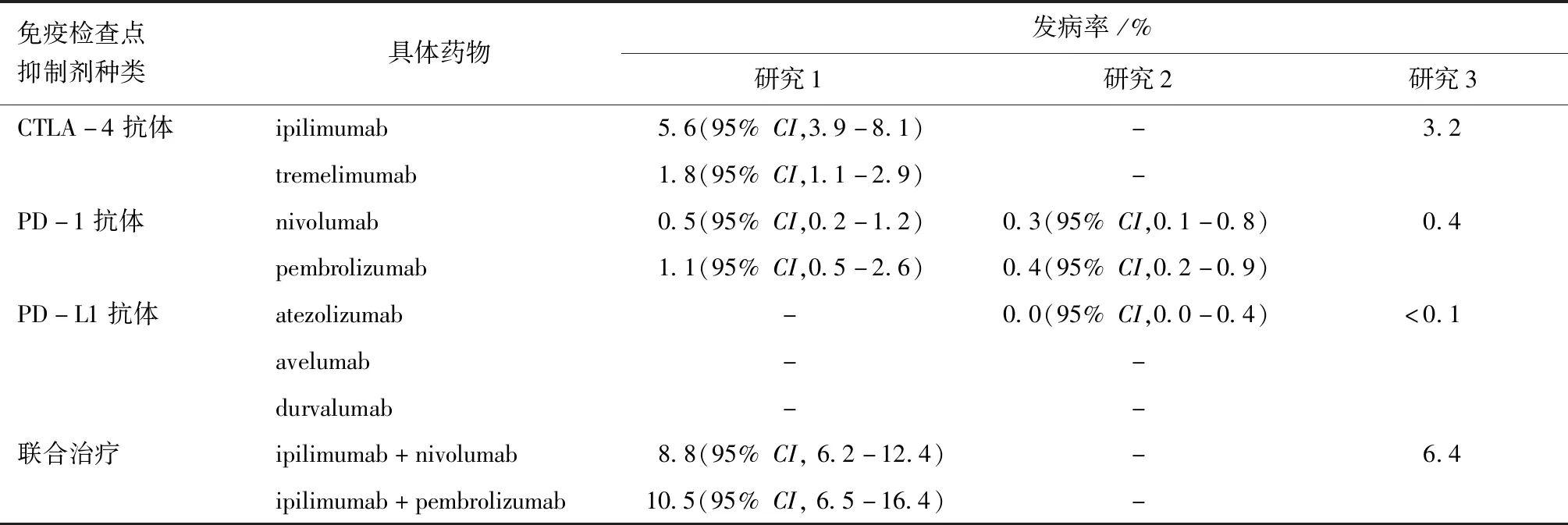
表1 近年研究中不同免疫检查点抑制剂诱导的垂体炎的发病率Table 1 Incidence of immunotherapy induced hypophysitis in recent researches
影像学方面,50%以上的垂体炎患者在垂体增强磁共振成像(magnetic resonance imaging,MRI)上表现为垂体的弥漫性增大[13]。18F-FDG PET(β-2-[18F]-fluoro-2-deoxy-D-glucose positron emission tomo-graphy,β-2-[18氟标记]氟-2-脱氧-D-葡萄糖正电子发射断层扫描)在某些免疫检查点抑制剂相关垂体炎患者中可显示标准摄取值(standard uptake value,SUV)高摄取,并且这一表现可能先于临床症状和激素检查异常,但是垂体PET-CT并不是常规的筛查手段[14-15]。
如果IH不及时治疗,可能会因垂体危象导致患者生命危险[16],所以早期发现和诊断至关重要,提示在免疫检查点抑制剂治疗患者中,应该在治疗前和治疗期间评估垂体前叶相关激素水平,必要时通过垂体增强MRI早期发现。
5 治疗与预后
IH的治疗需要考虑是否停用免疫检查点抑制剂和受累的下丘脑-垂体轴的激素替代治疗两个方面。治疗原则是激素对症治疗,应根据IH导致的垂体前叶激素减低类型和临床症状补充除生长激素外的相应激素。对1-2级IH,建议持续免疫检查点抑制剂的治疗以免影响原发肿瘤的治疗效果[17],对轻度IH患者继续应用ipilimumab治疗是有益的[6, 18]。对于3-4级IH患者因多合并垂体危象建议停止免疫检查点抑制剂的治疗[11]。
大剂量糖皮质激素冲击治疗在IH应用中存在争议。早期研究认为初始治疗策略应该包括用大剂量糖皮质激素(约1 mg/kg泼尼松或等效物)的冲击治疗[19],但是近年研究证明在患有伊普利单抗诱发的垂体炎的黑色素瘤患者中,接受大剂量糖皮质激素治疗会降低患者的生存率[20],并且大剂量糖皮质激素治疗并不能显著改善垂体前叶功能减低[12]。因此,不推荐大剂量的糖皮质激素治疗。
有3项纵向研究表明IH患者需要长期的激素替代治疗。对17名ipilimumab诱发的IH患者的纵向分析发现,经过中位时间11.5个月的随访,大多数患者(13/17)中的垂体功能减退症持续存在,仅4例患者垂体功能恢复正常[6]。25例ipilimumab诱发的IH炎患者,经激素替代治疗后其继发性肾上腺功能不全未能痊愈,仍需长期激素替代[21]。对15例ipilimumab治疗后出现IH的患者经过激素替代治疗后,13例患者仍存在促肾上腺皮质激素缺乏[18]。
6 结论与展望
近年来免疫检查点抑制剂在晚期恶性肿瘤患者中的应用取得了很大进展,其所诱导的自身免疫性垂体炎也逐渐受到关注。IH所致的垂体危象会导致生命危险,因此早期识别IH尤为重要,临床应重视在免疫检查点抑制剂应用前和应用过程中动态监测垂体激素和垂体增强MRI。一旦诊断IH应启动以激素替代治疗为主的对症治疗。目前尚需大样本前瞻性研究,评估合并IH的晚期恶性肿瘤患者的激素变化对生存结局和预后的影响。
