Notch1表达下调抑制病理性瘢痕成纤维细胞增殖并诱导其凋亡
2020-03-04苏江维
苏江维,余 慧,杜 坤,汪 洁,柳 林,蔡 剑
(鄂州市中心医院 皮肤科, 湖北 鄂州 436000)
病理瘢痕成纤维细胞(fibroblast from patholog-ical scars,PSF)是由于皮肤过度愈合造成的,严重时会导致正常组织功能结构异常[1]。成纤维细胞过度增殖是病理性瘢痕形成的主要原因,研究PSF增殖和凋亡机制具有重要意义[2]。Notch1是Notch信号通路的主要受体,在多种组织器官发育中具有重要作用,它可促进心肌细胞、肿瘤细胞和成纤维细胞等多种细胞的增殖[3-5]。Notch1在瘢痕组织中过表达,可能参与瘢痕成纤维细胞过度增殖过程[6-7]。本文探讨下调Notch1对PSF增殖和凋亡的影响及其机制。
1 材料与方法
1.1 材料
增生病理瘢痕组织(鄂州市中心医院),男女各5例,年龄9~32岁,标本采集均经患者及家属同意并签署知情同意书,该研究经过鄂州市中心医院伦理委员会批准(批准文号:EZLY2017-06-24号)。Notch1抗体(MitoSciences公司);阴性对照慢病毒和Notch1 siRNA慢病毒(广州辉骏生物科技有限公司);活化的caspase-3(c-caspase-3)抗体、细胞周期蛋白D1(cyclin D1)抗体(天津赛尔生物技术有限公司);胞质蛋白提取试剂盒(Sigma-Aldrich公司);细胞周期依赖性蛋白激酶4(cyclin-dependent kinase 4,CDK4)抗体、活化的caspase-9(c-caspase-9)抗体(GeneTex公司);线粒体蛋白提取试剂盒(Ambion公司);JC-1线粒体膜电位检测试剂盒(杭州联科生物技术股份有限公司);细胞色素C(cytochrome C)抗体(Proteintech公司);PCR试剂(Thermo Fisher Scientificals公司)。
1.2 方法
1.2.1 PSFs的分离培养和分组处理:PSFs的分离培养方法参照文献[14],将PSFs分为对照组(control)、siRNA-NC和Notch1 siRNA组。siRNA-NC和Notch1 siRNA为稳定转染阴性对照慢病毒和Notch1 siRNA慢病毒的PSFs(感效率高于90%,慢病毒感染复数为20,慢病毒感染时添加Polybrene以增加慢病毒感染效率)。对照组为不感染慢病毒的PSFs。参照1.3和1.4中方法检测干扰效果。Notch1 siRNA序列:正义链 5′-GUCCGGAAACAA CUGCAATT-3′,反义链 5′-UUGCAGUUGUUUCCUGG ACTT-3′;阴性对照序列:正义链 5′-UUCUCCGAAC GUGUCACGUTT-3′,反义链 5′-ACGUGACACGUUC GGAGAATT-3′。
1.2.2 RT-qPCR检测Notch1 mRNA:常规方法提取总RNA,RNA用反转录试剂盒合成cDNA,10 μL反转录体系,包括:0.5 μg RNA,2 μL mix,7.5 μL无RNase水。用Notch1和内参β-actin引物进行SYBR定量PCR,20 μL PCR体系,包含0.5 μL的上下游引物,10 μL的2×ultra SYBR mixture,1 μL的cDNA,8 μL的RNase-free水。引物为:Notch1上游引物:5′-GGCAACAGCGAGGAAGAGGA-3′,下游引物:5′-CAGAAACAGGGGTGTCTCCT-3′。β-actin上游引物5′-CTGGAACGGTGAAGGTGACA-3′,下游引物5′-AAGGGACTTCCTGTAACAATGCA-3′。Real-time PCR程序设置:变性(94 ℃ 15 s);退火(60 ℃ 15 s);延伸(72 ℃ 20 s);荧光检测(76 ℃ 3 s),溶解曲线75 ℃~95 ℃。结果以2-△△Ct表示。
1.2.3 Western blot检测Notch1、cyclin D1、CDK4、c-caspase-3和c-caspase-9表达:加入0.25%的胰蛋白酶消化细胞、PBS漂洗及800×g离心10 min。按照106个细胞中加入500 μL的裂解液将细胞裂解后,12 000×g离心10 min,取各组离心上清液,置于-20 ℃保存。BCA法定量蛋白,SDS-PAGE蛋白上样量为40 μg,电压设置为90 V。转膜:转膜电压设置为90 V,转膜在冰上操作,转膜2 h。封闭:电转后的NC膜放在5%脱脂奶粉孵育液中,室温缓慢摇晃结合60 min。蛋白印迹:添加TBST把NC膜反复洗涤3次,将NC膜置于1∶500稀释的Notch1抗体结合液中,cyclin D1、CDK4、c-caspase-3和c-caspase-9抗体以1∶800、40和1∶400稀释,置于4 ℃冰箱反应过夜,经TBST洗膜,与1∶1 000稀释的二抗在室温条件中反应2 h,TBST洗膜,用ECL显色试剂盒显色,扫描图像,分析目的蛋白和内参β-actin条带的A值。按照公式:目的蛋白水平=目的蛋白条带A值÷β-actinA值计算蛋白表达水平。
1.2.4 MTT法检测细胞增殖:在每个96孔板内加入4×103个细胞,以对照组细胞存活率为100%,分析各组细胞存活率水平。
1.2.5 检测细胞周期及细胞凋亡:用流式细胞仪检测各组细胞周期分布。用annexin V-FITC/PI法检测细胞凋亡,用结合缓冲液500 μL将各组细胞悬浮以后,分别加入5 μL的annexin V-FITC和5 μL的PI,混合以后,用流式细胞仪测定细胞凋亡。
1.2.6 检测线粒体膜电位和cytochrome C蛋白水平:用JC-1法线粒体膜电位试剂盒检测线粒体膜电位,结果用红色荧光和绿色荧光的比值表示。线粒体和胞质蛋白提取试剂盒提取线粒体和胞质中蛋白,用Western blot检测cytochrome C蛋白表达,步骤同1.4,蛋白提取步骤同线粒体和胞质蛋白提取试剂盒。线粒体内蛋白内参为VDAC1。
1.3 统计学分析
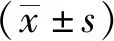
2 结果
2.1 Notch1 siRNA降低PSFs中Notch1表达水平
Notch1 siRNA慢病毒感染后的PSFs中Notch1 mRNA和蛋白水平降低(P<0.05)(图1)。
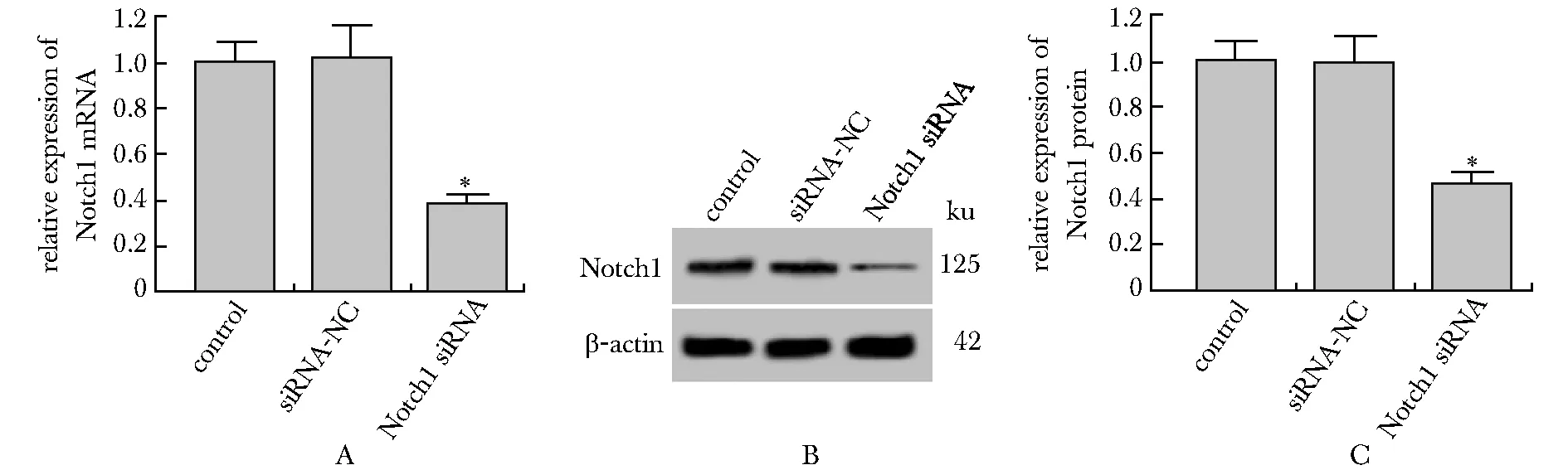
A.Notch1 mRNA level; B.Notch1 protein expression band; C.Notch1 protein level;*P<0.05 compared with control and siRNA-NC图1 Notch1 siRNA慢病毒感染后的PSFs中Notch1 表达差异Fig 1 Differences in Notch1 expression in PSFs infected with Notch1 siRNA
2.2 下调Notch1抑制PSFs增殖
下调Notch1的PSFs存活率降低(P<0.05)(图2)。
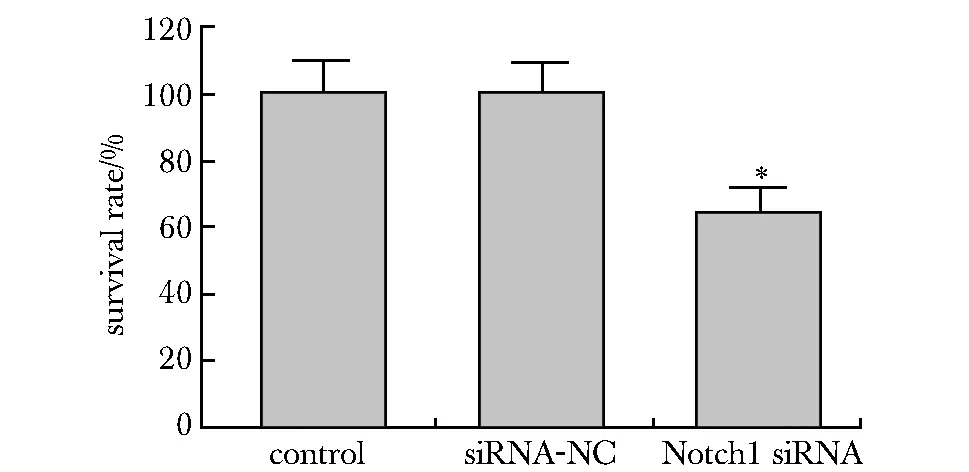
*P<0.05 compared with control and siRNA-NC图2 下调Notch1对PSFs存活率的影响Fig 2 Effect of down-regulation of Notch1 on PSFs
2.3 下调Notch1阻碍PSFs周期进展
下调Notch1的PSF G0/G1期比例明显升高(P<0.05),cyclin D1和CDK4蛋白水平降低(P<0.05)(图3)。
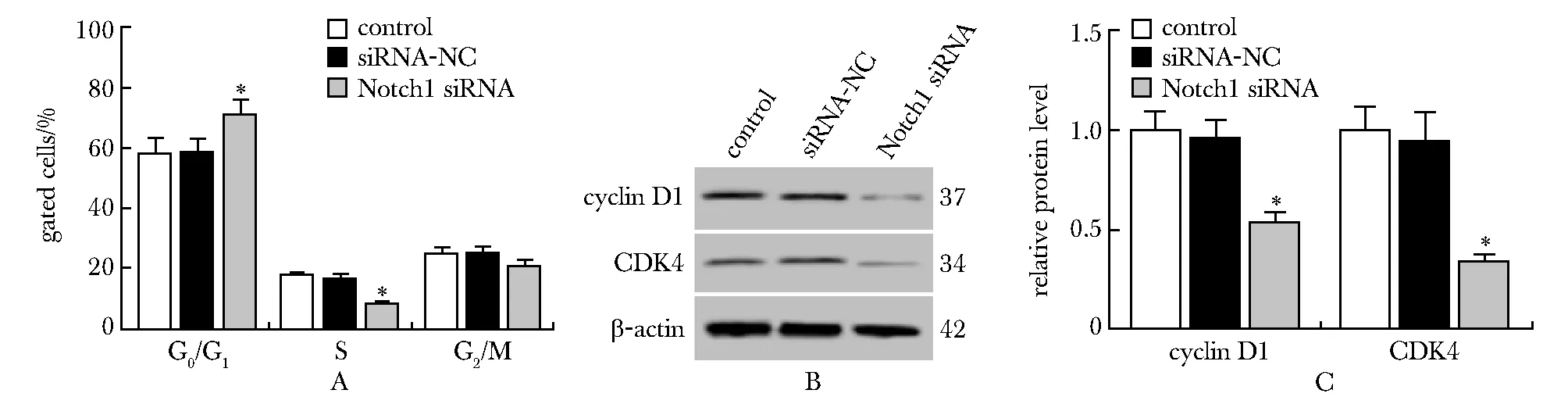
A.PSFs cell cycle changes; B.cyclin D1 and CDK4 protein expression bands; C.cyclin D1 and CDK4 protein levels;*P<0.05 compared with control and siRNA-NC
2.4 下调Notch1诱导PSFs凋亡
下调Notch1的PSFs凋亡率明显升高(P<0.05),表明下调Notch1诱导PSF凋亡(图4,表1)。
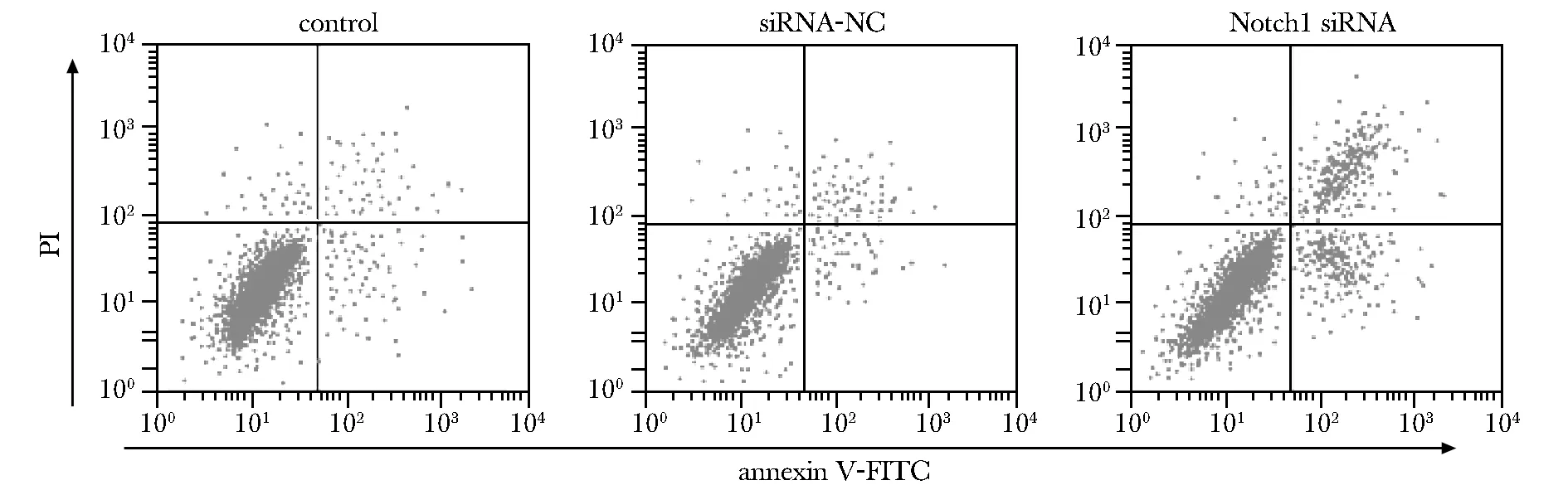
图4 流式细胞计量术检测PSFs凋亡Fig 4 Flow cytometry detecting apoptosis of PSFs

表1 下调Notch1对PSF凋亡的影响Table 1 Effect of down-regulation of Notch1 on PSF
*P<0.05 compared with control and siRNA-NC.
2.5 下调Notch1对PSFs中c-caspase-3、c-caspase-9、caspase-3 和caspase-9 蛋白水平影响
下调Notch1的PSFs中c-caspase-3、c-caspase-9蛋白水平升高(P<0.05)(图5,表2)。

图5 下调Notch1后PSF中c-caspase-3、c-caspase-9、caspase-3 和caspase-9蛋白表达Fig 5 Protein expression of c-caspase-3, c-caspase-9, caspase-3 and caspase-9 in PSF after down- regulation of Notch1
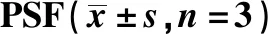
表2 下调Notch1对PSF中c-caspase-3、c-caspase-9、caspase-3 和caspase-9 蛋白水平的影响Table 2 Effect of down-regulation of Notch1 on the levels of c-caspase-3, c-caspase-9, caspase-3 and caspase-9 in
*P<0.05compared with control and siRNA-NC.
2.6 下调Notch1降低线粒体膜电位并减少线粒体释放cytochrome C
下调Notch1的PSF线粒体cytochrome C蛋白减少而胞质cytochrome C蛋白水平升高(P<0.05),细胞线粒体膜电位下降(P<0.05)(图6,表3)。

A.level of cytochrome C protein in mitochondria; B.level of cytochrome C protein in the cytoplasm图6 下调Notch1后PSFs中cytochrome C蛋白水平变化Fig 6 Protein levels of cytochrome C in mitochondria and cytoplasm of PSFs after down-regulation of Notch1
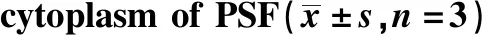
表3 下调Notch1对PSF线粒体和胞质中Cytochrome C蛋白水平影响Table 3 Effect of down-regulation of Notch1 on the levels of cytochrome C protein in mitochondria and
*P<0.05 compared with control and siRNA-NC.
3 讨论
细胞周期依赖性蛋白激酶和细胞周期蛋白是调控细胞周期的两大家族,CDK4是细胞周期依赖性蛋白激酶家族成员,cyclin D1是细胞周期蛋白家族成员。
CDK4和cyclin D1在G1期表达升高,促进细胞从G1期向S期转变[8-10]。下调Notch1可以抑制细胞周期进展,并将细胞周期阻滞在G1期[11-12]。本实验表明下调Notch1后的PSFs G0/G1期比例升高,细胞中CDK4和cyclin D1蛋白水平降低,提示下调Notch1可以通过抑制CDK4和cyclin D1蛋白表达阻碍细胞从G1期向S期转变。
细胞凋亡和增殖是机体维持内环境稳定的前提,细胞凋亡的发生与细胞内caspase级联反应有关,caspase级联反应可以被胞质中的cytochrome C激活[13]。正常情况下,线粒体内外存在一定的渗透压,cytochrome C进入到胞质以后可以激活caspase-9及caspase-3,诱导细胞凋亡[14]。Notch1可提高心肌细胞线粒体膜电位,减少心肌细胞凋亡,是线粒体膜电位的正调控因子[15]。下调Notch1后的PSF中活化的caspase-9和caspase-3明显升高,胞质内的cytochrome C蛋白含量增多,线粒体膜电位明显下调,说明下调Notch1能够通过降低线粒体膜电位促进caspase凋亡反应发生。
综上,下调Notch1可阻碍PSF周期进展,抑制其增殖,降低线粒体膜电位诱导caspase凋亡反应促进PSF凋亡。下调Notch1可能是抑制PSF增生的潜在途径,为病理性瘢痕的治疗提供了新思路。
