耐药结节细胞分化超家族介导鲍曼不动杆菌替加环素耐药机制研究
2020-03-03张心宇杜雪飞邹桂玲姜晓峰
张心宇, 杜雪飞, 邹桂玲, 姜晓峰
(哈尔滨医科大学附属第四医院检验科,黑龙江 哈尔滨 150001)
鲍曼不动杆菌是一种常见的可引起医院感染的条件致病菌,随着抗菌药物的广泛使用,越来越多的多重耐药鲍曼不动杆菌(multidrugresistant Acinetobacter baumannii,MDR-AB)被发现[1-3]。替加环素是目前治疗MDR-AB和碳青霉稀类耐药鲍曼不动杆菌的少数可选药物之一。目前,我国已有替加环素不敏感或耐药鲍曼不动杆菌的相关报道[1-3],但鲍曼不动杆菌对替加环素的耐药机制十分复杂,至今尚未被完全阐明。有研究结果显示,鲍曼不动杆菌对替加环素的耐药机制与耐药结节细胞分化超家族(resistance nodulation division,RND)外排泵高表达有关[4-8],但这一结论并不适用于所有菌株[5-6,9-10],目前关于鲍曼不动杆菌耐药的研究多集中于我国南方地区,东北地区目前尚无相关报道。本研究旨在了解哈尔滨地区RND外排泵介导MDR-AB替加环素敏感性降低的相关机制,探讨鲍曼不动杆菌替加环素耐药与RND外排泵基因表达的关系,进一步明确鲍曼不动杆菌对替加环素耐药的可能机制,以指导临床合理用药。
1 材料和方法
1.1 菌株筛选
收集2015年11月—2018年2月分离自哈尔滨医科大学附属第四医院患者的最小抑菌浓度(minimum inhibitory concentration,MIC)≥4 μg/mL的鲍曼不动杆菌21株。同时随机选取同一时期替加环素MIC≤2 μg/mL的MDRAB 39株。质控菌株为铜绿假单胞菌(ATCC 27853)、大肠埃希菌(ATCC 25922)和鲍曼不动杆菌(ATCC 19606),均购自国家卫生健康委临床检验中心。
1.2 仪器与试剂
VITEK 2 Compact全自动细菌鉴定仪(法国生物梅里埃公司),基质辅助激光解吸电离飞行时间质谱仪(德国布鲁克公司),TC-96/G/H(b)bioer基因扩增仪(杭州博日公司),LightCycler480Ⅱ高通量实时荧光定量PCR仪(瑞士罗氏公司),BIORAD通用基础电泳仪(美国伯乐公司),Ultra PowerTM可见光透射仪(北京百泰克公司)。替加环素药物敏感性试验试剂(温州生物公司),哥伦比亚琼脂、MH琼脂(郑州安图生物工程股份有限公司),Taq PCR Master Mix(2×with Blue Dye)、DNA Marker D(100~2 000 bp)、LB Broth-ready to us、Trizol试剂、RNA-E2 Reagents N DNA-Be-GoneA、M-MuLV第一链cDNA合成试剂盒[生工生物工程(上海)有限公司],Biowest Agarose(西班牙Biowest公司),AceQ qPCR SYBR Green Mastermix(南京Vazyme公司)。根据文献[16-18]确定引物序列,由生工生物工程(上海)有限公司合成,引物序列见表 1。
1.3 体外药物敏感性试验
采用VITEK 2 Compact全自动细菌鉴定仪检测β内酰胺类、氨基糖苷类、碳青霉烯类、四环素类、喹诺酮类、磺胺类抗菌药物及替加环素的MIC。对替加环素MIC≥4 μg/mL的菌株分别采用纸片扩散法及微量肉汤稀释法检测其对替加环素的敏感性。纸片扩散法、微量肉汤稀释法替加环素敏感性折点参考2014年欧洲药物敏感性试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)标准,其他抗菌药物敏感性折点参照2017年美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)M100-S27文件。以微量肉汤稀释法为标准方法,以替加环素非敏感菌株(MIC≥2 μg/mL)为实验组,替加环素敏感菌株(MIC≤1 μg/mL)为对照组。
1.4 RND外排泵基因检测
采用煮沸法提取菌株的模版DNA,检测adeB、adeG、adeJ、adeS、baeR和baeS基因。反应体系:Taq PCR Master Mix(2×with Blue Dye)10 μL,上、下游引物各5 μmol/L,模版DNA浓度为40~100 ng,双蒸水补充体系至20 μL。反应条件: 预变性 95 ℃ 10 min;变性95 ℃ 1 min,退火52 ℃ 30 s,延伸72 ℃ 1 min,35个循环;72 ℃延伸10 min。取5 μL聚合酶链反应(polymerase chain reaction,PCR)产物在2.0%琼脂糖凝胶中电泳30 min,观察结果。

表1 RND外排泵操纵子及内参基因引物序列
1.5 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RTqPCR)检测外排泵表达量
采用Trizol法提取鲍曼不动杆菌(ATCC 19606)标准菌株及对照组、实验组菌株对数生长期细菌总RNA。每10 μL反转录体系利用1 g总RNA合成第1链cDNA,反应条件:42 ℃ 60 min,70 ℃ 10 min。采用RT-qPCR检测外排泵adeB、adeG、adeJ、adeR、baeR和baeS转录水平,采用LightCycler480Ⅱ高通量实时荧光定量PCR仪配套软件分析得到各个样本管家基因gyrB和Ct值,以管家基因gyrB为内参,MDR-AB标准菌株鲍曼不动杆菌(ATCC 19606)为参考菌株,采用2-ΔΔCT法计算各外排泵基因的相对表达量。
1.6 双组分调节系统基因插入序列检测
对于外排泵基因adeB表达水平升高的菌株,采用PCR对其adeS基因进行扩增,产物送生工生物工程(上海)有限公司进行测序,通过ISFinder数据库比对查找插入序列。
1.7 统计学方法
数据采用GraphPad Prism 5软件进行分析。
2 结果
2.1 药物敏感性试验结果
采用VITEK 2 Compact全自动细菌鉴定仪共鉴定出替加环素非敏感鲍曼不动杆菌21株,采用纸片扩散法抗菌药物敏感性试验筛选出替加环素抑菌圈直径≤12 mm的菌株10株,采用微量肉汤稀释法筛选出替加环素MIC≥2 μg/mL的菌株12株,并且这些菌株对亚胺培南亦耐药。VITEK 2 Compact全自动细菌鉴定仪分析的MIC值与微量肉汤稀释法相比,高2~4个稀释度。实验组鲍曼不动杆菌药物敏感性试验结果见表2。
2.2 RND外排泵基因检测结果
实验组、对照组所有菌株均检出RND相关外排泵基因adeB、adeG、adeJ、adeS、baeR和baeS,检出率为100%。
2.3 RND外排泵转录水平表达量检测结果
实验组adeB表达水平在不同菌株之间存在差异,替加环素非敏感菌株TR5、TR13和TR20 adeB的表达水平分别约是替加环素参考菌株鲍曼不动杆菌(ATCC 19606)的3.3、3.5和2.7倍。adeG相对表达水平在菌株TR7中稍有升高,约是参考菌株鲍曼不动杆菌(ATCC 19606)的2.8倍。adeJ、adeR、baeR以及baeS表达水平在菌株中未见明显升高。见图1。
12株替加环素非敏感菌株adeB、adeG、adeJ、adeR、baeR及baeS的相对表达量分别为1.43±0.32、1.107±0.20、0.86±0.10、0.84±0.14、0.13±0.03和1.12±0.10;48株替加环素敏感菌株adeB、adeG、adeJ、adeR、baeR及baeS的相对表达量分别为1.12±0.12、0.48±0.06、0.66±0.06、 0.66±0.09、0.10±0.01和1.53±1.11。见图2。
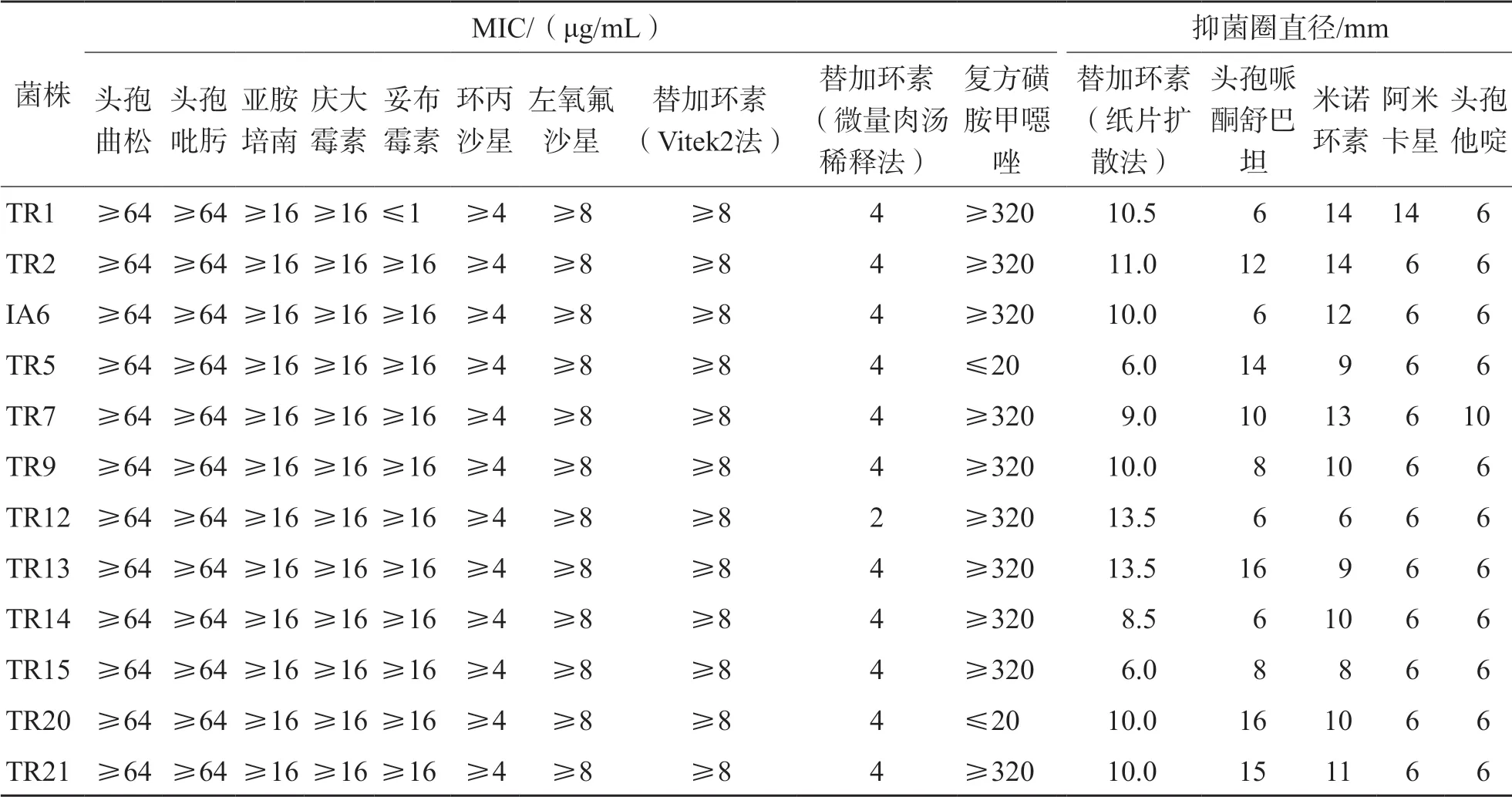
表2 实验组鲍曼不动杆菌药物敏感性试验结果
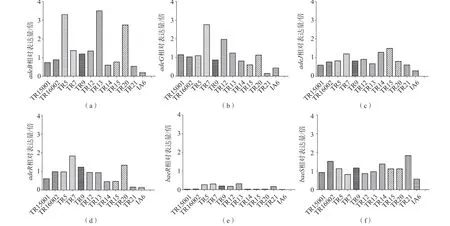
图1 实验组RND外排泵相对表达量
2.4 adeS突变检测
外排泵表达水平增高与上游双组分调节系统adeS序列插入有关,在外排泵高表达替加环素非敏感菌株TR5及TR13的adeS基因中发现了ISAbaⅠ插入序列。在菌株TR5中发现的ISAbaⅠ插入序列。部分测序结果见图3。

图2 实验组及对照组RND外排泵相对表达量

图3 TR5菌株adeS基因插入序列ISAbal部分测序结果
3 讨论
替加环素是目前治疗MDR-AB和碳青霉稀类抗菌药物耐药鲍曼不动杆菌的少数可选药物之一,抗菌谱广、抗菌活性强、不良反应小,且应用不受患者年龄、性别、病情等的限制。自2005年美国食品药品监督管理局(U. S. Food and Drug Administration,FDA)批准替加环素应用于临床治疗后,仅1年就分离到了替加环素敏感性降低的鲍曼不动杆菌。目前,我国也检出了替加环素不敏感或耐药的鲍曼不动杆菌,然而替加环素的耐药机制仍不明确。
目前,临床实验室多以VITEK 2 Compact全自动细菌鉴定仪鉴定鲍曼不动杆菌对替加环素的敏感性,但在实际工作中发现VITEK 2 Compact全自动细胞鉴定仪的鉴定结果较微量肉汤稀释法MIC值高2~4个稀释度,“假中介”及“假耐药率”较高,因此VITEK 2 Compact全自动细胞鉴定仪能否作为鲍曼不动杆菌替加环素敏感性检测的方法仍有待商榷。临床上检测替加环素抑菌活性的方法很多,培养基配制时间、锰的含量、易氧化等因素往往会使结果的准确性受到影响[14]。《替加环素体外药敏试验操作规程专家共识》推荐以肉汤稀释法作为金标准,建议当VITEK 2 Compact全自动细菌鉴定仪确定鲍曼不动杆菌替加环素中介或耐药时,应用微量肉汤稀释法进行确证[15]。
作为RND的3种外排泵,AdeABC,AdeFGH和AdeIJK与该物种的替加环素耐药性有关,由膜融合蛋白(membrane fusion protein,MFP)、膜转运蛋白和外膜因子(outer membrane protein,OMF)3种蛋白质共同发挥作用。双组分调节系统AdeRS与BaeRS位于AdeABC上游,可感应外界环境并在保守组氨酸残基发生自磷酸化,通过转移磷酸基团并调控DNA 的转录,调节下游基因表达[16]。本研究结果显示,adeB、adeG、adeJ、adeS和baeRS基因在所有的实验组和对照组菌株中都被检测到,验证了外排泵基因很可能是鲍曼不动杆菌的固有基因这一观点,即当菌株暴露在外排泵底物环境中时,外排泵基因表达水平会上调,从而使菌株耐药[17]。
通过RT-qPCR验证发现实验组菌株TR5、TR13和TR20的adeB表达水平上调。同时在TR5和TR13的adeS中发现ISAbaⅠ序列插入,已知机制表明ISAbaⅠ插入adeS会产生1个N末端截短的adeS和由ISAba1 Pout启动子产生的mRNA转录本。这种截短的adeS能够激活adeR,并增强adeABC基因表达[18]。SUN等[18]和HAMMERSTROM等[19]的研究结果与本研究结果一致。除AdeRS以外,双组分调节系统BaeRS可正向调控adeB的表达[12,20],TR20中仅adeB表达量增加,该结果的出现不排除RND外排泵仅作为鲍曼不动杆菌替加环素敏感性降低的辅助因素。目前认为低剂量抗菌药物治疗会使AdeFGH外排泵过度表达,增加诱导生物膜形成的自诱导分子的合成和转运[21-23];另外,某些药物,如去甲肾上腺素也会导致AdeFGH的过表达,诱导生物膜形成[8]。由于本研究未进行多位点序列分子分型研究,所以无法说明去甲肾上腺素具体如何诱导adeG表达水平升高以及是否存在其他非抗菌药物类药物影响鲍曼不动杆菌的抗菌活性,这也是我们下一步研究的重点。
值得注意的是,虽然本研究中外排泵基因的检出率为100%,但仅有少数菌株的外排泵基因水平表达上调,且表达水平上调的幅度并不高。这一结果表明,RND外排泵基因高表达很可能不是鲍曼不动杆菌替加环素敏感性下降的唯一因素。有研究发现,外排泵在细菌耐药过程中主要介导低水平耐药,只作为一种耐药背景参与替加环素耐药的发生[17]。因此,我们推测RND外排泵可能仅辅助其他耐药机制促进替加环素耐药发生,而这一假设还有待进一步研究确证。
