NKX2-5在乳腺癌患者他莫昔芬耐药中的作用及调控机制
2020-03-03杨飞翔
赵 铮, 李 毅, 杨飞翔
(湖北医药学院附属东风医院检验科,湖北 十堰 442000)
乳腺癌是女性最常见的恶性肿瘤之一,每年发病率占女性恶性肿瘤的29%[1]。内分泌治疗是雌激素受体(estrogen receptor,ER)阳性乳腺癌最有效的治疗手段。有研究结果显示,内分泌治疗可降低ER阳性乳腺癌患者的复发和死亡风险,提高生存率[2]。内分泌治疗药物的耐药会使乳腺癌治疗难度增加。有调查结果显示,约有25%的ER阳性乳腺癌患者对他莫昔芬(tamoxifen,TAM)初始治疗无效,即使在首次TAM治疗有效的患者中,也有40%最终可能会发展成获得性耐药[3]。因此,探讨TAM的耐药机制对乳腺癌临床治疗具有重要的指导意义。转录因子NKX2-5是NK同源盒-2基因的成员,主要表达于心脏组织,维持心脏的正常发育和功能[4]。近来年,有学者发现部分恶性肿瘤中NKX2-5表达异常,与肿瘤的发生、发展关系密切,如前列腺癌等实体瘤中NKX2-5表达下调,并与患者不良结局呈负相关[5]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路在乳腺癌内分泌治疗药物耐药机制中扮演着重要角色。有研究结果显示,阻断MAPK信号通路可以抑制乳腺癌细胞的增殖和迁移,而激活该信号通路会增强ER转录效率并导致TAM耐药[6]。本研究拟分析NKX2-5是否能通过阻断MAPK信号通路逆转TAM耐药。
1 材料和方法
1.1 研究对象
选取2012年7月—2016年7月在湖北医药学院附属东风医院采用规律内分泌药物(TAM 20 mg/d)治疗的乳腺癌患者50例,年龄23~73岁。收集所有患者TAM治疗前切除的乳腺癌组织及对应的癌旁组织样本。纳入标准:病理检查证实为乳腺癌,入院前未接受过放疗、化疗、激素治疗或其他抗癌治疗。排除合并其他恶性肿瘤者。50例患者中有18例(36.0%)发生TAM耐药,再次收集TAM耐药患者的组织样本。组织样本取出后立即置于液氮中保存。本研究经湖北医药学院附属东风医院医学伦理委员会批准,所有患者治疗前均签署知情同意书。
1.2 数据库分析
从高通量基因表达数据库(Gene Expression Omnibus,GEO)下载乳腺癌患者基因表达数据(GSE42568),通过整理数据库中的相关数据,分析患者总生存率、无复发生存率与肿瘤组织基因表达水平的关系。
1.3 细胞株来源
人乳腺癌细胞株MCF-7、T47D、BCAP37、SKBR3及正常乳腺细胞株MCF10A均购自美国菌种保藏中心(American Type Culture Collection,ATCC)。所有细胞均接种于含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI-1640培养基(美国Thermo Fisher Scientific公司)中,37 ℃、5%CO2培养箱中培养。按LI等[7]报道的方法构建TAM耐药MCF-7细胞株(MCF-7/TAM):将TAM溶于甲醇中,配置成终浓度为50 mg/mL的溶液,MCF-7细胞用含1 μmol/L TAM的RPMI-1640培养基培养,持续培养6个月。后续为了维持细胞对TAM的耐药表型,将细胞培养于含0.5 μmol /L TAM的培养基中。
1.4 主要试剂
TAM(美国Sigma公司),NKX2-5抗体(武汉博士德生物工程公司),生物素标记的山羊抗小鼠IgM抗体(二抗)(北京博奥森生物技术有限公司),兔抗人细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)、磷酸化细胞外调节蛋白激酶(phosphorylatedextracellular regulated protein kinase,p-ERK)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)、磷酸化p38丝裂原活化蛋白激酶(phosphorylated-p38 mitogenactivated protein kinase,p-p38MAPK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、磷酸化c-Jun氨基末商激酶(phosphorylatedc-Jun N-terminal kinase,p-JNK)抗体(北京中杉金桥生物技术有限公司),鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体(美国Santa Cruz公司),HiFiScript cDNA第一链合成试剂盒(北京康为世纪生物科技有限公司),Trizol试剂盒(美国Invitrogen公司)。
1.5 癌组织和癌旁组织样本中NKX2-5的表达
所有组织样本均用中性甲醛固定,石蜡包埋后制成厚度为3 μm的切片,二甲苯脱蜡,梯度乙醇水化。加入0.1%过氧化氢,室温孵育15 min,消除内源性过氧化物酶,微波修复抗原,5%羊血清封闭10 min。滴加NKX2-5抗体,4 ℃孵育过夜,再滴加生物素标记的二抗,室温孵育1 h。二氨基联苯胺(diaminobenzidine,DAB)显色,中性树胶封固,CX41型光学显微镜(日本Olympus光学工业株式会社)下观察。根据阳性细胞比例和染色强度,采用半定量评分法对免疫组化染色结果进行评价。染色强度:无染色记0分,轻度染色记1分,中度染色记2分,重度染色记3分。阳性细胞百分比:无阳性细胞为0分,阳性细胞百分比<10%记1分,阳性细胞百分比为10%~50%记2分,阳性细胞百分比>50%记3分。最终评分为染色强度得分×阳性细胞百分比得分。
1.6 NKX2-5过表达和抑制
NKX2-5过表达质粒(Ad-NKX2-5)、空载质粒(Ad-NC)及NKX2-5小干扰RNA质粒(NKX2-5-siRNA)、空白对照(NC-siRNA)由上海吉玛生物制药有限公司合成。NKX2-5-siRNA序列为:5'-GCAGCUUCACCUAUCCGAU-3',NC-siRNA序列为3'-CGUCGAAGUGGAUAGGCUA-5'。采用瞬时转染技术将Ad-NKX2-5、Ad-NC转染MCF-7/TAM细胞(Ad-NKX2-5组、Ad-NC组),将NKX2-5-siRNA、NC-siRNA转染MCF-7细胞(NKX2-5-siRNA组、NC-siRNA组)。采用Lipofectamine 2000脂质体瞬时转染过表达质粒和低表达质粒,具体步骤:将细胞接种于6孔板,加入200 μL Lipofectamine 2000和4 μg质粒,室温避光孵育20 min,37 ℃、5%CO2条件下培养6 h后更换培养基,继续培养48 h后检测转染后的蛋白表达,验证转染效率。
1.7 细胞增殖活力的检测
取处于对数生长期的细胞,用不含胎牛血清的培养液重悬,细胞计数为1.0×104个/mL。将细胞接种于96孔板(100 μL/孔),分别用5、20、50、100 μmol/L TAM处理,连续培养72 h,采用CCK-8试剂盒检测培养24、48、72 h时各孔的吸光度(A)值,计算并绘制细胞在不同浓度TAM下的增殖抑制曲线,各组实验平行重复3次,取平均值。增殖抑制率=(对照组A值-实验组A值)/(对照组A值-空白组A值)×100%。
1.8 乳腺癌细胞中各种蛋白的表达
收集Ad-NKX2-5组、Ad-NC组、NKX2-5-siRNA组和NC-siRNA组细胞,加入1 mL RIPA裂解液,冰浴上裂解20 min,4 ℃ 16 110×g离心15 min,吸取上清液,采用二喹啉甲酸(bicinchoninic acid,BCA)法蛋白测定试剂盒检测蛋白纯度。取50 μg总蛋白,用10%十二磺基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离。分别加入NKX2-5抗体(1∶1 000)、ERK抗体(1∶1 000)、p-ERK抗体(1∶1 000)、P38抗体(1∶1 000)、p-P38抗体(1∶1 000)、JNK抗体(1∶1 000)、p-JNK抗体(1∶1 000)和GAPDH抗体(1∶2 000),4 ℃孵育过夜。次日用磷酸盐缓冲液(phosphate-buffered saline,PBS)冲洗3遍,滴加二抗稀释液(1∶4 000),37 ℃孵育2 h。加入增强化学发光(enhanced chemiluminescence,ECL)液显色,采用LAS4000mini超灵敏化学发光成像仪拍照。以GAPDH为内参,计算目的蛋白的相对表达量。
1.9 人乳腺癌细胞株MCF-7、T47D、BCAP37、SKBR3、MCF10A中NKX2-5 mRNA的表达及正常乳腺细胞株
采用逆转录-聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)检测MCF-7、T47D、BCAP37、SKBR3、MCF10A细胞中NKX2-5 mRNA的表达。采用Trizol试剂盒提取细胞总RNA,并用HiFiScript cDNA第一链合成试剂盒将0.5 μg总RNA逆转录为互补DNA(complementary DNA,cDNA)。取1 μL cDNA产物进行聚合酶链反应(ploymerase chain reaction,PCR)扩增。NKX2-5:5'-CGGACCACCTCGCCTTACA-3'(正义链),5'-CTGGGCTCCTTCCCTCATCG-3'(反义链);GAPDH:5'-TGCACCACCAACTGCTTAG-3'(正义链),5'-AGTAGAGGCAGGGATGATGTTC-3'(反义链)。反应条件:95 ℃45 s,55 ℃ 45 s,72 ℃ 90 s,30个循环。以GAPDH为内参,按2-ΔΔCt法计算目的基因相对表达量。
1.10 统计学方法
采用GraphPad Prism 7.0软件进行统计分析。呈正态分布的数据以±s表示,2个组之间比较采用t检验,多组间比较采用单因素方差分析,两两之间比较采用LSD-t检验。绘制Kaplan-Meier生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 组织样本中NKX2-5的表达
免疫组化染色结果显示,NKX2-5主要表达于细胞质,阳性细胞颜色为棕黄色或褐色。癌旁组织NKX2-5的阳性表达率为74.0%(37/50),癌组织为42.0%(21/50),癌旁组织NKX2-5表达明显高于癌组织(P<0.05)。TAM敏感组织中NKX2-5表达明显高于TAM耐药组织(P<0.05)。见图1。

图1 不同组织中NKX2-5的表达(×200)
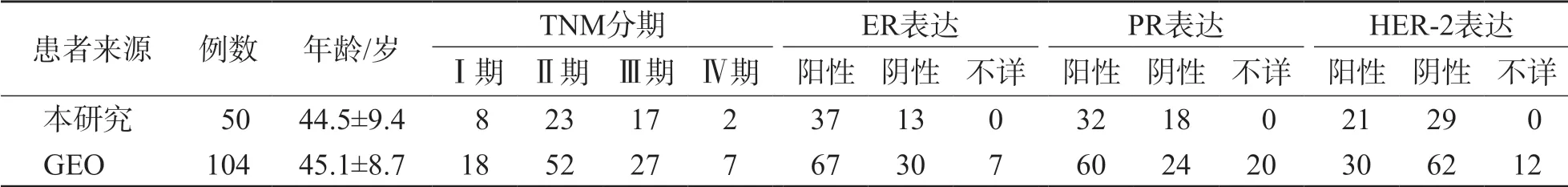
表1 乳腺癌患者的一般资料
本研究50例乳腺癌患者和GEO数据库104例乳腺癌患者的临床资料见表1。
癌旁组织NKX2-5的评分明显高于乳腺癌组织(P<0.000 1)。TAM敏感组织NKX2-5的评分明显高于TAM耐药组织(P<0.000 1)。见图2。
NKX2-5高表达率为78.8%(82/104),NKX2-5低表达率为21.2%(22/104)。Kaplan-Meier生存曲线结果显示,NKX2-5低表达组总生存率和无复发生存率明显低于NKX2-5高表达组(P<0.000 1)。在接受TAM治疗的乳腺癌患者中,NKX2-5低表达组总生存率明显低于NKX2-5高表达组(P<0.000 1)。见图3。

图2 不同组织免疫组化染色评分比较

图3 NKX2-5高表达和低表达乳腺癌患者的Kaplan-Meier生存曲线
2.2 人乳腺癌细胞株MCF-7、BCAP37、T47D、SKBR3及正常乳腺细胞株MCF10A中NKX2-5的表达
与MCF10A细胞相比,MCF-7细胞NKX2-5 mRNA和蛋白表达明显升高,T47D、BCAP37、SKBR3细胞明显降低(P<0.05),见图4。采用不同浓度TAM处理MCF-7、T47D、BCAP37及SKBR3细胞,结果显示TAM对MCF-7细胞的半数抑制浓度(half inhibit concentration,IC50)低于T47D、BCAP37及SKBR3细胞,见表2。
由于MCF-7细胞NKX2-5的表达量相对较高,因此后续实验均选择MCF-7细胞作为研究对象。与MCF-7细胞比较,MCF-7/TAM细胞NKX2-5蛋白表达降低(P<0.05),见图5。

图4 MCF-7、T47D、BCAP37、SKBR3及MCF10A细胞NKX2-5蛋白及NKX2-5 mRNA的表达

表2 不同浓度TAM对MCF-7、T47D、BCAP37、SKBR3细胞的增殖抑制率 %,x±s

图5 MCF-7和MCF-7/TAM细胞NKX2-5蛋白表达的比较
TAM对MCF-7细胞的IC50低于MCF-7/TAM细胞,见表2。MCF-7和MCF-7/TAM细胞的NKX2-5蛋白表达均呈浓度依赖性降低,见图6。
2.3 NKX2-5表达对TAM敏感性的影响
Ad-NKX2-5组NKX2-5蛋白表达明显高于Ad-NC组(P<0.05),NKX2-5-siRNA组蛋白NKX2-5蛋白表达明显低于NC-siRNA组(P<0.05),见图7。提示质粒转染成功。

图6 不同浓度TAM处理后MCF-7和MCF-7/TAM细胞NKX2-5蛋白表达的比较
采用50、100 μmol/L TAM处理后,Ad-NKX2-5组增殖抑制率明显高于Ad-NC组(P<0.05),NKX2-5-siRNA组增殖抑制率明显低于NC-siRNA组(P<0.05)。见表3。
2.4 NKX2-5对MAPK信号通路的影响
MCF-7/TAM细胞p-P38、p-JNK、p-ERK蛋白表达明显高于MCF-7细胞(P<0.05),见图8。
Ad-NKX2-5组p-P38、p-JNK、p-ERK蛋白表达明显低于Ad-NC组(P<0.05),NKX2-5-siRNA组p-P38、p-JNK、p-ERK蛋白表达明显高于NC-siRNA组(P<0.05)。见图9。

图7 Ad-NKX2-5组、Ad-NC组、NKX2-5-siRNA组和NC-siRNA组NKX2-5蛋白的表达
表3 不同浓度TAM对Ad-NKX2-5组、Ad-NC组和NKX2-5-siRNA组、NC-siRNA组的增殖抑制率%,

表3 不同浓度TAM对Ad-NKX2-5组、Ad-NC组和NKX2-5-siRNA组、NC-siRNA组的增殖抑制率%,
注:与Ad-NC组比较,*P<0.05;与NC-siRNA组比较,#P<0.05
images/BZ_59_197_1072_1117_1204.pngAd-NKX2-5组 8.7±0.521.4±5.7 56.9±10.1*67.9±7.8*Ad-NC组 4.3±0.419.7±4.5 28.9±7.3 49.7±7.1 NKX2-5-siRNA组19.8±5.438.9±6.2*#40.9±5.4*# 40.5±5.6*#NC-siRNA组 21.2±6.559.4±8.4 60.1±8.9 67.7±7.6

图8 MCF-7细胞和MCF-7/TAM细胞MAPK信号通路相关蛋白的表达

图9 Ad-NKX2-5组、Ad-NC组、NKX2-5-siRNA组和NC-siRNA组MAPK信号通路相关蛋白的表达
3 讨论
内分泌治疗药物耐药是ER阳性乳腺癌患者临床治疗的难点之一,耐药的产生会影响内分泌治疗的效果和患者的远期生存率[8]。本研究分析了从GEO数据库中获取的相关数据,结果显示NKX2-5低表达组总生存率和无复发生存率明显低于NKX2-5高表达组,在接受内分泌药物治疗的乳腺癌患者中,NKX2-5低表达与总生存率有关,提示NKX2-5可能是乳腺癌的一种抑癌基因,或可作为乳腺癌预后评估的指标之一。同时,本研究临床样本的检测结果显示,乳腺癌组织NKX2-5表达降低,TAM耐药患者的癌组织中NKX2-5表达也同样降低,提示NKX2-5可能与乳腺癌TAM耐药有关。
既往研究结果显示,NKX2-5与心肌细胞的发育有关[9-10]。NKX2-5可激活α-肌动蛋白等心肌转录因子,在胚胎时期心肌组织定向分化过程中起关键作用[11]。近期有学者发现前列腺癌组织NKX2-5表达下调,NKX2-5可能通过表观遗传DNA甲基化改变抑制前列腺癌的早期病变[12]。还有研究结果显示,肺癌血清NKX2-5水平明显升高,NKX2-5高表达与患者的不良结局有关[13]。这说明NKX2-5表达可能存在组织特异性,在不同肿瘤中发挥的作用也不一样。目前,尚未见NKX2-5与恶性肿瘤化疗耐药的相关报道。杨莉[14]的研究结果显示,NKX2-5的同型家族成员NKX2-1与肺癌化疗药物的耐药有关,NKX2-1高表达的肺癌细胞对吉西他滨的敏感性高于顺铂及多西他赛。本研究结果显示,TAM对MCF-7细胞的IC50明显低于MCF-7/TAM细胞,且MCF-7/TAM细胞NKX2-5蛋白表达明显低于MCF-7细胞。提示NKX2-5可能参与了乳腺癌细胞TAM耐药的发生。
本研究采用瞬时转染技术上调MCF-7/TAM细胞和下调MCF-7细胞中NKX2-5的表达,结果显示,上调MCF-7/TAM细胞NKX2-5表达可以明显增强TAM对MCF-7细胞的抑制作用,而下调MCF-7细胞NKX2-5表达则可降低MCF-7细胞对TAM的敏感性。说明NKX2-5可以逆转乳腺癌细胞对TAM的耐药性。ALCÁNTARA-ORTIGOZA等[15]分析了癌症基因组数据库,发现肺癌、乳腺癌等组织中缺乏NKX2-5;敲除NKX2-5基因后可激活SOX2和KRAS 2种癌基因,诱导组织出现恶性病变,并介导癌细胞逃避化疗和药物治疗。LI等[16]的研究结果显示,TAM可以上调NKX2-1表达,在TAM耐药的细胞株中上调NKX2-1可以增加细胞对TAM的敏感性。本研究初步证实NKX2-5是一种抑癌因子,并可增加TAM耐药乳腺癌细胞对TAM的敏感性。
内分泌治疗药物耐药的产生是一个复杂的过程,有多种信号通路和调控机制参与其中。ERK、JNK和p38MAPK信号通路是生物体内存在的一条经典信号通路[17]。MAPK通路可将细胞外信号转导至细胞核内,并引起细胞增殖、分化、凋亡等多种生物学反应[18]。XU等[19]的研究结果显示,阻断MAPK信号通路可以抑制乳腺癌细胞增殖,激活此信号通路则可降低乳腺癌细胞对TAM的敏感性。既往研究证实TAM耐药乳腺癌细胞中活化型ERK明显增加,p-P38MAPK表达增加与MCF-7细胞TAM耐药有关[20-21]。本研究结果显示,与MCF-7细胞比较,MCF-7/TAM细胞p38MAPK、JNK、ERK的活化型蛋白(p-p38MAPK、p-JNK、p-ERK)表达明显增加,提示TAM耐药细胞中MAPK信号通路处于激活状态,TAM耐药可能与MAPK信号通路活化有关。上调MCF-7/TAM细胞NKX2-5表达可以抑制MAPK通路,而下调MCF-7细胞NKX2-5表达则可激活MAPK通路,提示NKX2-5可能是通过抑制MAPK信号通路逆转MCF-7细胞对TAM的耐药。
综上所述,TAM耐药乳腺癌细胞中NKX2-5表达下调。上调NKX2-5表达或许能通过抑制MAPK信号通路逆转MCF-7细胞对TAM的耐药。NKX2-5有望成为TAM耐药乳腺癌的潜在治疗靶点。
