黄瓜单性结实性状遗传与QTL定位
2020-02-27牛志红宋晓飞李晓丽郭晓雨何书强贺栾劲芝冯志红孙成振闫立英
牛志红,宋晓飞,李晓丽,郭晓雨,何书强,贺栾劲芝,冯志红,孙成振,闫立英
黄瓜单性结实性状遗传与QTL定位
牛志红,宋晓飞,李晓丽,郭晓雨,何书强,贺栾劲芝,冯志红,孙成振,闫立英
(河北科技师范学院,河北秦皇岛 066004)
【】单性结实性是影响设施黄瓜产量和品质的重要性状。深入解析黄瓜单性结实性状遗传规律并对其进行QTL定位,有助于提高设施专用黄瓜品种育种效率。以强单性结实自交系‘6457’和弱单性结实自交系‘6426’构建的重组自交系F2:8为材料,基于3年表型数据,采用黄瓜基因组测序SSR分子标记构建黄瓜遗传连锁图谱,结合QTL-Seq分析,对黄瓜单性结实性进行QTL定位。黄瓜单性结实性状符合数量遗传特征。利用SSR标记构建了1张包含11个连锁群的遗传图谱,覆盖基因组555.0 cM,平均图距为6.8 cM。2016—2018年春季在3号染色体上均检测到1个与黄瓜单性结实性相关的QTL位点,位于标记SSR19430和SSR15419之间(3.33—5.57 Mb),遗传距离6.6 cM,贡献率分别为11%、12.5%和6.3%。进一步进行QTL-Seq分析,发现4个与黄瓜单性结实性相关的QTL,分别位于1号(4.38—11.00 Mb)、3号(2.24—10.66 Mb)、6号(15.67—17.93 Mb,26.33—27.49 Mb)染色体上。其中在3号染色体上检测到的QTL与Map QTL所得的QTL区间重叠。推测、和为与黄瓜单性结实性状相关的候选基因。分别在1、3、6号染色体上检测到4个与黄瓜单性结实性相关的QTL位点,其中3号染色体上的QTL年度间稳定,贡献率较高。
黄瓜;单性结实;遗传图谱;QTL定位
0 引言
【研究意义】黄瓜(L.)属于葫芦科甜瓜属一年生草本植物,是设施栽培高产高效的主要蔬菜作物之一。单性结实是指子房不经过授粉受精而发育成果实的现象[1],单性结实性状是设施黄瓜绿色标准化生产中直接与产量和品质密切相关的重要性状,强单性结实黄瓜品种在设施栽培的无虫媒条件下,子房无需植物生长调节剂等处理就能够正常膨大形成无籽果实,从而实现优质丰产节本。因此,深入解析黄瓜单性结实性遗传分析和QTL定位,对提高设施专用黄瓜品种育种效率具有重要意义。【前人研究进展】国内外学者对单性结实性的遗传规律研究较多,但由于生长条件、试验设计及所选用材料的不同而研究结果不同。Pike等[2]和DE Ponti等[3]认为单性结实性状属于质量遗传,但目前大多数学者[4-12]认为黄瓜单性结实性具有数量性状的遗传特征,Sun等[7-8]认为黄瓜单性结实性由至少2个基因控制的数量性状;闫立英等[9-12]利用主基因+多基因混合遗传模型分析法研究表明黄瓜单性结实性是1—2对主效基因控制的数量性状。陈学好等[13]筛选出与黄瓜非单性结实基因连锁的ISSR分子标记,遗传连锁距离为18.9 cM。闫立英[14]发现1个与黄瓜非单性结实性紧密连锁的AFLP分子标记,遗传距离为9.7 cM。Sun等[15]采用区间作图和复合区间作图的方法,利用ALFP、SCAR等多种标记对美国加工型全雌黄瓜单性结实性进行图谱构建和QTL分析,两个种植地点共检测到10个QTL,主要分布在3个连锁群上。Calvin等[16]对美国加工黄瓜进行单性结实QTL分析,共检测出7个位点,分布于2、4、5、6、7号染色体上,其中和三个位点与强单性结实品种有关。武喆等[17]发现7个与单性结实有关的QTL位点,分布于1、2、3、5、7染色体上,推测基因和与单性结实相关性更大。Li等[18]通过RNA-Seq检测出14个与单性结实相关的基因,涉及到生长素、细胞分裂素和赤霉素等信号传导及其交互作用。张婷等[19-20]发现12个与单性结实相关的候选基因,但都定位于2号染色体,推测()是单性结实的主要候选基因。【本研究切入点】目前黄瓜单性结实QTL定位作图群体多为暂时性群体,无法验证QTL的稳定性,研究结果不一,而与单性结实性相关的基因较少。【拟解决的关键问题】本研究基于黄瓜强单性结实自交系‘6457’和弱单性结实自交系‘6426’构建的重组自交系(RIL)F2:8,利用SSR标记构建高质量分子标记连锁图谱,初步定位黄瓜单性结实性状关联位点,并结合QTL-Seq数据分析筛选出与黄瓜单性结实有关的关键位点和基因,为分子标记辅助育种提供有价值的参考。
1 材料与方法
1.1 材料
以本校黄瓜课题组自主选育的雌雄同株类型的强单性结实自交系‘6457’为母本(P1),与多代选育的雌雄同株的弱单性结实自交系‘6426’(P2)配制F1,采用单子传代法构建了116个重组自交系(RIL)F2:8。
1.2 表型鉴定方法
2016年春季、2017年春季、2018年春季,将所得116个RIL群体,每个株系定植10株,采用双高垄栽培,大行距80 cm,小行距50 cm,株距23 cm,田间常规管理。在植株开花结果期,参照李锡香等[21]、闫立英等[14]单性结实性状鉴定方法和标准进行单性结实表型鉴定。具体方法:每天下午逐株检查并对次日将开的雌花进行束花隔离,次日上午挂牌标记。注明雌花节位及开花日期,花后8—10 d调查坐果情况,计算单株单性结实坐果率(正常瓜数/标记雌花数×100%),用平均单系单性结实坐果率表示双亲和重组自交系单性结实性的强弱。
1.3 遗传连锁图谱的构建
采用改良CTAB法[22]提取黄瓜基因组DNA。SSR引物序列来源于‘9930’和‘Gy14’黄瓜全基因组测序信息[23],从中选择均匀分布于7条染色体上的1 220对SSR标记,以亲本‘6457’和‘6426’为模板进行多态性筛选,获得多态性好、差异显著的SSR标记引物,对116个RIL群体进行PCR扩增,PCR产物用6%的聚丙烯酰胺凝胶电泳分离,采用银染法进行显色,条带统计,分别以1和0记录电泳谱带的有无,建立SSR数据库,与母本‘6457’带型一致的标记记为A,与父本‘6426’带型一致的标记记为B,模糊不清或者丢失的带记为‘-’,-1、-2、-3分别表示同一引物的不同多态性位点。利用SPSS进行数据处理,经χ2检测,在≤0.05水平,去除偏分离标记引物,再利用JoinMap 4.1软件进行黄瓜连锁图谱的构建。
1.4 不同年份黄瓜单性结实遗传性状分析和QTL定位
调查2016年春季、2017年春季以及2018年春季黄瓜单性结实性状表型数据,进行平均单系单性结实坐果率的次数分布分析。利用Map QTL 4.0软件,以区间作图法(IM)对黄瓜单性结实性状进行QTL分析。选用1 cM的步长,在α=0.01的水平上,利用Permutation检验法重复检验1 000次,将LOD阈值设定为2.5,确定QTL在染色体上的位置和数目。
1.5 基于QTL-Seq的黄瓜单性结实相关基因定位
利用QTL-Seq技术[24]和原理,在RIL群体中挑选单性结实性状差异显著的强单性结实株系和弱单性结实株系各20株,分别构建强单性结实池(parthenocarpy,par)和弱单性结实池(non-parthenocarpy,np),利用Illumina HiSeqTMPE150测序仪对亲本池和混合池展开20×和10×覆盖度的全基因组重测序,获得大量的SNP标记。计算每个位点的SNP频率(SNP-index=该位点与参考序列不同的reads数/总reads数),计算△SNP-index,进行1 000次置换检验。选取95%的置信水平作为筛选的阈值,大于阈值的窗口作为候选区间。
1.6 候选基因分析与预测
利用黄瓜基因组数据库和拟南芥数据库(https:// www.arabidopsis.org/)对定位到的黄瓜单性结实相关基因进行同源比对,分析各基因功能,筛选与黄瓜单性结实相关的参与激素调节、信号转导及功能代谢途径的基因。
2 结果
2.1 黄瓜单性结实遗传分析
对2016年春季、2017年春季以及2018年春季的亲本及RIL群体单性结实性状表型鉴定结果进行相关分析,结果表明不同年份间相关系数均达极显著水平,2016年春季与2017年春季、2016年春季与2018年春季、2017年春季与2018年春季黄瓜重组自交系单性结实率相关系数分别为0.78**、0.77**、0.71**,均达极显著水平,说明不同年份间单性结实表型相对稳定。进一步进行次数分布分析(图1),2016年春季、2017年春季及2018年春季,‘6457’平均单系单性结实坐果率分别为97.95%、87.42%、77.15%,均表现为强单性结实,而‘6426’平均单系单性结实坐果率分别为17.91%、12.50%、11.88%,均表现为弱单性结实,双亲单性结实表型相对稳定且差异明显;RIL群体平均单系单性结实坐果率均为连续分布,符合数量遗传特征。
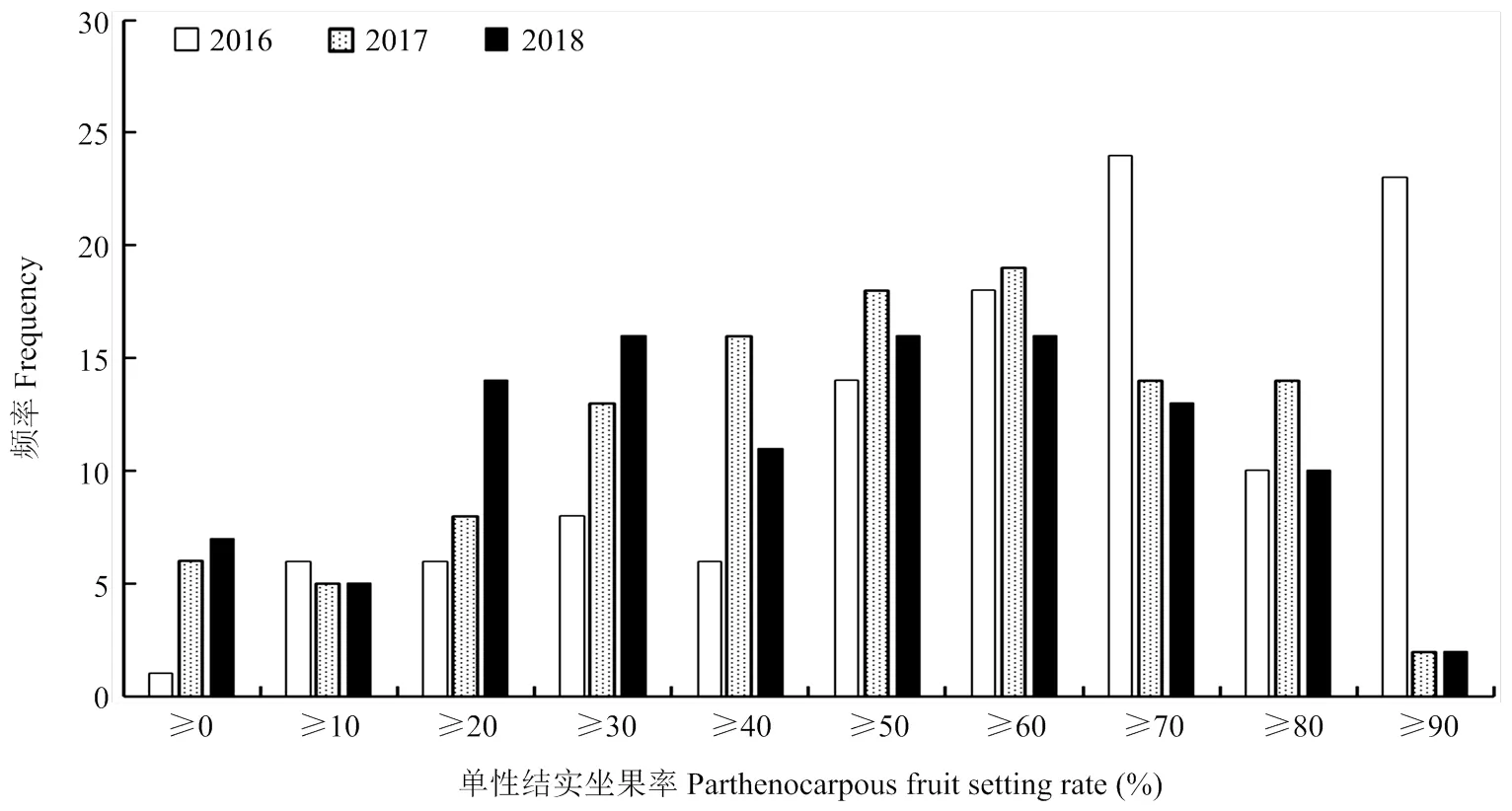
图1 2016—2018年春季RIL群体平均单系单性结实坐果率次数分布图
2.2 黄瓜连锁图谱的构建
以亲本‘6457’和‘6426’为模板,利用1 220对SSR引物进行筛选,共获得在双亲间存在多态性,条带清晰的引物组合169对,多态性为13.9%。169对多态性好的引物,经过χ2检测,在≤0.05水平,87对标记表现出偏分离,去除偏分离标记引物,采用JoinMap 4.1软件,获得一张包含11个连锁群的遗传图谱,包含82个SSR标记,该图谱覆盖基因组555.0 cM,平均图距为6.8 cM。每个连锁群上标记数在2—23个,长度在3.3—120.4 cM。最大的连锁群含有23个标记,覆盖基因组120.4 cM,平均图距5.2 cM,最小的连锁群含有2个标记,覆盖基因组3.3 cM(图2)。
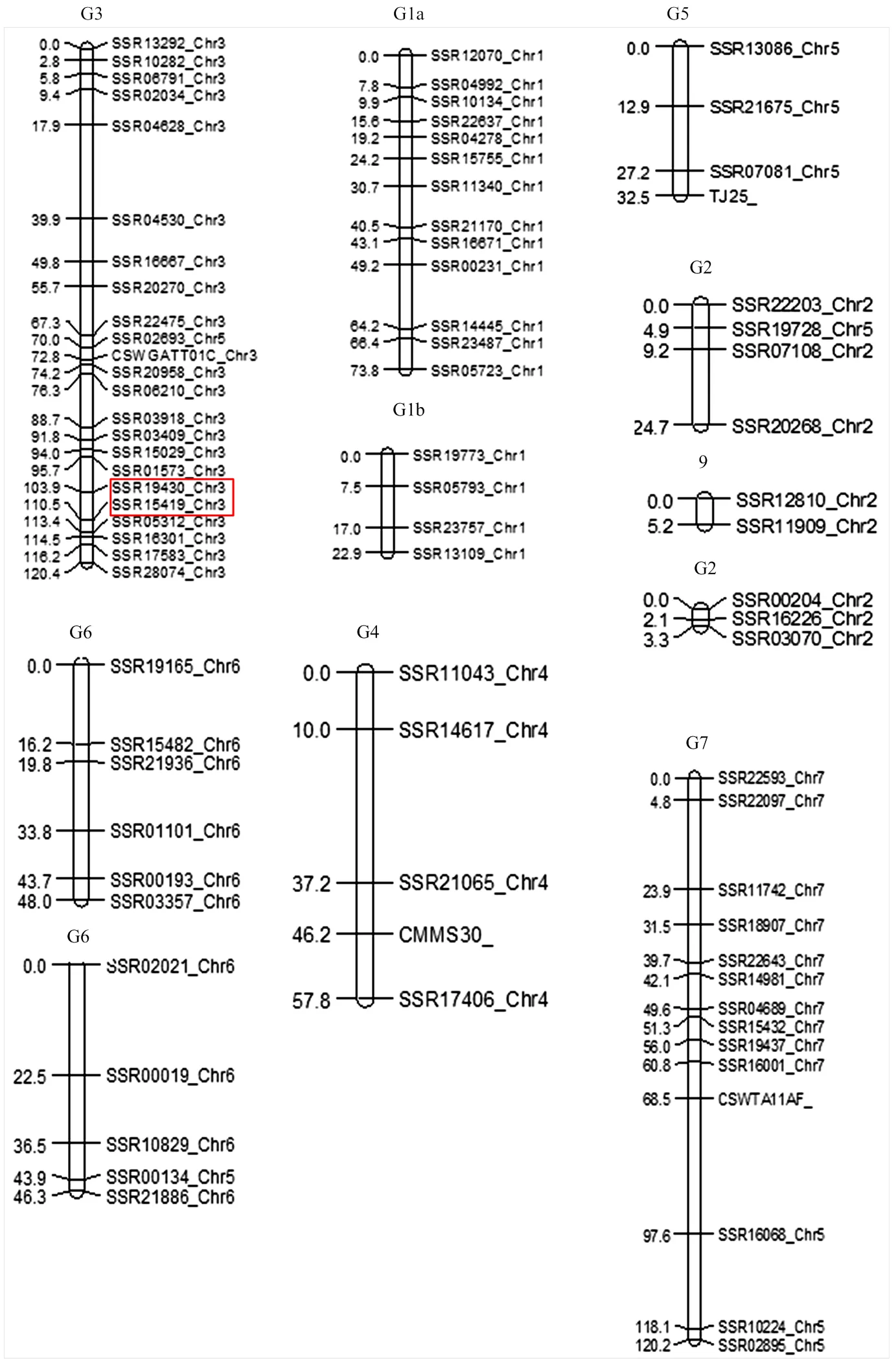
图2 黄瓜(‘6457’ב6426’)SSR遗传连锁图谱及单性结实性状QTL定位
2.3 不同年份黄瓜单性结实QTL定位
基于上述图谱,对2016年春季、2017年春季以及2018年春季3年数据检测,均得到1个与黄瓜单性结实性相关的QTL位点,位于3号染色体上的标记SSR19430和SSR15419之间,遗传距离6.6 cM。2016年春季的QTL对应的LOD值为2.95,贡献率为11%(图3-A);2017年春季的QTL对应的LOD值3.33,贡献率为12.5%(图3-B);2018年春季的QTL对应的LOD值1.54(超过单连锁群阈值),贡献率为6.3%(图3-C)。3年数据重复性好,QTL定位结果一致。
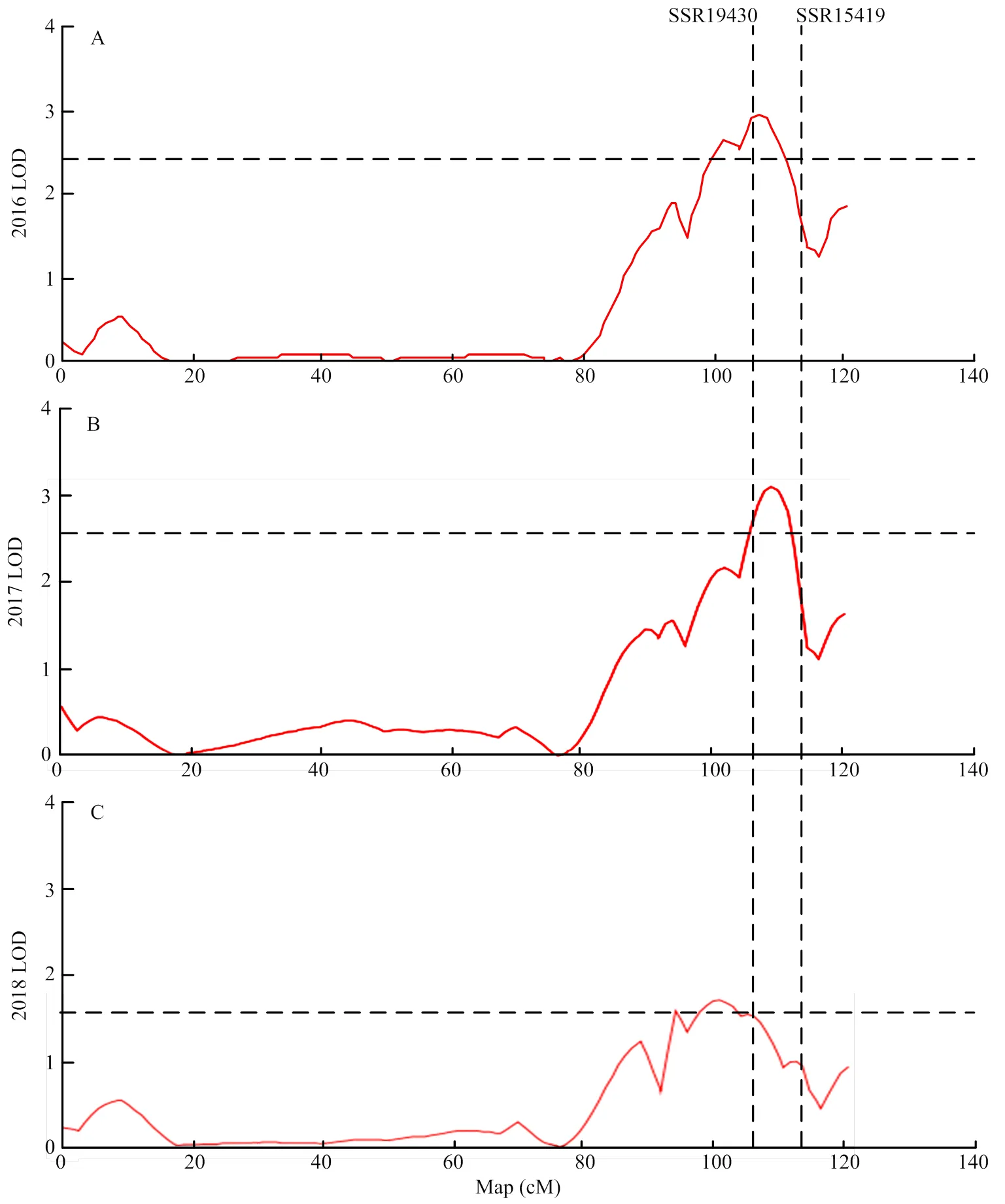
图3 2016年春季(A)、2017年春季(B)以及2018年春季(C)黄瓜(‘6457’ב6426’)单性结实性状第3号染色体上QTL定位结果
2.4 基于QTL-Seq技术的黄瓜单性结实QTL定位
2.4.1 混池测序数据质量分析 对亲本P1、P2及20株强单性结实株系组成的混池(par)和20株弱单性结实株系组成的混池(np)开展全基因组重测序,共得到24.945 G原始数据,过滤后4个样本有效数据量在4 004.935—7 672.465 M,总数据量23.567 G。利用测序结果的QPhred数值(Phred Score,Q),计算碱基错误率,发现Q20≥93.99%、Q30≥87.01%,碱基错误率低于0.03%,测序质量高,GC含量在38.80%—39.84%之间(表1)。以黄瓜基因组作为参考基因组,参考基因组大小为197 271 687 bp,所有样本的比对率在87.06%—88.14%,对参考基因组(排除N区)的平均覆盖深度在12.40—21.61 X,1X覆盖度(至少有一个碱基的覆盖)在97.21%以上(表2)。
2.4.2 黄瓜单性结实QTL定位 以亲本P1作为参考亲本,分析计算两个子代在亲本间163 926个标记位点的SNP-index(即SNP的频率)。根据强单性结实池与弱单性结实池的SNP-index,计算两个池的SNP-index的差值,以染色体位置为横坐标,以1 Mb为单位窗口,1 kb为步长,绘制par池SNP-index(图4-A)、np池SNP-index(图4-B)和△SNP-index图(图4-C)。根据混池之间基因频率差异筛选,对强单性结实(par)与非单性结实池(np)间SNP和Indel统计显示:与参考基因组相比,两个子代池共有287 805个位点发生SNP突变,在外显子区域发现同义突变10 654个,非同义突变9 390个,缺失型终止密码子变异50个,获得性终止密码子变异162个。
在95%的置信水平下,以△SNP-index大于阈值的窗口作为候选区,共检测到4个QTL(图4),分别位于1号染色体(4.38—11.00 Mb)、3号染色(2.24—10.66 Mb)和6号染色体(15.67—17.93 Mb;26.33—27.49 Mb),其中3号染色体QTL-Seq检测到的QTL与前述Map QTL检测到的2016—2018年度间稳定的QTL基本重合,QTL-Seq结果包含Map QTL检测结果(图5)。
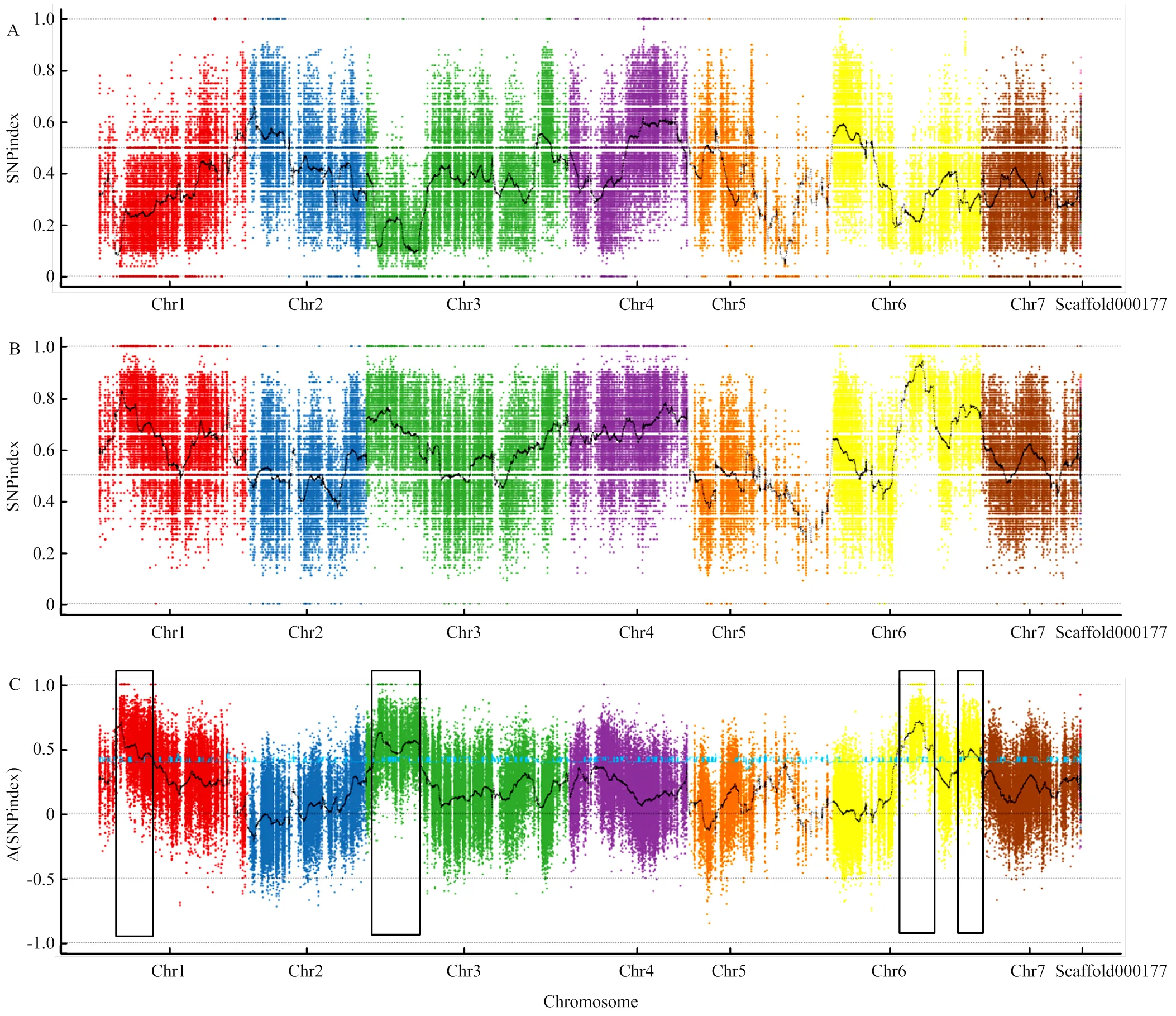
A:par混池SNP-index在染色体上的分布;B:np混池SNP-index在染色体上的分布;C:△SNP-index在染色体上的分布,显著QTL在图中以空心框标注
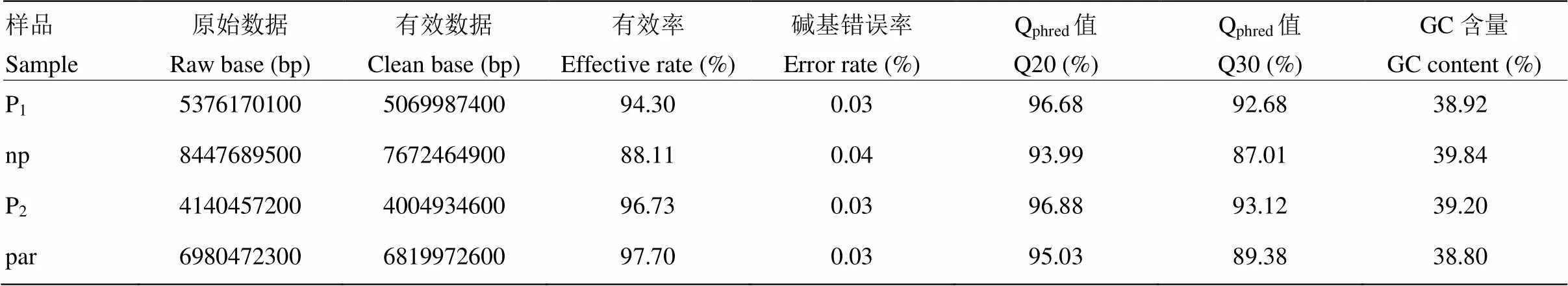
表1 黄瓜(‘6457’ב6426’)单性结实性状QTL-Seq测序数据质量分析
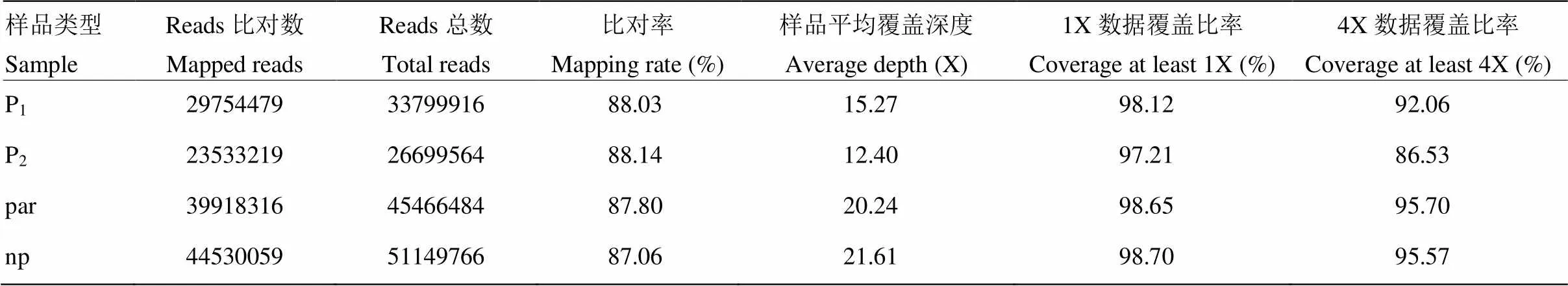
表2 黄瓜(‘6457’ב6426’)单性结实性状QTL-Seq测序深度及覆盖度分析

图5 黄瓜(‘6457’ב6426’ )单性结实性状3号染色体上Map QTL(红框)与QTL-Seq (蓝框)位置比较
2.5 候选基因分析与预测
根据黄瓜基因组,上述4个QTL区间内共获得候选多态性标记位点129个,提取ANNOVAR的注释结果,优先挑选引起stop loss或者stop gain或非同义突变或可变剪接的位点所在的基因作为候选基因,共获得与黄瓜单性结实性状相关的候选基因19个,含有27个SNP位点(表3)。
将单性结实QTL-Seq分析所得候选基因,利用BLAST软件将候选区域的19个基因与拟南芥库进行同源比对,发现19个候选基因编码区中有3个非同义突变,分别为、和。
QTL-Seq与QTL均定位到了3号染色体,其候选基因的上游序列2 000 bp区间内检测到7个变异位点,分别位于:(Unknown protein)、(Receptor-like protein kinase,RLPK)、(DELLA protein GAI,DPG)、(Unknown protein)、(O- Methyltransferase-like protein,OMLP)、(Vacuolar protein sorting-associated protein VTA1-like protein,VTA1L)、(CBL-interacting protein kinase 20,CBLIPK20)上游,编码蛋白激酶、跨膜蛋白和GRAS家族转录因子等(表3)。其中,和是3号染色体上年度可重复区间的两个基因,推测这两个基因是与单性结实性状相关的重要候选基因。(DPG)与赤霉素介导的果实发育有关,因此,推测(DPG)是黄瓜单性结实候选基因。
此外基因编码亚精胺合成酶,而亚精胺是影响黄瓜单性结实和果实生长发育的重要多胺类激素,推测也是与黄瓜单性结实性相关的候选基因。
3 讨论
3.1 关于单性结实的遗传分析
无论是前人采用经典遗传学研究方法[4-8],还是笔者课题组采用的主基因+多基因研究方法[9-12],研究均表明黄瓜单性结实性是由1—2对主效基因控制的数量性状。闫立英等[10-11]基于‘6457’ב6426’构建的多世代联合分析,发现分离世代均表现出明显的主基因+多基因的遗传特征。本试验对‘6457’ב6426’配组的RIL群体进行平均单系单性结实坐果率的次数分布分析,黄瓜单性结实性状符合数量性状遗传特征。
3.2 关于单性结实QTL定位研究
研究认为[25-26],以初定位为目的,100—200个作图群体,每隔10 cM左右有一个标记就足够,若5—10 cM有一个标记,即使再增加标记也不会提高QTL检测功效。本试验采用116个RIL永久作图群体,构建了1张包含11个连锁群的遗传图谱,覆盖基因组555.0 cM,平均图距为6.8 cM,图谱已满足初定位要求。Sun等[15]采用区间作图和复合区间作图的方法,利用AFLP、SCAR和RAPD等标记对美国加工型全雌黄瓜单性结实性进行图谱构建和QTL分析,两个种植地点共检测到10个QTL,主要分布在3个连锁群上。与本研究相比,虽考虑到环境对单性结实的影响,但研究材料和标记手段不同,且Sun等[15]的研究中连锁群未能与黄瓜染色体对应,因此相比较下,本研究结果更有参考价值。
武喆等[17]利用1 335对SSR引物和143对Indel引物对F2:3家系进行两季筛选,多态性为11.7%。本研究利用1 220对SSR引物对RIL群体进行两年筛选,多态性为13.9%。相同之处:分子标记多态性都偏低,这可能与两亲本都是栽培种有关;都考虑到环境对单性结实的影响,保证了试验结果的准确性。但试验材料和定位到单性结实位点不同,武喆等[17]所用为暂时性群体F2:3家系,并检测出7个与单性结实有关的QTL位点,分布于1、2、3、5、7号染色体上,认为Parth2-1是单性结实性主效QTL位点。本研究利用永久性作图群体RIL,且传代多年,定位到1、3、6号染色体上。虽与武喆等[17]定位到的主效QTL位点不同,但与其认为的Parth3-1(SSR17751-UW084149)和Parth3-2(SSR16667-UW085093)两个微效QTL单性结实位点相近,这也更加说明单性结实性状与3号染色体相关。此外,还定位到了6号染色体上的8个基因,为进一步定位黄瓜单性结实关键基因提供参考。
3.3 QTL-Seq与传统作图QTL定位结果的比较
本研究采用QTL-Seq方法检测到黄瓜单性结实性的4个QTL,分别位于1、3、6号染色体。采用Map QTL方法在3号染色体上(3.33—5.57 Mb)上检测到年度间稳定的QTL,且位于QTL-Seq在3号染色体上检测到(2.24—10.66 Mb)的QTL区间内,而Map QTL方法在1号和6号染色体上未能检测到QTL的原因可能是遗传连锁图谱标记密度较低所致[27-29]。
3.4 关于单性结实候选基因预测
目前黄瓜单性结实基因研究较少,Li等[18]利用RNA-Seq发现14个与单性结实相关的基因,功能涉及生长素、细胞分裂素等。武喆等[17]推测出基因和与单性结实相关的可能性更大。张婷等[19-20]发现12个定位于2号染色体上的单性结实候选基因,推测()是单性结实的重要候选基因。
本研究利用Map QTL和QTL-Seq两种方法,将与单性结实性有关的QTL共同指向3号染色体,且QTL-Seq结果包含Map QTL结果,在QTL-Seq检测到的19个候选基因中,和位于Map QTL和QTL-Seq两种方法检测结果的重合区域,故推测这两个基因是与单性结实性状相关的主要关键基因。此外,3号染色体上的7个基因分别编码蛋白激酶、跨膜蛋白和GRAS家族转录因子等。其中DELLA蛋白属于GRAS家族,是GA信号传导途径的核心作用元件,且GA与植物花和果实发育有关[30-32],而(DPG)是GAI的DELLA蛋白,因此推测其是单性结实的关键基因。
此外,多胺对番茄[33]、苹果[34-36]、柑橘[37]、李[38]等许多植物开花结果和果实发育具有明显的调节作用。亚精胺是影响黄瓜单性结实和果实生长发育的重要多胺类激素,陈学好等[39]和于杰等[40]发现未授粉子房施用外源亚精胺能显著提高子房内源亚精胺、精胺与腐胺水平,促进其单性结实和果实生长。黄瓜编码亚精胺合成酶(亚精胺合成途径关键酶),虽然该基因不在3号染色体上,但推测其与黄瓜单性结实有关。与前人研究结果相比较,本研究推测到的与黄瓜单性结实相关的基因并无重合,为进一步解析黄瓜单性结实现象提供了参考。
4 结论
本研究以强单性结实自交系‘6457’与弱单性结实自交系‘6426’构建的RIL为试材,基于SSR标记构建出一张覆盖基因组555.0 cM,平均图距为6.8 cM的连锁图谱。传统QTL检测到年度间稳定遗传的1个QTL,位于3号染色体SSR19430—SSR15419标记之间,遗传距离6.6 cM。QTL-Seq发现4个与黄瓜单性结实性状相关的QTL,分别位于1、3、6号染色体上,QTL-Seq结果包含QTL初定位结果,推测和是与单性结实性状相关的重要关键基因;和也是与黄瓜单性结实性状相关的候选基因。
[1] 陈学好, 曹碚生. 黄瓜单性结实研究概况. 中国蔬菜, 1994(3): 56-59.
CHEN X H, CAO B S. Research on parthenocarpy in cucumber., 1994(3): 56-59. (in Chinese)
[2] PIKE L M, PETERSON C E. Inheritance of parthenocarpy in the cucumber (L)., 1969, 18(1): 101-105.
[3] DE PONTI O M B, GARRETSEN F. Inheritance of parthenocarpy in pickling cucumbers (L) and linkage with other characters., 1976, 25(1): 633-642.
[4] EL-SHAWAF I I S, BAKER L R. Inheritance of parthenocarpic yield in gynoecious pickling cucumber for once-over mechanical harvest by diallel analysis of six gynoecious lines., 1981, 106(3): 359-364.
[5] EL-SHAWAF I I S, BAKER L R. Combining ability and genetic variances of G×H F1hybrids for parthenocarpic yield in gynoecious pickling cucumber from once-over mechanical harvest., 1981, 106(3): 365-370.
[6] 曹碚生, 陈学好, 徐强, 顾春山. 黄瓜单性结实世代遗传效应的初步研究. 园艺学报, 1997, 24(1): 53-56.
CAO B S, CHEN X H, XU Q, GU C S. The genetic effects of parthenocarpic generations of cucumber., 1997, 24(1): 53-56. (in Chinese)
[7] SUN Z Y, LOWER R L, STAUB J E. Analysis of generation means and components of variance for parthenocarpy in cucumber (L)., 2006, 125(3): 277-280.
[8] SUN Z Y, LOWER R L, STAUB J E. Variance component analysis of parthenocarpy in elite U.S. processing type cucumber (L.) lines., 2006, 148(3): 331-339.
[9] 闫立英, 娄丽娜, 娄群峰, 陈劲枫. 全雌黄瓜单性结实性的遗传分析. 园艺学报, 2008, 35(10): 1441-1446.
YAN L Y, LOU L N, LOU Q F, CHEN J F. Inheritance of parthenocarpy in gynoecious cucumber (L)., 2008, 35(10): 1441-1446. (in Chinese)
[10] 闫立英, 娄丽娜, 李晓丽, 娄群峰, 冯志红, 陈劲枫. 雌雄同株黄瓜单性结实性遗传分析. 中国农业科学, 2010, 43(6): 1295-1301.
YAN L Y, LOU L N, LI X L, LOU Q F, FENG Z H, CHEN J F. Inheritance of parthenocarpy in monoecious cucumber (L)., 2010, 43(6): 1295-1301. (in Chinese)
[11] 闫立英, 娄丽娜, 冯志红, 李晓丽, 娄群峰, 陈劲枫. 雌雄同株黄瓜单性结实性主基因+多基因混合遗传分析. 西北植物学报, 2009, 29(6): 1122-1126.
YAN L Y, LOU L N, FENG Z H, LI X L, LOU Q F, CHEN J F. Analysis on mixed major gene and polygene inheritance of parthenocarpy in monoecious cucumber (L)., 2009, 29(6): 1122-1126. (in Chinese)
[12] 闫立英, 娄丽娜, 冯志红, 娄群峰, 李晓丽, 陈劲枫. 不同生态环境下雌雄同株黄瓜单性结实性遗传的比较. 应用生态学报, 2010, 21(1): 61-66.
YAN L Y, LOU L N, FENG Z H, LOU Q F, LI X L, CHEN J F. Inheritance of parthenocarpy in monoecious cucumber(L) under different eco-environments., 2010, 21(1): 61-66. (in Chinese)
[13] 陈学好, 王佳, 徐强, 嵇怡, 梁国华. 一个与黄瓜单性结实基因连锁的ISSR标记. 分子遗传育种, 2008, 6(1): 85-88.
CHEN X H, WANG J, XU Q, JI Y, LIANG G H. An ISSR marker linked to the parthenocarpic gene of cucumber., 2008, 6(1): 85-88. (in Chinese)
[14] 闫立英. 黄瓜单性结实性生理和遗传分析及分子标记研究[D]. 南京: 南京农业大学, 2009.
YAN L Y. Studies on physiological and genetic analysis and molecular makers of parthenocarpy in cucumber (L) [D]. Nanjing: Nanjing Agricultural College, 2009. (in Chinese)
[15] SUN Z Y, STAUB J, CHUNG S M, E LOWER R L. Identification and comparative analysis of quantitative trait loci associated with parthenocarpy in processing cucumber., 2006, 125(3): 281-287.
[16] LIETZOW C D. ZHU H Y, PANDEY S, HAVEY M J, WENG Y Q. QTL mapping of parthenocarpic fruit set in North American processing cucumber., 2016, 129(12): 2387-2401.
[17] 武喆, 李蕾, 张婷, 张停林, 李季, 娄群峰, 陈劲枫. 黄瓜单性结实性状的QTL定位. 中国农业科学, 2015, 48(1): 112-119.
WU Z, LI L, ZHANG T, ZHANG T L, LI J, LOU Q F, CHEN J F. QTL mapping of parthenocarpy traits in cucumber., 2015, 48(1): 112-119. (in Chinese)
[18] LI J, WU Z, CUI L, ZHANG T L, GUO Q W, XU J, JIA L, LOU Q F, HUANG S W, LI Z G, CHEN J F. Transcriptome comparison of global distinctive features between pollination and parthenocarpic fruit set reveals transcriptional phytohormone cross-talk in cucumber (L)., 2014, 55(7): 1325-1342.
[19] 张婷. 黄瓜单性结实相关基因的克隆与表达研究[D]. 南京: 南京农业大学, 2016.
ZHANG T. Cloning and expression analysis of parthenocarpy related genes
[20] 张婷, 武喆, 张开京, 徐建, 娄群峰, 李季, 陈劲枫. 黄瓜单性结实候选基因预测与表达分析. 核农学报, 2016, 30(2): 224-230.
ZHANG T, WU Z, ZHANG K J, XU J, LOU Q F, LI J, CHEN J F. Prediction and expression analysis of parthenocarpy candidate genes in cucumber., 2016, 30(2): 224-230. (in Chinese)
[21] 李锡香, 朱德蔚. 黄瓜种质资源描述规范和数据标准. 北京: 中国农业出版社, 2005.
LI X X, ZHU D W.(L.). Beijing: China Agricultural Press, 2005. (in Chinese)
[22] MURRAY H G, THOMPSON W F. Rapid isolation of higher weight DNA., 1980, 8(19): 4321.
[23] HUANG S W, LI R Q, ZHANG Z H, LI L, GU X F, FAN W, LUCAS W J, WANG X W, XIE B Y, NI P X, REN Y, ZHU H M, LI J, LIN K, JIN W W, FEI Z J, LI G C, STAUB J B, KILIAN A, VAN DER VOSSEN E A G,. The genome of the cucumber,L., 2009, 41(12): 1275-1281.
[24] TAKAGI H, ABE A, YOSHIDA K, KOSUGI S, NATSUME S, MITSUOKA C, UEMURA A, UTSUSHI H, TAMIRU M, TAKUNO S, INNAN H, CANO L M, KAMOUN S, TERAUCHI R. QTL-seq: rapid mapping of quantitative trait loci in rice by whole genome resequencing of DNA from two bulked populations., 2013, 74(1): 174-183.
[25] LI H, HEAME S, BANZIGER M, LI Z, WANG J. Statistical properties of QTL linkage mapping in biparental genetic populations., 2010, 105(3): 257-267.
[26] 李慧慧, 张鲁燕, 王健康. 数量性状基因定位研究中若干常见问题的分析与解答. 作物学报, 2010, 36(6): 918-931.
LI H H, ZHANG L Y, WANG J K. Analysis and answers to frequently asked questions in quantitative trait locus mapping., 2010, 36(6): 918-931. (in Chinese)
[27] YU H H, XIE W B, WANG J, XING Y Z, XU C G, LI X H, XIAO J H, ZHANG Q F. Gains in QTL detection using an ultra-high density SNP map based on population sequencing relative to traditional RFLP/SSR markers., 2011, 6(3): e17595.
[28] LI H, HEAME S, BANZIGER M, LI Z, WANG J. Statistical properties of QTL linkage mapping in biparental genetic populations., 2010, 105(3): 257-267.
[29] ZHOU Z Q, ZHANG C S, ZHOU Y, HAO Z F, WANG Z H, ZENG X, DI H, LI M S, ZHANG D G, YONG H J, ZHANG S H, WENG J F, LI X H. Genetic dissection of maize plant architecture with an ultra-high density bin map based on recombinant inbred lines., 2016, 17(1): 178.
[30] FLEET C M, SUN T P. A DELLAcate balance: the role of gibberellin in plant morphogenesis., 2005, 8: 77-85.
[31] ZHAO B, LI H T, LI J J, WANG B, DAI C, WANG J, LIU K D.DS-3, encoding a DELLA protein, negatively regulates stem elongation through gibberellin signaling pathway., 2017, 130(4): 727-741.
[32] LI W J, ZHANG J X, SUN H Y, WANG S M, CHEN K Q, LIU Y X, LI H, MA Y, ZHANG Z H. FveRGA1, encoding a DELLA protein, negatively regulates runner production in., 2018, 247(4): 941-951.
[33] RAJEEV R, SAWHNEY V K. Polyamines and flower development in the male sterile stamenless-2 mutant of tomato (Mill.)., 1990, 93: 446-452.
[34] COSTA G, BAGNI N. Effect of polyamines on fruit set of apple., 1983, 18(1): 59-61.
[35] 徐继忠, 陈海江, 邵建柱, 袁小乱, 马宝焜, 章文才. 外源多胺促进红富士苹果花芽形成的效应. 果树科学, 1998, 15(1): 10-12.
XU J Z, CHEN H J, SHAO J Z, YUAN X L, MA B K, ZHANG W C. Effects of exogenous polyamines on flower bud formation of red Fuji apple variety., 1998, 15(1): 10-12. (in Chinese)
[36] 徐继忠, 陈海江, 马宝焜, 章文才. 外源多胺对富士苹果花和幼果内源多胺与激素的影响. 园艺学报, 2001, 28(3): 206-210.
XU J Z, CHEN H J, MA B K, ZHANG W C. Effects of exogenous spermidine on the levels of endogenous hormones and polyamines in the flowers and fruitlets of red Fuji apple., 2001, 28(3): 206-210. (in Chinese)
[37] 张秋明, 郑玉生, 魏岳荣, 刘昆玉, 谢深喜. 柑桔多胺代谢及其对生长结果调控的研究. 湖南农业大学学报, 2000, 26(4): 271-273.
ZHANG Q M, ZHENG Y S, WEI Y R, LIU K Y, XIE S X. Studies on polyamine metabolism and its regulation of growth and fruit set in Citrus., 2000, 26(4): 271-273. (in Chinese)
[38] 任小林, 马锋旺, 王飞. 亚精胺对李果实乙烯的产生和呼吸速率的影响. 植物生理学通讯, 1995, 31(3): 186-188.
REN X L, MA F W, WANG F. Effect of spermidine on ethylene and respiration of plum., 1995, 31(3): 186-188. (in Chinese)
[39] 陈学好, 于杰, 徐强, 郭绍贵. Spd和MGBG对黄瓜子房内源多胺和蛋白质组成的影响及与单性结实的关系. 园艺学报, 2005, 32(4): 632-637.
CHEN X H, YU J, XU Q, GUO S G.Effects of Spd and MGBG on endogenous polyamine levels and protein profiles in ovary and its relationship with parthenocarpy of cucumber., 2005, 32(4): 632-637. (in Chinese)
[40] 于杰. 黄瓜单性结实与多胺代谢的关系及多胺调控研究[D]. 扬州: 扬州大学, 2003.
YU J. Study on the relationship between parthenocarpy and polyamines metabolism of cucumber ovary and exogenous regulation with polyamines [D]. Yangzhou: Yangzhou University, 2003. (in Chinese)
Inheritance and QTL Mapping for Parthenocarpy in Cucumber
NIU ZhiHong, SONG XiaoFei, LI XiaoLi, GUO XiaoYu, HE ShuQiang, HE LuanJingZhi, FENG ZhiHong, SUN ChengZhen, YAN LiYing
(Hebei Normal University of Science and Technology, Qinhuangdao 066004, Hebei)
【】 Parthenocarpy is an important trait affecting both yield and quality in the protected cucumber production. Genetic analysis of parthenocarpy and its QTL mapping are of great significance for improving breeding efficiency in cucumber.【】 Based on three-year phenotypic data, the genetic linkage map of cucumber was constructed by using SSR molecular markers obtained from cucumber genome sequencing, and the QTL-Seq analysis was used to map the parthenocarpy of cucumber, using recombinant inbred line F2:8constructed from strong parthenocarpic inbred line ‘6457’ and weak parthenocarpic inbred line ‘6426’.【】 The inheritance of parthenocarpy in cucumber accorded with quantitative inheritance. A genetic map containing 11 linkage groups was constructed using SSR markers, covering 555.0 cM of the genome with an average distance of 6.8 cM. In the spring of 2016, 2017 and 2018, a single QTL locus related to parthenocarpy was commonly detected between SSR19430 and SSR15419 markers (3.33-5.57 Mb) on chromosome 3, and the genetic distance was 6.6 cM, with 11%, 12.5% and 6.3% contribution rate, respectively. By QTL-Seq analysis, four QTLs related to parthenocarpy were identified on chromosomes 1 (4.38-11.00 Mb), 3 (2.24-10.66 Mb) and 6 (15.67-17.93 Mb; 26.33-27.49 Mb), the QTL on chromosome 3 overlapped with that detected by Map QTL approach.,,andwere proposed to be candidate genes associated with parthenocarpic trait in cucumber. 【】Four QTLs were identified on chromosome 1, 3 and 6, including one QTL on chromosome 3 that was consistently detected over years with relatively high contribution. The results could facilitate marker-assisted selection and understanding the underlying mechanism of parthenocarpy in cucumber.
cucumber; parthenocarpy; genetic map; QTL mapping
10.3864/j.issn.0578-1752.2020.01.015

2019-01-21;
2019-06-05
河北省重点研发计划(19226364D)、河北省现代农业产业技术体系创新团队建设项目(HBCT2018030209)
牛志红,Tel:18332567462;E-mail:zhihongn@163.com。宋晓飞,Tel:13613358355;E-mail:songxiaofei1979@163.com。牛志红和宋晓飞为同等贡献作者。通信作者闫立英,Tel:13933608253;E-mail:yanliying2017@126.com。通信作者孙成振,Tel:18000690856;E-mail:chengzhensun@126.com
(责任编辑 赵伶俐)
