甜瓜实时荧光定量PCR分析中内参基因的筛选
2020-02-22章丽珍韩晓云吴菁华GefuWANG-PRUSKI张志忠
章丽珍 韩晓云 吴菁华 GefuWANG-PRUSKI 张志忠
摘要:【目的】篩选可分别在甜瓜不同组织器官和不同胁迫处理下稳定表达的内参基因,用于对靶基因表达量的实时荧光定量分析,保证相关试验的准确性及可靠性。【方法】以甜瓜品种新银辉为试验材料,通过实时荧光定量PCR技术分析18s rRNA、TUA、EFla、Actinl、Actin2、Actin3、Actin4、CYC和UBI-ep共9个候选内参基因在甜瓜不同组织器官及不同胁迫处理下的表达稳定性,包括甜瓜根、叶、种子和果实4种不同组织材料,以及水分胁迫、肉桂酸胁迫、盐碱胁迫和ABA胁迫4种处理。同时使用Best-Keeper、Norm Finder和ge Norm软件对9个候选内参基凶进行稳定性分析。【结果】对不同组织器官而言,Best-Keeper评估排名前5的内参基因依次为CYC>18srRNA> UBI-ep> EFla> TUA;Norm Finder计算排名前5的内参基凶依次为EFla> UBI-ep>Actin4> CYC>Actin3;geNorm分析排名前5的基因依次为Actin4=Actin3>Actinl>EFla>UBI-ep。不同胁迫处理中,Best-Keeper计算排名前5的基凶依次为18s rRNA>Actin3>Actin4>EFla>UBI-ep;Norm Finder分析排名前5的基凶依次为EFla>UBI-ep>Actin4>CYC>18s rRNA;ge Norm分析排名前5的基因依次为EFla=UBI-ep>Actin4>CYC>Actinl。总体而言EFla在不同组织器官和不同胁迫处理中的综合排名均较为稳定;Actin4、Actin3、Actinl和EFla是不同组织器官中较为稳定的内参基因组合;EFla和UBI-ep是4种胁迫条件下较稳定的内参基因组合。【结论】EFla在甜瓜不同组织器官及不同胁迫条件下均可稳定表达,是较为合适的内参基因;同时可通过设置双内参基因进一步降低试验误差。
关键词:甜瓜;内参基凶;实时荧光定量PCR;组织器官;胁迫
中图分类号:S 652
文献标志码:A
文章编号:1008-0384(2020)11-1179-09
0 引言
【研究意义】实时荧光定量PCR技术(QuantitativeReal-time PCR,RT-qPCR)因其具有简单、高效、低成本等特点,在分子生物学研究领域被广泛应用。RT-qPCR检测结果依样品来源和处理条件而异,同时与样本品质、样品反转录效率、加样模板量等因素也密切相关,一个能在不同样品中相对稳定表达的内参基因是对其结果进行标准化衡量的关键[1]。甜瓜(Cucumis melo L.)具有较高的经济价值,是世界各地广泛栽培和消费的重要瓜果作物[2]。目前关于甜瓜内参基因筛选的报道较少,不同研究选用的内参基因不同,导致研究结果间可比性和重复性较差,限制了其分子生物学研究的深入。本研究旨在筛选适用于甜瓜不同组织器官和不同胁迫处理下的有效内参基因,为甜瓜RT-qPCR检测提供可靠理论依据。【前人研究进展】内参基因的选择对于RT-qPCR检测至关重要,有严格的标准和分析方法[3-4]。但必须注意的是没有一个内参基因能在不同物种及不同试验条件下恒定表达[5]。如18s rRNA是最广泛应用的内参基因之一,研究显示其在野百合[6](Lilium brownieF.E.)和黄山栾树[7](Koelreuteria bipinnata Franch,)等物种中可稳定表达;但在洪桐[8](Davidia involucrataBaill.)和鼠尾草[9](Salvia hispanica Thunb.)中表达稳定性均较差,不适合作为二者相关研究中的内参基因。在对中国石蒜(Lvcoris chinensis Traub.)的研究中发现,Ubiquitin5基因可在不同花发育时期稳定表达,但在不同组织中表达稳定性较差[10]。对内参基因的筛选受到研究者的广泛重视,如已有关于牡丹[11](Paeonia suffruticosa Andr.)、 棉花[12](Gossypiumhirsutum L.)和刺葡萄[13](Vitis davidii Fo?x.)等重要植物内参基因筛选的报道,这些报道将有利于提高相关试验的准确性和可重复性[14]。对甜瓜而言,Actin3在总样品、根、茎叶样品中具有较好的稳定性,但在高低温胁迫、不同激素胁迫下表达稳定性较差[15]。【本研究切入点】目前甜瓜内参基因筛选的报道较少,前人筛选的甜瓜内参基因均是针对不同胁迫或是不同的组织器官分别筛选,鲜少将两者结合考虑。【拟解决的关键问题】本研究以甜瓜不同组织器官以及水分胁迫、白毒胁迫、盐碱胁迫和ABA处理等多种胁迫处理样品为材料,选择18s rRNA、TUA、EFla、Actin、Actin2、Actin3、Actin4、CYC和UBI-ep等9个内参基因,综合利用Best-Keeper、NormFinder和ge Norm软件对相关基因的稳定性进行分析,并进行验证,以期筛选出在甜瓜中稳定表达并适用于不同条件的内参基因或其组合。
1 材料与方法
1.1试验材料
供试材料为新银辉品种的甜瓜,购于福建农嘉种业股份有限公司。
1.2试验方法
1.2.1甜瓜幼苗培育 选取颗粒饱满的甜瓜种子,使用l0%过氧化氢溶液进行浸种10 min,均匀撒到含有珍珠岩的培养皿(90 mm)中,并加入10mL无菌双蒸水(保证充分浸湿珍珠岩),盖上培养皿盖子,放置于28℃的恒温培养箱,暗环境培养3d后,分别将单株苗转移至500g基质(蛭石、珍珠岩、草炭土比为1:1:3)中培育。在自然生长条件下,选取长势一致的甜瓜三叶一心幼苗进行处理,采用5%PEG-6000溶液模拟水分胁迫,采用0.6 mmol·L-1肉桂酸溶液模拟自毒胁迫,采用50 mmol·L-1 NaCI+25 mmol·L-1 NaHC03溶液模拟盐碱胁迫,采用4mg·L-1ABA溶液进行ABA处理,以上溶液均采用双蒸水进行配制。每盆根灌100 mL上述不同处理液,ABA处理采用叶面喷施方式进行。在第3d取植株的第3叶作为甜瓜叶片不同胁迫处理的供试材料;另选取未经过胁迫处理的甜瓜种子、根、叶、果实作为不同组织器官的供试材料对照。所有样品均设3次重复,每个处理不少于10株幼苗。取样后迅速置于液氮中,存放于-80℃环境中用于提取RNA。
1.2.2总RNA提取及cDNA合成 用天根多酚多糖总RAN提取试剂盒(TIANGEN公司)提取供试材料总RNA,具体提取操作步骤按照说明书进行,用NanoDrop200超微量分光光度计[赛默飞世尔科技(中国)有限公司]测定RNA的OD值和浓度,用l%的凝胶琼脂检测RNA的完整性。利用Hifair?Ⅱlst Strand cDNA Synthesis SuperMix for qPCR( gDNAdigester plus)试剂盒(上海翊圣生物科技有限公司)反转录合成cDNA,置于-20℃保存。
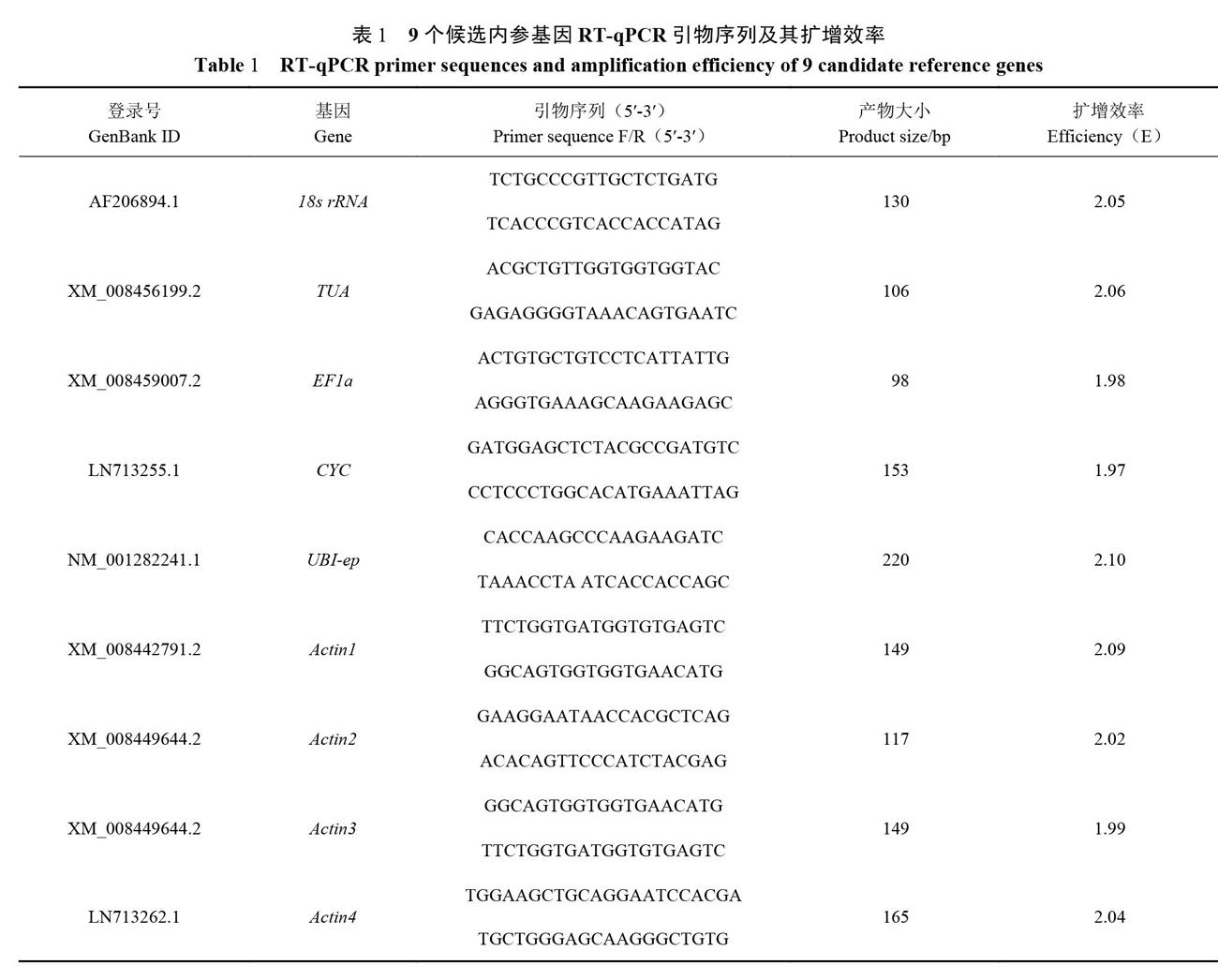
1.2.3引物设计和特异性检测 选择9个功能不同的看家基因:18s rRNA、TUA、EFla、Actinl、Actin2、Actin3、Actin4、CYC、UBI-ep作为候选内参基因,通过Primer Premier 5.0软件设计内参基因引物(表1),由福州尚亚生物技术有限公司合成引物。将所有样品的cDNA模板等量混合,对10个内参基因进行PCR。PCR反应采用2×Taq Master Mix(上海近岸科技有限公司)试剂,反应20μL体系为:上、下游引物(10 μmol·L-1)分别0.5μL,cDNA模板1μL,2×Taq Master Mix 10μL,无菌水8μL。PCR反应条件为:95℃预变性3 min;98℃变性20s,60℃退火20s,72℃延伸30s,共35个循环;72℃延伸5min。最后用l%的琼脂糖凝胶电泳检测引物特异性。
1.2.4扩增效率及qRT-PCR分析 实时荧光定量PCR在伯乐公司的CFX96Touch实时荧光定量PCR仪上进行,按照Hieff? qPCR SYBR Green Master Mix试剂盒(上海翊圣生物科技有限公司)进行,反应体系为20μL:上、下游引物(10μmol·L-1)分别为0.4μL,cDNA模板1μL,Hieff? qPCR SYBR Green MasterMix 10μL,无菌水8.2μL。反应程序:95℃预变性5min,变性95℃10 s,60℃退火30s,72℃延伸20s,共45个循环,每个样品设置3次重复;反应结束,根据熔解曲线分析基因的特异性。将所有样品的cDNA模板等量混合,按10倍进行稀释,稀释成5个浓度梯度,进行标准曲线制作,根据Bio-RadCFX Manager 3.0(3.0.1224.1015)软件给出的Ct值(循环阈值,Cycle threshold)计算引物的扩增效率E值,计算公式为:E=(10-1/slope-1)×100%,Slope为标准曲线的斜率。
1.3数据分析
通过Excel对数据进行整理,参照BestKeeper[14]、NormFinder[16]和geNorm[4]软件使用说明,对9个候选内参基因稳定性进行分析筛选。
2 结果与分析
2.1 RNA质量、引物特异性检测及扩增效率分析
采用NanoDrop 200超微量分光光度计测定所提取甜瓜不同组织RNA的OD值,所提的总RNA浓度为1028~7230 ng·μL-l,OD260/280值在1.89~2.10;经过1%的琼脂凝胶电泳检测,18S和28S的条带清晰,且28S条带亮度约是18S条带的2倍,表明所有样品的总RNA质量良好,符合后续试验要求。将8个不同组织器官的模板等量混合,在1%的琼脂凝胶电泳检测,扩增出的条带均为单一条带,无引物二聚体(图1)。所有引物的熔解曲线均只有单一峰且重复性好(图2),进一步说明引物特异性好。通过Ct值计算引物的扩增效率E值,9个候选内参基因的扩增效率在1.97~2.10(表1),符合荧光定量PCR要求。
2.2 9个候选参考基因表达稳定性分析
2.2.1 9个内参基因Ct值分析 采用荧光定量PCR仪对9个候选内参基因进行扩展,由图3可看出,9个候选内参基因的Ct值分布于9.02~35.63,其中18s rRNA Ct值最小,表明其在样品中的转录水平最高;Actin2分布范围最广,且Ct值最大,丰度低,最大Ct值与最小Ct值相差6.36;EFla分布范围最小,Ct值相差3.09;其他内参基因Ct值的相差分布于3.40~4.99。
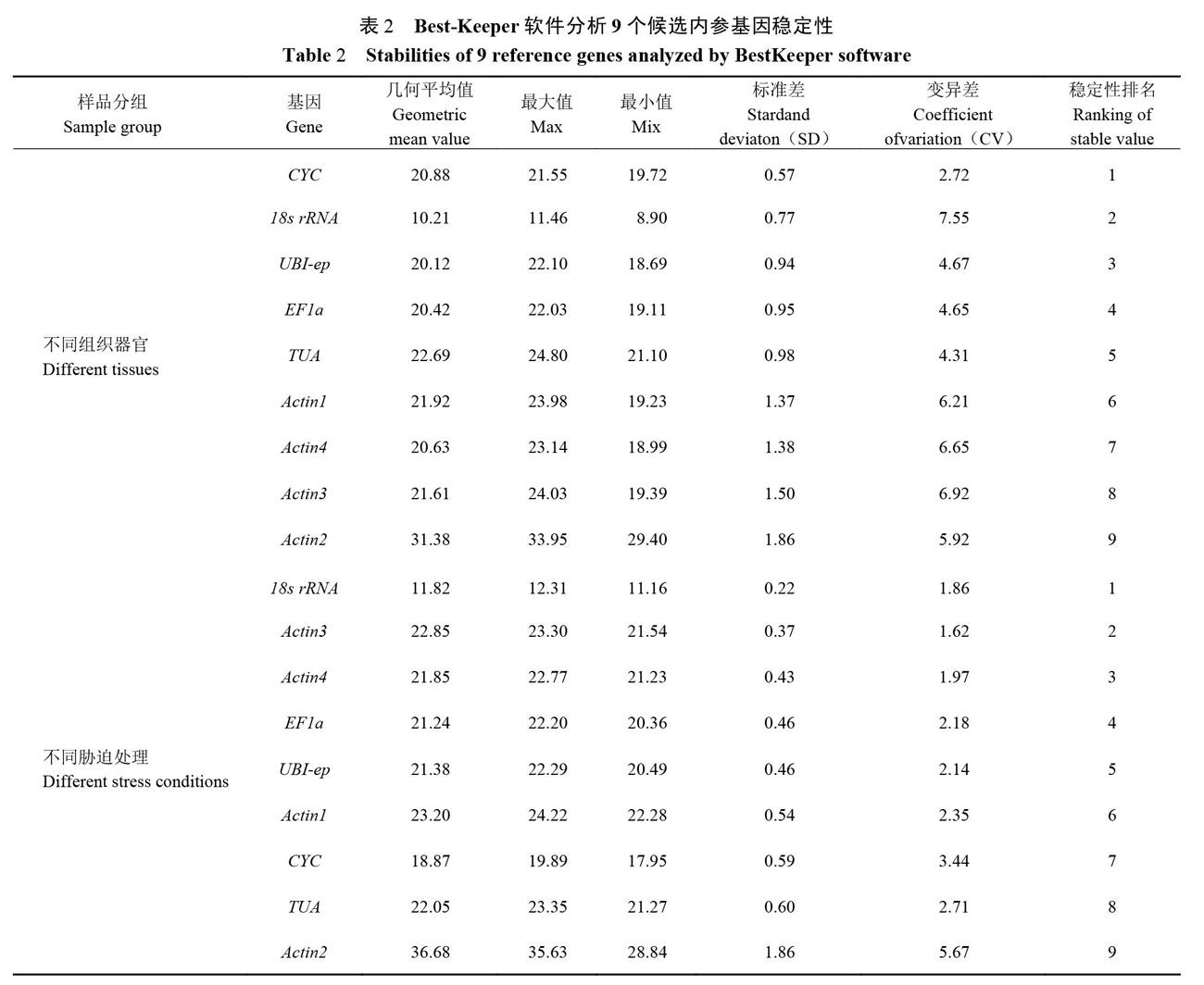
2.2.2 Best-Keeper稳定性分析 使用Best-Keeper软件分析结果如表2所示,在甜瓜不同组织器官中表达最稳定的前5个基因依次为CYC>18s rRNA>UBI-ep>EFla>TUA。CYC在不同组织器官中表达最稳定,其SD值(标准差,Stardand deviaton)为0.57;Actinl、Actin2、Actin3和Actin4的SD值均超过1,表明4个内参基因在不同组织器官中表达稳定性较低。在不同胁迫处理中表达最稳定的前5个基因依次为18s rRNA>Actin3>Actin4> EFla>UBI-ep。18srRArA在不同脅迫处理中表达最稳定,其SD值为0.22;Actin2的SD值为1.86,SD值超过1,说明Actin2在不同胁迫处理中的稳定性较差。
2.2.3 Norm Finder及ge Norm稳定性分析 在NormFinder软件分析结果(表3)中,在不同组织器官中表达最稳定的前5个基因依次为EFla>UBI-ep>Actin4>CYC>Actin3。EFla在不同组织器官中表达最稳定,M值(稳定值,Stabilityvalue)为0.107;Actin2表达最不稳定,M值为0.423。在不同胁迫处理中表达最稳定的前5个基因依次为EFla>UBI-ep>Actin4>CYC>18s rRNA,EFla在不同胁迫处理中表达最为稳定,M值为0.023;Actin2表达最不稳定,M值为0.264。
使用ge Norm分析结果如表3所示,在不同组织器官中稳定值前5名的依次为Actin4=Actin3>Actinl>EFla>UBI-ep。Actin4和Actin3的M值均为0.526。CYC、TUA和Actin2的M值大于1,这3个基因在不同组织器官中表达不稳定。不同胁迫处理中表达最稳定的依次为EFla=UBI-ep>Actin4>CYC>Actinl,EFla和UBI-ep的M值为0.138。最不稳定的基因是Actin2,M值为0.781。
2.2.4候选内参基因组合分析 基于ge Norm软件V值(配对变异值,Pairwise variation value)可计算出最适内参基因组合的数量(图4)。在甜瓜不同组织器官中V4/5=0.148,V值小于0.15,最佳基因组合数目为4个,Actin4、Actin3、Actinl和EFla可作为最佳内参基因组合。在不同胁迫处理中的V2/3=0.043,小于0.15,最佳基因组合数目为2,EFla和UBI-ep可作为最佳内参基因组合。
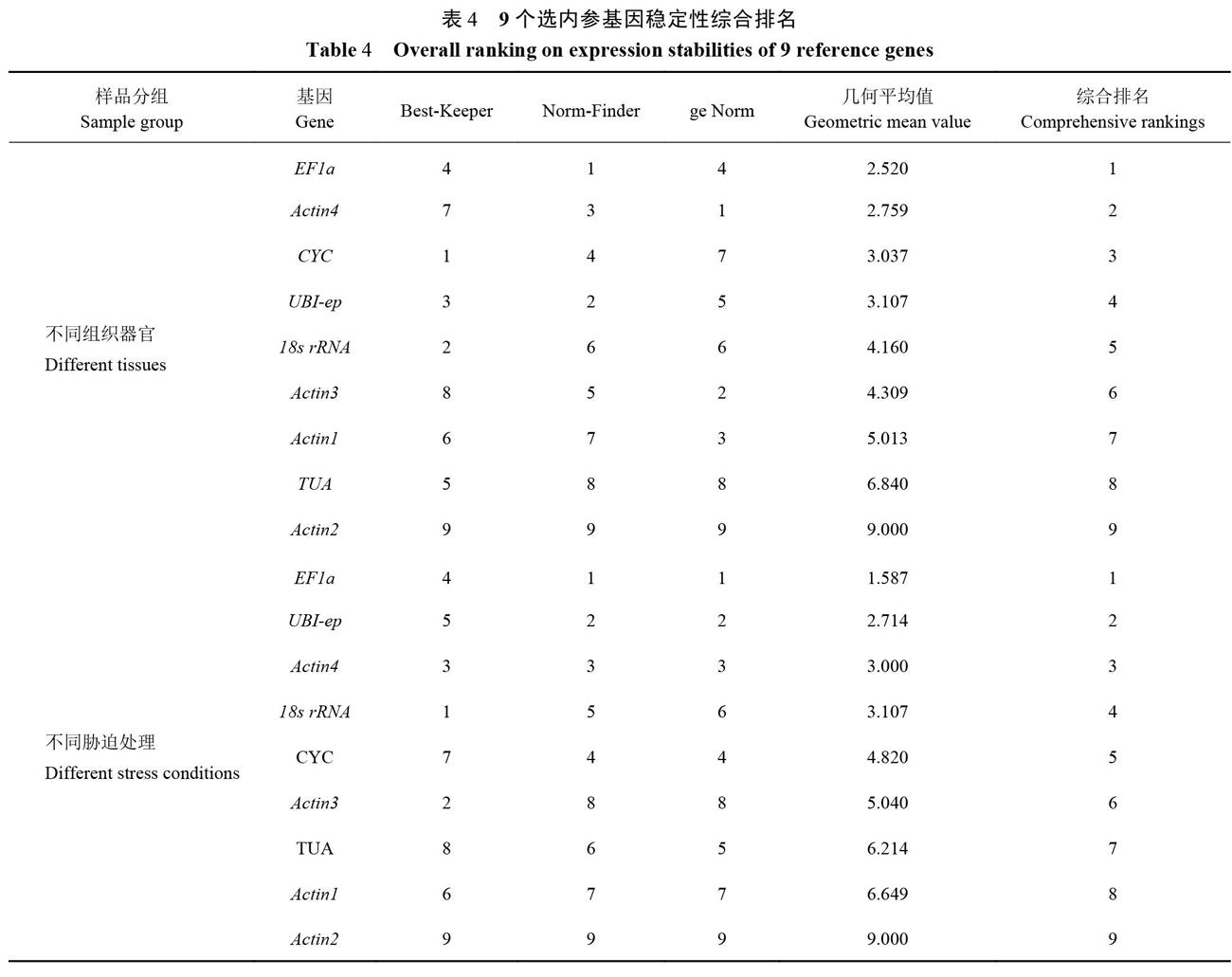
2.2.5候选内参基因表达稳定性综合排名 3款软件算法不同导致候选内参基因排名有所不同,可通过几何平均值来综合评估内参基因的稳定性。根据3款软件分析结果,确定了9个候选内参基因的综合排名(表4)。不同器官组织测试中排名前三的内参基因依次是EFla>Actin4>CYC,ge Norm软件计算出的最佳基因组合为Actin4、Actin3、Actinl和EFla。不同胁迫处理中排名前3的基因依次为EFla>UBI-ep>Actin4,ge Norm软件评估EFla和UBI-ep稳定性优于其他基因,为最佳组合基因。总体而言EFla在甜瓜不同组织器官和不同胁迫处理中均能稳定表达,可作为甜瓜RT-qPCR分析首选内参基因。
3讨论与结论
多数研究把传统管家基因直接作为内参基因,常见的如Actin(肌动蛋白基因)、EFla(转录延伸因子)、18s rRNA(18s核糖体RNA)等[17]。但内参基因的表达会因为植物不同器官组织和不同外界条件而产生差异性,在对人参[18](Panax ginseng C.A.Meyer)、蒲公英[19](Taraxacum officinaleF.H.Wigg,)、核桃[20](Juglans reiga L.)和马铃薯[3](Solanumtuberosum L.)等的相关研究中均证实了这一问题,进行相关分析前筛选出合适内参基因无疑是必要的。Best-Keeper、Norm Finder和ge Norm是公认的内参基因筛选软件。Best-Keeper分析流程简便,但分析数量仅限3~10个[14]。Norm Finder可处理组内及组间差异,但无法消除样品间误差,且每次只能给出一个最适基因,无法确定最佳内参基因组合[16]。ge Norm与Norm Finder类似,优点在于可计算最佳组合,但给出的基因组合具有相似表达谱[20]。为了筛选在甜瓜不同组织及胁迫均能稳定表达的内参基因,本研究采取3款评测软件同时对候选内参基因进行分析,并结合Excel进行综合评估,结果更具有可靠性。
本研究发现9个候选内参基因在不同部位及不同脅迫处理条件下稳定性不同。其中EFla在甜瓜盐碱胁迫、ABA处理及叶片中表达最稳定,EFla是不同甜瓜组织及胁迫处理中表达最稳定的内参基因,这与EFla在夜香树[21](Cestrum nocturnum L.)和羊草[22](Levmus chinensis Tzvel.)中的鉴定结果类似。Actin2是3款软件分析共同认为表达最不稳定的内参基因,这可能与样品种类、组织及不同胁迫有关,在蒙古冰草[23](Agropyron mongolicum Keng.)的干旱胁迫和剑麻(Agave sisalana Perr.)的水杨酸处理[24]的研究中同样发现Actin2的稳定性低,不适合选为内参基因。在试验中引入2个或2个以上内参基因可降低实验误差[25]。基于ge Norm分析发现针对甜瓜不同组织器官而言最佳内参基因组合数目是4个,同时使用Actin4、Actin3、Actin1和EFla为内参基因组合来分析目的基因在不同组织器官中的表达可提高试验准确性;但这样可能会使试验设计较为复杂,操作流程繁琐,具体分析时应适当加以选择,缩减数量。对不同胁迫而言可采用EFla和UBI-ep作为组合,可使结果更加准确和稳定,也不会产生较多试验设计冗余。
本研究综合利用Best-Keeper、Norm Finder和geNorm软件对甜瓜内参基因进行评估及筛选,3款软件分析结果存在一定差异,这与在蒲公英[19]、核桃[20]、黄山栾树[5]和刺葡萄[13]等研究中的情况类似,3款软件算法不同可能是导致这一问题的主要原因[26]。综上所述,在甜瓜不同组织器官的基因定量分析中可选EFla为内参基因,Actin4、Actin3、Actin1和EFla为内参基因组合;在不同胁迫处理研究中推荐使用EFla为内参基因,EFla和UBI-ep可作为内参基因组合。
参考文献:
[1]GINZINGER D G.Gene quantification using real-time quantitativePCR: An emerging technology hits the mainstream[J].ExperimentalHematology,2002,30(6):503-512.
[2]ZHANG Z Z,FAN J R,WU J H,et al. Alleviating effect of silicon onmelon seed germination under autotoxicity stress [J]. Ecotoxicologyand Environmental Safety,2020,188:109901.
[3]PFAFFL M W,TICHOPAD A, PRGOMET C, et al. Determination ofstable housekeeping genes, differentially regulated target genes andsample integrity: BestKeeper-Excel-based tool using pair-wisecorrelations[J].Biotechnology Letters,2004,26(6):509-515.
[4]VANDESOMPELE J, DE PRETER K,PATTYN F,et al. Accuratenormalization of real-time quantitative RT-PCR data by geometricaveraging of multiple internal control genes [J]. Genome Biology,2002,3(7):1-12.
[5]TANG x,ZHANG N,SI H J,et al. Selection and validation ofreference genes for RT-qPCR analysis in potato under abioticstress[J].Plant Methods,2017,13:85.
[6]LUO H L,LUO L P,GUAN B C,et al. Evaluation of candidatereference genes for RT-qPCR in lily (Lilium brownii) [J].The Journalof Horticultural Science and Biotechnology, 2014, 89(3):345-351.
[7]吕运舟,董筱昀,黄利斌.黄山栾树实时荧光定量PCR内参基因的筛选[J].分子植物育种,2019,17(2):553-560.
LU Y Z,DONG X Y, HUANG L B.The screening of reference genesfor real-time fluorescent quantitative PCR of Koelreuteriabipinnata[J]. Molecular Plant Breeding, 2019,17(2):553-560.(in Chinese)
[8]任銳,戴鹏辉,李萌,等.珙桐实时定量PCR内参基因的筛选及稳定性评价[J].植物生理学报,2016,52(10):1565-1575.
REN R,DAI P H,LI M,et al.Selection and stability evaluation ofreference genes for real-time quantitative PCR in dove tree (Davidiainvolucrata)[J].Plant Physiology Communications,2016,52(10):1565-1575.(in Chinese)
[9]GOPALAM R,RUPWATE S D,TUMANEY A W. Selection andvalidation of appropriate reference genes for quantitative real-timePCR analysis in Salvia hispanica [J]. PLoS One,2017,12(11):e0186978.
[10]蒋婷婷,高燕会,童再康.石蒜属植物实时荧光定量PCR内参基因的选择[J].园艺学报,2015,42(6):1129-1138.
JIANG T T,GAO Y H,TONG Z K.Selection of reference genes forquantitative real-time PCR in Lycoris [J]. Acta Horticulturae Sinica,2015,42(6):1129-1138.(in Chinese)
[11]王彦杰,董丽,张超,等.牡丹实时定量PCR分析中内参基因的选择[J].农业生物技术学报,2012,20 (5):521-528.
WANG Y J,DONG L, ZHANG C, et al. Reference gene selection forreal-time quantitative PCR normalization in tree peony (Paeoniasuffruticosa andr.) [J]. Journal of Agricultural Biotechnology, 2012,20(5): 521-528. (in Chinese)
[12]FAUSTOAK S,SILVA T D F,ROMANEL E, et al_microRNAs asreference genes for quantitative PCR in cotton[J]. PLoS One, 2017,12(4):e0174722.
[13]潘红,赖呈纯,张静,等.不同光质条件下刺葡萄红色愈伤组织的RT-qPCR内参基因筛选[J].应用与环境生物学报,2019,25(6):1407-1413.
PAN H,LAI C C,ZHANG J, et al.Selection of reference genes forRT-qPCR from the red callus of Vitis davidii (Rom. Caill.) Fo(e)xunder different light qualities [J]. Chinese Journal of Applied&Environmental Biology, 2019,25(6):1407-1413.(in Chinese)
[14]GONZALEZ-VERDEJO C I,DIE J V, NADAL S, et al. Selection ofhousekeeping genes for normalization by real-time RT-PCR: Analysisof Or-MYBl gene expression in Orobanche ramosa development [J].Analvtical Biochemistry,2008,379(2):176-181.
[15]史兴青.甜瓜生长发育和胁迫条件下实时荧光定量PCR内参基因的筛选[D].郑州:河南农业大学,2016.
SHI X Q,Selection of suitable reference genes for quantitative real-time RT-PCR studies in Cucumis melo under growth and developmentprocess, biotic and abiotic stresses[D]. Zhengzhou: Henan AgriculturalUniversity, 2016.(in Chinese).
[16]ANDERSEN C L JENSEN J L,ORNTOFT T F.Normalization ofreal-time quantitative reverse transcription-PCR data:A model-basedvariance estimation approach to identify genes suited fornomalization,applied to bladder and colon cancer data sets[J].(Cancer Research,2004,64(15):5245-5250.
[17]SUDHAKAR REDDY P,SRINIvAS REDDY D,SIvASAKTHI K,et al.Evaluation of Sorghum [Sorghum bicolor(L.)]reference genes invariOus tissues and under abiotic Stress conditiOnS for auantitative real-time PCR data nonnalization[J].Frontiers in Plant Science,2016,7:529.
[18]LI L,wANG K Y,ZHAO M Z,et al. Selection and validation ofreference genes desirable for gene expression analysis by qRT-PCR inMeJA-treated ginseng hairy roots[J]. PLoS One,2019,14(12):e0226168.
[19]乔永刚,王勇飞,曹亚萍,等.药用蒲公英低温和高温胁迫下内参基因筛选与相关基因表达分析[J].园艺学报,2020,47(6):1153-1164.
QIAO Y G,WANG Y F,CAO Y P,et al. Reference genes selectionand related genes expressiOn analysis under low and high temperaturestress in Taraxacum officinale[J]. Acta Horticulturae Sinica,2020,47(6):1153-1164.(in Chinese)
[20]宋晓波,常英英,刘吴,等,核桃不定根发生阶段内参基因筛选与关键基因表达分析[J].园艺学报,2019,46(10):1907-1918.
SONG X B,CHANG Y Y,LIU H,et al.Reference gene SeleCtion andgenes expression analysis during adventitious root formation inwalnut[J].Acta Horticulturae Sinica,2019,46(10):1907-1918.(in Chinese)
[21]劉涛,熊青,许颖妍,等.夜香树花期荧光定量PCR内参基因的筛选[J].植物科学学报,2017,35(4):534-542.
LIU T,XIONG Q,XU Y Y,et al.Selection of reference genes forqRT-PCR normalization in Cestru nocturnum during floweing[J].Plant Science Journal,2017.35(4):534-542.(inChinese)
[22]胡宁宁,郭慧琴,李西良,等.羊草不同组织实时定量PCR内参基因的筛选[J].草业科学,2017,34(7):1434-l441.
HU N N,GUO H Q,LI X L,et al.Selection of reference genes forquantitative real-time PCR of Leymus chinensisi in
in differenttissues[J].Pratacultural Science,2017,34(7):1434-1441.(inChinese)
[23]黄文华.蒙古冰草干旱胁迫下内参基因的筛选及P5CS基因定量表达分析[D].呼和浩特:内蒙古农业大学,2014.
HUANG W H. SeleCtion Of control gene in quantitative PCR andanalysis of differential expression of P5CS gene in Agropyronmongolicum Keng under drought stress[D].Hohhot:Inner MongoliaAgricultural University,2014.(in Chinese).
[24]张燕梅,王瑞芳,杨子平,等.剑麻内参基因筛选与稳定表达分析[J].热带作物学报,2019,40(11):2166-2173.
ZHANG Y M,WANG R F,YANG Z P,et al.Screening of suitablereference genes for qRT-PCR normalization in sisal[J].ChineseJournal of Tropical Crops,2019,40(11):2166-2173.(inChinese)
[25]XIAO Z,SUN X B,LIU X Q,et al.Selection of reliable referencegenes for gene expression studies on Rhododendron molle G.don[J].Frontiers in Plant Science,2016,7:1547.
[26]HU R,QI G,KONG Y,et al. Comprehensive analysis of NAC domaintranscription factor gene family in Populus trichocarpa[J]. BMCPlant Biology,2010,10(1):145-158.
(責任编辑:张梅)
收稿日期:2020-07-29初稿;2020-10-04修改稿
作者简介:章丽珍(1994-),女,硕上研究生,研究方向:农艺与种业(E-mail: 651260775@qq.com)
*通信作者:张志忠(1976-),男,博上,副教授,研究方向:园艺植物逆境生理和生物技术(E-mail:zeada2001@l63.com)
基金项目:福建省闽江学者科研基金(116-114120019);福建农林大学创新专项基金(CXZX2016108、CXZX2017168)
