多头切花菊瓶内开花技术的研究
2020-02-22左李娜王容刘丹吴海峰陈天烺陈炜方萍赵鹏霞
左李娜 王容 刘丹 吴海峰 陈天烺 陈炜 方萍 赵鹏霞
摘要:分别以多头切花菊纯心的花瓣、花头、带芽茎段为外植体,探究高效的多头切花菊不定芽诱导方法以及不同培养基及激素浓度和不同光照时间对多头切花菊瓶内开花的影响。结果表明,以花头为外植体诱导不定芽的增殖系数最高,增殖系数达18.77,最佳诱导培养基为MS+1.5 mg/L 6-BA+0.1 mg/L NAA+30 g/L蔗糖;瓶内开花最佳培养基为改良MS+0.05 mg/L 6-BA+0.4 mg/L PP333+300 g/L蛭石+50 g/L蔗糖,开花率达76.5%;光照时间为 8 h/d 时,菊花的开花率极显著高于其他处理组,达63.9%。
关键词:多头切花菊;瓶内开花;增殖系数;开花率
中图分类号: S682.1+10.4 文献标志码: A 文章編号:1002-1302(2020)23-0146-04
菊花是菊科(Compositae)菊属(Chrysanthemum L.)多年生草本花卉,是我国传统四大名花之一,也是世界四大切花之一。切花菊按整枝方式不同有标准切花菊与多头切花菊,其中多头切花菊每茎着花多朵[1]。多头切花菊因其花色鲜艳丰富、花形多变、叶色浓郁、花茎通直挺拔、姿态优美,深受国人的喜爱和推崇,广泛用作切花、盆花以及庭院绿化[2]。20世纪80年代初,多花型切花走向国际市场,作为世界最流行的切花之一,菊花正以花型趋向小型多头、花形多样、花色缤纷、花姿优美,符合世界切花潮流而风靡国内外。多头切花菊因其花型优美、颜色醒目、瓶插寿命长而具有较高的观赏价值[3]。瓶内开花可以让人们在任意季节,特别是非开花季节观赏到植物花的开放,具有微小便携的特点,具有独特的观赏价值[4]。自从1946年,罗士韦首次报道田野菟丝子在试管中开花以来,据统计现约有30多个科、100多种植物能够进行瓶内开花[5-6]。目前可以做成试管花卉的植物有石斛兰、短叶芦荟、美丽十二卷、鸡冠花、玫瑰、红莲、凤梨、大花蕙兰、狼牙掌、燕尾芦荟、非洲紫罗兰、金线莲、迎春、六月雪、红叶李、无刺火棘、紫薇、情人草、康乃馨、幸运草、草莓、非洲菊、文心兰等[7]。而关于多头切花菊瓶内开花的研究至今未见有报道。因此,研究多头切花菊的瓶内开花具有重要的理论和现实意义。
1 材料与方法
1.1 材料
于2018年12月20日在浙江省绍兴市柯桥区平水镇浙江海丰花卉有限公司种植基地采取花头直径约为3 cm且开放度为4度的粉色多头菊纯心10株,带回实验室备用。
1.2 方法
1.2.1 外植体消毒 分别选用纯心的花头、花瓣和带腋芽的1~2 cm的茎段(剪去茎段上的花梗和叶片)作为外植体。每个外植体先在洗洁精水中浸泡10 min,取出用自来水流水冲洗1 min左右;然后将外植体在多菌灵1 000倍液中浸泡30 min,取出用自来水流水冲洗1 min左右;于超净工作台上再将外植体在75%乙醇溶液中浸泡30 s,取出用无菌水冲洗2次;最后将外植体在有效氯为5%的次氯酸钠溶液中浸泡7~8 min,取出用无菌水冲洗6次,每次冲洗1 min,得到消毒灭菌后的外植体。
1.2.2 初代培养 将消毒后的不同外植体为材料进行不定芽诱导培养,具体步骤为将经消毒灭菌后的花头、花瓣和带芽茎段接触药品的部位切除,分别接种于含有不定芽诱导培养基的组培瓶中进行培养,每个组培瓶接种1个外植体,每种外植体接种30个。不定芽诱导培养基由MS培养基、6-BA、NAA、蔗糖和琼脂组成。其中,6-BA的浓度为 1.5 mg/L,NAA浓度为0.1 mg/L,蔗糖的浓度为 30 g/L,琼脂的浓度为5 g/L,不定芽诱导培养基pH值6.0。
培养条件:培养温度为(22±2) ℃,光照度为 2 000 lx,光照时间为14 h/d。培养7 d后开始观察生长情况,20 d后统计增殖系数,增殖系数= 增殖数 / 接种数。
1.2.3 增殖培养 以花头作为外植体初代培养 30 d 后,外植体花头底部长出1 cm左右的不定芽。待不定芽长至5~6 cm时,再切成长约为2 cm且带有1~3个叶芽的茎段,并接种于含有增殖培养基MS+0.5 mg/L 6-BA+0.5 g/L AC+30 g/L蔗糖的组培瓶中进行培养,每个组培瓶接种7个茎段,pH值6.0。
1.2.4 开花预培养 待增殖培养至得到不定芽长为5~6 cm的菊花小苗时,将菊花小苗切成长约为2 cm且带有1~3个叶芽的茎段,接种于含有开花预培养基的组培瓶中进行培养(图1-A),每个组培瓶接种7个茎段。培养条件如下:培养温度为(25±2) ℃,光照度为2 000 lx,光照时间为 8 h/d。
开花预培养基由MS培养基、6-BA、蛭石、琼脂和蔗糖组成。其中,6-BA浓度为0.5 mg/L,蔗糖浓度为30 g/L,琼脂浓度为5 g/L,蛭石在开花预培养基中的浓度为300 g/L,pH值6.0。
1.2.5 开花培养
1.2.5.1 不同培养基及激素浓度对多头菊瓶内开花的影响 将开花预培养50 d后的菊花苗,切成 2 cm 左右且带有1~3个叶芽的茎段,分别接种于含有不同开花培养基的组培瓶中进行培养,每个组培瓶接种7个茎段。培养条件如下:培养温度为(25±2) ℃,光照度为2 000 lx,光照时间为8 h/d。
采用三因素随机区组试验设计开花培养基,基本培养基分别设置为改良MS培养基和MS培养基;6-BA浓度为0.05 mg/L;PP333浓度分别设置为0、0.1、0.2、0.3、0.4 mg/L;蔗糖浓度为50 g/L;琼脂浓度为5 g/L。不同开花培养基的pH值均为6.0。开花培养15 d后开始观察瓶苗的生长状况,统计菊花苗开花数、开花率、平均株高及生长情况,开花率=开花的株数 / 接种的总的带芽茎段数×100%。
1.2.5.2 不同光照时间对多头菊开花的影响 将开花预培养50 d后的菊花苗,切成2 cm左右且带有1~3个腋芽的茎段,接种于含有开花培养基的组培瓶中进行培养,每个组培瓶接种7个茎段。培养条件如下:培养温度为(25±2) ℃,光照度为 2 000 lx,光照时间分别设置为8、10、12 h/d。开花培养15 d后开始观察瓶苗的生长状况,统计开花数和开花率。
2 结果与分析
2.1 初代培养
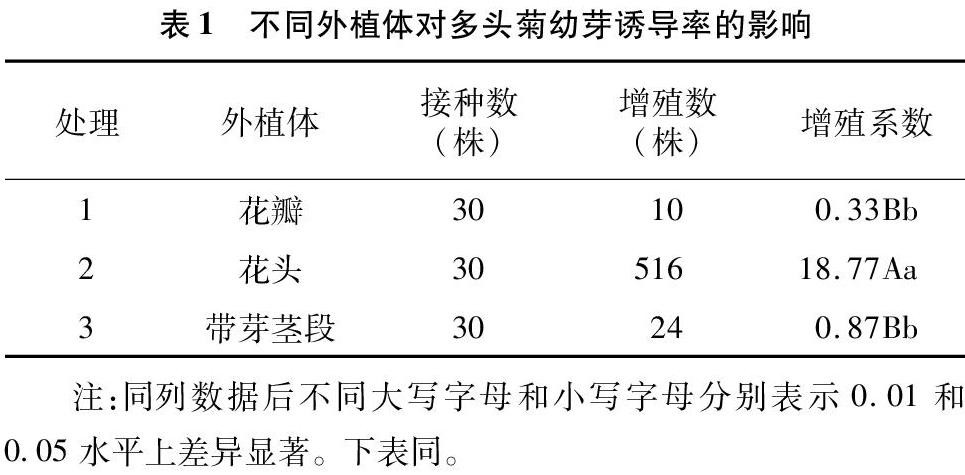
从表1中看出,不同外植体诱导不定芽的效果差异显著,以花头为外植体诱导不定芽的增殖系数最高,极显著高于其他处理,达18.77;因此,花头是诱导多头菊不定芽的最佳外植体。
2.2 开花培养
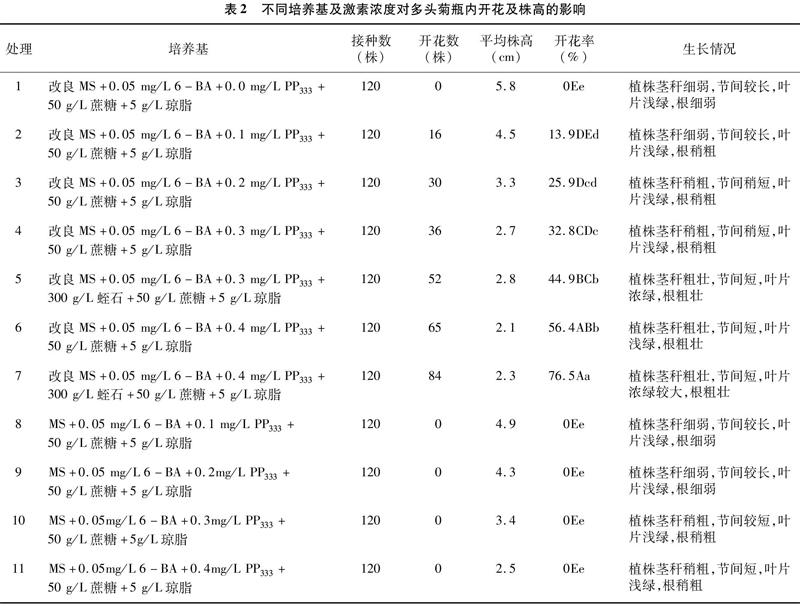
2.2.1 不同培养基及激素浓度对多头菊瓶内开花的影响 从表2中看出,不同培养基及激素浓度配比对多头菊开花的效果差异显著。处理7(开花培养基:改良MS+0.05 mg/L 6-BA+0.4 mg/L PP333+300 g/L蛭石+50 g/L蔗糖+5 g/L琼脂)的开花率显著高于其他处理组,达76.5%,平均株高为2.3 cm,植株莖秆粗壮,节间短,叶片浓绿较大,根粗壮。其中,处理2、处理3、处理4、处理6与处理8、处理9、处理10、处理11相比,开花率显著提高,没有经过改良的MS开花株数为0,说明改良MS对诱导开花起着关键性的作用。处理1至处理6,随着PP333浓度的增加,株高越来越矮,开花率越来越高,说明PP333的浓度对菊花的开花起着促进作用。处理5与处理4、处理7与处理6相比,开花率显著提高,植株的生长状态也更好(植株茎秆粗壮、节间短、叶片浓绿),说明蛭石对菊花的开花和生长状况有着促进作用。因此,开花培养基改良MS+0.05 mg/L 6-BA+0.4 mg/L PP333+300 g/L蛭石+50 g/L 蔗糖+5 g/L琼脂是诱导多头菊开花的最佳培养基。
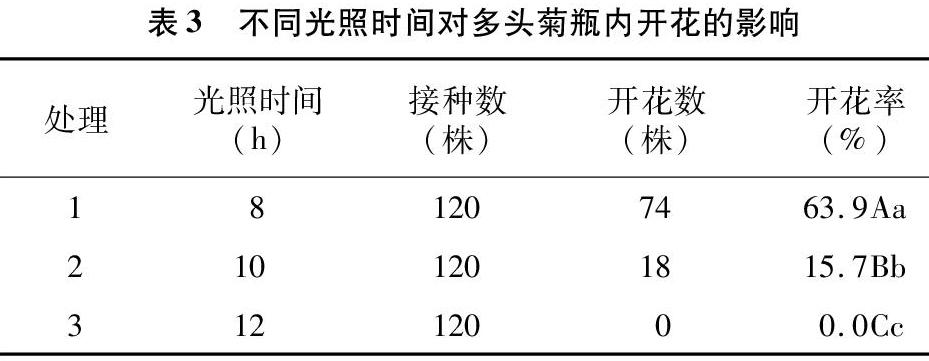
2.2.2 不同光照时间对多头菊开花的影响 从表3中看出,不同光照时间对多头菊开花的影响效果差异显著。处理1, 即当其他培养条件一致,光照时间为8 h/d时,菊花的开花率极显著高于其他处理组,达63.9%,随后随着光照时间的延长,开花率越来越低,甚至不开花,说明光照时间的长短对开花率的高低具有重要的影响作用。因此,光照时间8 h/d 是诱导菊花开花的最佳时间。在光照时间 8 h/d 条件下,开花培养20 d后,小苗高度达4 cm左右,于株顶出现花蕾(图1-C),花蕾直径约为 2 mm;开花培养40 d,花苞膨大至开花。
3 结论与讨论
本研究分别以多头切花菊纯心的花头、花瓣、茎段为外植体,探究高效的不定芽诱导方法,结果表明以花头为外植体诱导不定芽的增殖系数最高,达18.77,明显高于张天静等[8]以茎段和李晓亮等[9]以茎尖为外植体诱导成苗的增殖效率,且在整个芽诱导期,外植体不经过愈伤组织直接分化成苗,历时短且效率高。在多头切花菊的增殖阶段,在MS基本培养基的基础上添加 0.5 mg/L 6-BA和0.5 g/L活性炭,增殖阶段无菌苗叶片大且浓绿,植株整体生长健壮。
在开花培养前对瓶苗进行开花预培养,开花预培养基在增殖培养基的基础上添加300 g/L的蛭石,培养效果较好。在菊花的种植过程中,为了使菊花正常生长,种植基质应具备排水性、透气性好,富含有机质,肥沃,保水性强,对肥料的吸附力佳等特点[10-11]。本试验在开花预培养基中加入蛭石,提高培养基的透水透气性外,在一定程度上可以为无菌苗的生长提供有机质,尽可能模拟菊花田间的生长环境,从而达到开花的效果。
在多头切花菊的开花培养中,本试验主要研究不同培养基及激素浓度对多头菊瓶内开花的影响,研究结果显示在MS基本培养基的基础上,适当降低氮元素的含量,增加钾元素的含量有利于多头切花菊的花芽形成,这个结果与陈肖英等的研究结果[4,12-13]基本保持一致,而在氮磷钾的配比上稍有不同,这可能是由于植物种类不同所导致。在改良MS培养基的基础上添加 0.05 mg/L 6-BA和 0.4 mg/L PP333有利于多头切花菊的瓶内开花,低浓度的PP333菊花植株茎秆细弱,节间较长,叶片浅绿,根细弱,开花率低;随着PP333浓度的升高,无菌苗的主茎变矮且粗壮,节间变短,叶片浓绿较大,根粗壮,开花率增大;当PP333浓度达到0.4 mg/L时,开花率最高,达76.5%;这说明多头切花菊营养生长达到一定程度后才进行生殖生长,多效唑抑制了无菌苗的营养生长,从而促进了生殖生长,进而提高了开花率[14]。除此之外,本试验还研究不同光照时间对多头切花菊开花的影响。菊花是短日照植物,对光周期非常敏感,能否开花取决于光周期[15],而在实际生产中也通常通过补光和遮光的方法来调控多头切花菊的开花时间。本研究结果显示,当其他培养条件一致,光照时间8 h/d条件下,开花培养20 d后,于株顶出现花蕾,这说明多头切花菊的开花必须经过一定时间的黑夜积累,而且一定时间的短日照处理使得多头切花菊体内的激素水平发生变化,但这并不会使菊花立即出现花芽分化,而是经过 15~20 d的诱导期,经过这个诱导期,菊花才能由营养生长开始转变为生殖生长阶段[15]。
最后,本试验发现,稍高浓度的蔗糖对多头切花菊的瓶内开花具有一定的促进作用,这与周俊辉等的研究结果[4]一致。在植物组织培养中,蔗糖的作用主要是提供碳源和能源,植物的生殖生长是一个耗能的过程,蔗糖浓度的增加使植株获得了足够的能源[16],从而为多头切花菊的开花提供了必要的条件。
参考文献:
[1]包满珠. 花卉学[M]. 2版. 北京:中国农业出版社,2003:214-215.
[2]洪 波,史春凤,张晓娇等. 菊花观赏性状和农艺性状基因工程改良研究进展[J]. 中国农业科学,2009,42(4):1348-1358.
[3]刘 鹏,刘 金,赵艳红等. 菊花的组织培养、脱毒与快繁技术研究[J]. 内蒙古民族大学学报(自然科学版),2005,20(4):410-413.
[4]周俊辉,杨寅桂,刘义存等. 微型月季的试管开花诱导研究[J]. 江西农业大学学报,2008,30(3):504-508.
[5]陈永宁.试管开花植物名录(初编)[J]. 植物生理学通讯,1990(3):71-76.
[6]陈永宁.试管开花植物名录(续编)[J]. 植物生理学通讯,1995,31(4):318-320.
[7]郜旭芳.勋章菊的组培快繁及试管开花研究[D]. 河南:河南科技大学,2012.
[8]张天静,雷家军,孙文松.菊花品种神马的茎段离体快繁研究[J]. 黑龙江农业科学,2014(12):19-22.
[9]李晓亮,张军云,张钟等. 盆栽菊花的茎尖组织培养快繁技术[J]. 江苏农业科学,2018,46(24):57-62.
[10]高 飞.中日菊花栽培常用基质[J]. 现代园艺,2014,(5):35,42.
[11]范如芹,罗 佳,张振华. 复合调理剂对栽培基质性能及蔬菜生长的影响[J]. 江苏农业学报,2018,34(4):887-896.
[12]陈肖英.霍山石斛试管开花研究[D]. 广东:华南师范大学,2003.
[13]王再花,涂红艳,叶庆生.细茎石斛的快速繁殖和试管开花诱导[J]. 植物生理学通讯,2006(6):145-146.
[14]孙婵娟.万寿菊的快速繁殖及试管开花研究[D]. 重庆:西南大学,2009.
[15]林贵玉,郑成淑,孙宪芝等. 光周期对菊花花芽分化和内源激素的影响[J]. 山东农业科学,2008(1):35-39.
[16]梁红艳,王小国.菊花的离体快繁与试管开花技术研究[J]. 林业实用技术,2012(7):53-55.张 顾,任义方,肖良文,等. 气象因素对江苏地区荷斯坦奶牛产奶量的影响及产奶量预测研究[J]. 江苏农业科学,2020,48(23):150-154.
