素馨属植物ISSR-PCR反应体系的建立和优化
2020-02-22荆玲侠卜朝阳崔学强狄清琳卢家仕
荆玲侠 卜朝阳 崔学强 狄清琳 卢家仕
摘要:为了确定素馨属植物ISSR-PCR反应的最佳体系,以素馨属植物叶片为材料,采用单因素试验和正交试验设计2种方法对影响素馨属ISSR-PCR反应中的dNTPs 、Taq DNA聚合酶、引物、模板 DNA以及Mg2+ 5个因素进行4个水平的优化试验,通过试验建立了素馨属25 μL最佳反应体系:dNTPs浓度为0.10 mmol/L、Taq DNA聚合酶用量2.5 U、引物浓度为0.7 μmol/L、模板 DNA用量为2.5 ng、Mg2+浓度为1.0 mmol/L。在最佳反应体系下,从100条ISSR引物中筛选出了8条ISSR引物,并确定了各引物的最佳退火温度。利用29份素馨属材料进行最佳反应体系的验证,结果表明,该优化体系扩增条带清晰,稳定性高,重复性好,表明该反应体系适用于素馨属植物ISSR分子标记的研究。本研究可为素馨属植物遗传多样性以及亲缘关系等方面的研究提供参考依据。
关键词:素馨属;ISSR-PCR;单因素试验;正交设计
中图分类号: S684.01;S188 文献标志码: A 文章编号:1002-1302(2020)23-0071-08
素馨属(Jasminum)隶属于木樨科(Oleaceae)素馨亚科(Jasminoideae),该属植物枝叶繁茂,花形优美,且多具芳香性,不乏观赏价值较高的植物[1]。目前,素馨属在我国有47种、1个亚种、4个变种,该属植物主要包括多种素馨、毛茉莉和茉莉花[2-3]。
目前,有关素馨属植物分子方面的研究仍然比较欠缺。刘忠等利用TRAP技术对采自广西周边地区的28份茉莉种质资源进行了遗传多样性研究,并利用聚类分析将这28份茉莉材料聚为5个类群[4]。邱长玉等从100个ISSR随机引物中筛选出10个多态性引物对广西横县境内的30份茉莉花材料进行了研究[5]。此外,陈笛等利用RT-PCR和RACE技术对茉莉花萜类香气物质合成途径中的关键酶进行扩增,以研究其在茉莉花开放过程中的表达情况[6-7]。胥爱丽等对扭肚藤进行了UPLC指纹图谱的建立[8]。总体来说,素馨属植物在分子方面的研究还不够深入。
ISSR 标记技术结合了SSR和RAPD 2种标记技术的优点,但其最关键的步骤是要针对不同的物种建立相应的PCR反应体系[9]。目前,ISSR分子标记已被广泛应用于郁金香[10]以及荷花[11]等观赏性园艺植物的品种鉴定以及遗传多样性分析中。ISSR技术是基于PCR的一种分子标记技术,其扩增结果易受dNTPs浓度、Taq DNA聚合酶用量、引物浓度、模板DNA浓度等因子的影响[12]。本研究通过单因素试验和正交试验设计的方法来优化 ISSR-PCR 反应中的各项因子,建立适用于素馨属ISSR-PCR的最佳反应体系,为进一步开展素馨属植物的亲缘关系和遗传多样性分析等方面的研究提供理论参考。
1 材料与方法
1.1 试验材料
供试素馨属材料采自广西农业科学院花卉研究所资源圃。8条扩增条带清晰、多态性好的引物均来自于哥伦比亚大学(University of British Columbia, UBC)公布的100条ISSR通用引物。这8条引物分别为807(AGAGAGAGAGAGAGAGT)、811(DAGAGAGAGAGAGAGAC)、822(TCTCTCTCTCTCTCTCA)、834(AGAGAGAGAGAGAGAGYT)、835(AGAGAGAGAGAGAGAGYC)、841(GAGAGAGAGAGAGAGAYC)、873(GACAGACAGACAGACAGACA)、881(GGGTGGGGTGGGGTG),均用于后续PCR反应体系的构建。本研究所用引物由上海生物工程股份有限公司合成,所用试剂dNTPs、Taq DNA聚合酶、Mg2+、Marker等均采自东盛生物科技有限公司,其他药品均为国产分析纯。
1.2 试验方法
1.2.1 供试材料DNA 提取与检测 以供试材料的叶片为材料,使用天根植物快速DNA提取试剂盒法,对供试材料的叶片进行DNA提取。DNA提取后用1.00%琼脂糖凝胶电泳和紫外分光光度计检测提取的DNA质量,后置于-20 ℃冰箱中保存备用。
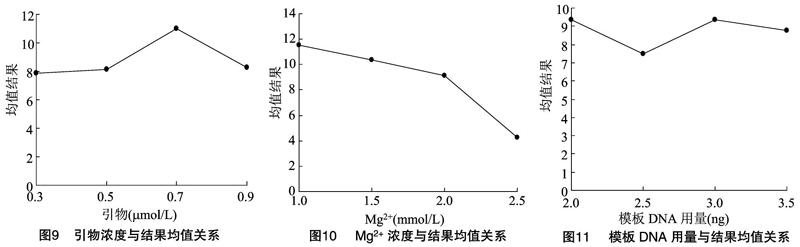
1.2.2 ISSR-PCR反应体系单因素筛选试验 对ISSR-PCR反应体系中的dNTPs浓度、Taq DNA聚合酶用量、引物浓度、模板DNA用量以及Mg2+ 浓度5个因素进行试验。在单因素试验中,在对某一因素进行梯度优化时,保持其他4个因素不变。20个处理(表1)的PCR反应体系的总体积均为25 μL,每个处理重复2次。PCR扩增程序:94 ℃ 4 min;94 ℃ 4 min,54 ℃ 45 s,72 ℃ 2 min,共计35个循环; 最后 72 ℃ 10 min。 PCR 产物进行琼脂糖凝胶电泳检测。
1.2.3 ISSR-PCR反应体系正交试验设计 在单因素试验的基础上,对影响ISSR-PCR反应体系的dNTPs浓度、Taq DNA聚合酶用量、引物浓度、模板DNA用量以及Mg2+ 浓度進行进一步的细化处理。针对上述因素采用5因素4水平L16(45)的正交试验设计(表2、表3)。试验按照表3中的16个处理水平进行试验,各个处理水平PCR反应体系的总体积均为25 μL,每个处理水平重复2次。PCR扩增程序:94 ℃ 4 min;94 ℃ 4 min,54 ℃ 45 s,72 ℃ 2 min,共35个循环;最后72 ℃ 10 min。PCR产物进行琼脂糖凝胶电泳检测。
1.2.4 引物及其退火温度的筛选 本研究在已确定的最佳素馨属ISSR-PCR反应体系的基础上,对引物退火温度进行筛选,以各引物的Tm值为中间温度,使用温度梯度PCR仪自动形成的12个温度梯度来筛选不同引物的最佳退火温度。
1.2.5 ISSR-PCR最佳体系的验证 ISSR-PCR 反应体系及扩增程序的优化结果应经过不同供试材料的反复验证以确定该扩增体系的可重复性。
2 结果与分析
2.1 单因素试验优化结果
2.1.1 dNTPs浓度对ISSR-PCR扩增体系的影响 根据需求本研究设置了4个dNTPs浓度梯度,分别为0.10、0.15、0.20、0.25 mmol/L,每个浓度梯度重复试验2次,具体扩增结果见图1。从图1可以看出,在dNTPs浓度为0.10~0.15 mmol/L时,扩增条带基本一致且清晰,并可以看出,在浓度为 0.10 mmol/L 时,扩增条带最亮最清晰。在dNTPs浓度为0.20~0.25 mmol/L时,扩增条带较暗且不完全。因此,在本研究ISSR-PCR扩增体系单因素筛选中dNTPs的最适浓度为0.10 mmol/L。
2.1.2 Taq DNA聚合酶用量对ISSR-PCR扩增体系的影响 根据需求本研究设置了4个Taq DNA聚合酶用量梯度,分别为1.0、1.5、2.0、2.5 U,每个用量梯度重复2次,具体扩增结果见图2。其中,在Taq DNA聚合酶的用量为1.0 U时,没有扩增产物的产生。在Taq DNA聚合酶的用量为 1.5 U 时,扩增条带较暗且不完全。在Taq DNA聚合酶的用量为2.0~2.5 U时,扩增条带清晰且基本一致,扩增产物间没有明显差异。基于成本考虑,本研究ISSR-PCR扩增体系单因素筛选中Taq DNA聚合酶的最适用量为2.0 U。
2.1.3 引物浓度对ISSR-PCR扩增体系的影响 根据需求本研究设置了4个引物浓度梯度,分别为0.2、0.4、0.6、0.8 μmol/L,每个浓度梯度重复2次,具体扩增结果见图3。从图3可以看出,当引物浓度为0.2 μmol/L时,扩增条带较暗且不完全。随着引物浓度的增加,扩增条带逐渐清晰,在引物浓度为0.8 μmol/L时,扩增条带最为清晰。因此,本研究ISSR-PCR扩增体系单因素筛选中引物的最适浓度为0.8 μmol/L。
2.1.4 模板DNA用量对ISSR-PCR扩增体系的影响 根据需求本研究设置了4个用量梯度,分别为2.0、2.5、3.0、3.5 ng,每个用量梯度重复2次,具体扩增结果见图4。从图4可以看出,当模板DNA用量在2.0~3.0 ng之间时,扩增条带间没有明显差异。当模板DNA浓度为 3.5 ng 时,产生了非特异性扩增条带。因此,本研究ISSR-PCR扩增体系单因素筛选中模板DNA用量的最适范围为2.0~3.0 ng。
2.1.5 Mg2+浓度对ISSR-PCR扩增体系的影响 根据需求本研究设置了4个浓度梯度,分别为0.9、1.2、1.5、1.8 mmol/L,每个浓度梯度重复2次,具体扩增结果见图5。从图5可以看出,当Mg2+浓度在0.9~1.2 mmol/L之间时,扩增条带较暗且数量比较少。当Mg2+ 浓度为1.5 mmol/L时,扩增条带比较清晰。当Mg2+浓度为1.8 mmol/L时,非特异性扩增数量增加。因此,本研究ISSR-PCR扩增体系单因素筛选中Mg2+ 浓度的最适浓度为1.5 mmol/L。
2.2 正交试验设计琼脂糖凝胶电泳结果
根据表3的16个处理组合,每个处理组合重复试验2次,具体扩增结果见图6。从图6可以看出,16个正交处理组合中的第8个处理组合为最佳处理组合。该处理组合比其他处理组合扩增条带更加清晰,扩增数量也更加丰富。因此本研究中 25 μL 最佳素馨属植物基因组ISSR-PCR扩增体系为dNTPs浓度0.10 mmol/L、Taq DNA聚合酶用量2.5 U、引物浓度0.7 μmol/L、模板DNA用量2.5 ng、Mg2+ 浓度1.0 mmol/L。
2.3 正交试验设计琼脂糖凝胶电泳结果图直观评分
根据图6的电泳结果,根据扩增条带的数量、强弱和清晰度采用直观评分的方式对16个正交设计处理水平的电泳结果从高到低进行打分,条带数量丰富、亮度和清晰度高的处理记为16分,相反,最差的记为1分[13]。针对16个正交处理水平的2次重复试验的结果进行统计评分,评分的结果分别为9、10、15、7、3、9、14、15、7、10、2、9、4、6、12、11;10、9、15、6、3、10、13、16、8、9、1、8、3、6、11、11。
利用SPSS 22.0数据分析软件对16个正交处理水平的2次重复结果的评分进行方差分析(表4)。从表4中可以看出,各因素水平的影响均达到了极显著水平,且从大到小依次为Mg2+浓度>Taq DNA 聚合酶用量>dNTPs浓度>引物浓度>模板DNA用量。
2.4 正交设计试验因素内各处理水平对PCR扩增结果的影响
由于各因素水平间的差异均达到了极显著水平,所以需要进一步对各因素内不同处理水平作多重比较分析。
2.4.1 dNTPs浓度对PCR扩增体系的影响 对dNTPs各处理水平梯度的多重比较分析结果表明,各处理水平梯度间均差异不显著。从图7可以看出,随着dNTPs浓度的增加,结果均值呈现先增大后降低再增大的趋势。当dNTPs浓度在0.05~0.10 mmol/L时,反应结果均值随着dNTPs浓度的增加而增大,在0.10 mmol/L时,达最大值;当dNTPs浓度继续增加时,结果均值逐渐降低,在0.15 mmol/L时最小;随着dNTPs浓度继续的增加,结果均值继续增大。因此,在25 μL反应体系中选择0.10 mmol/L水平作为该研究PCR反应体系中dNTPs的最佳浓度。
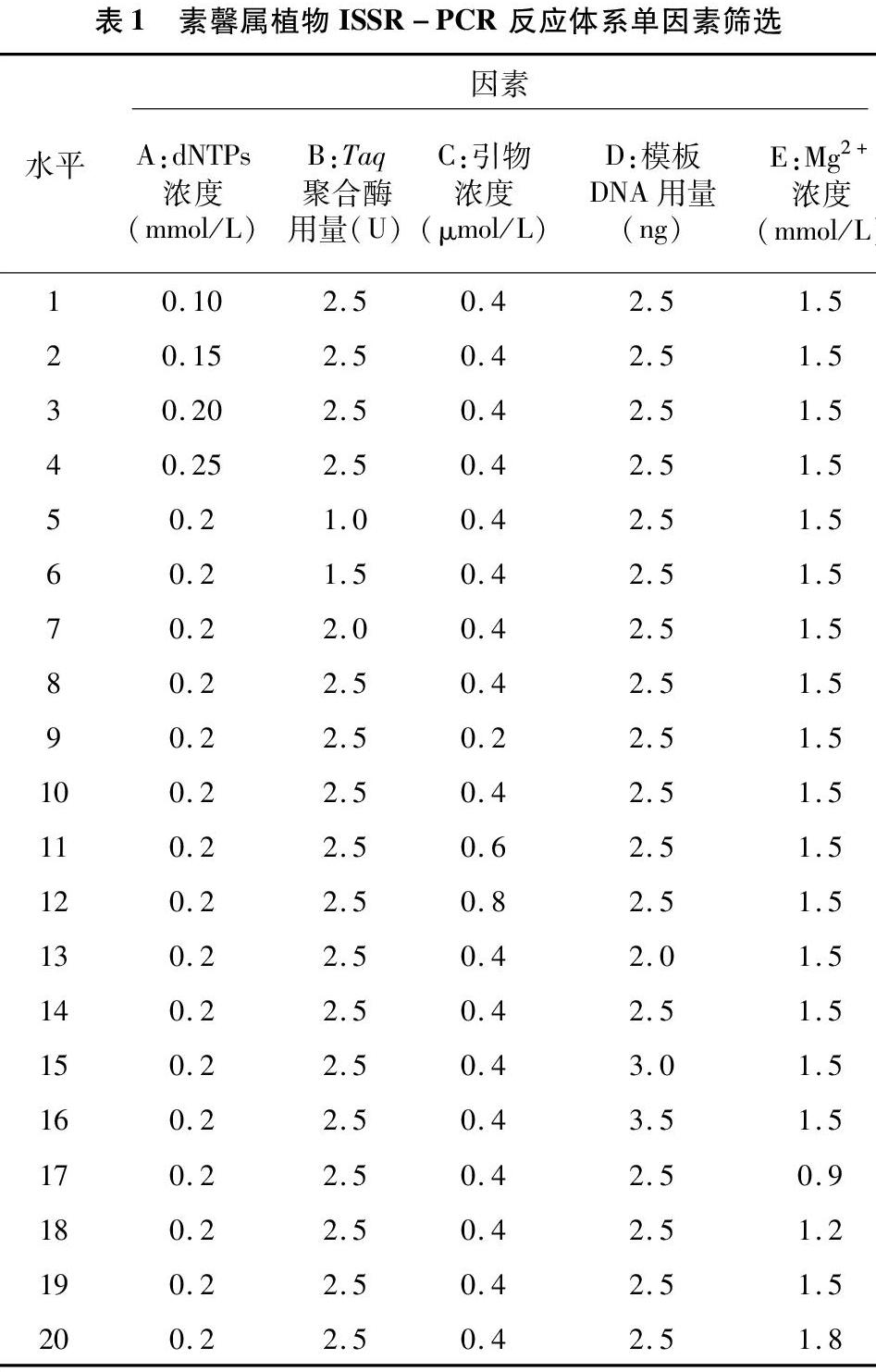
2.4.2 Taq DNA聚合酶用量對PCR扩增体系的影响 对Taq DNA聚合酶用量各处理水平梯度的多重比较分析结果表明,Taq DNA聚合酶用量梯度1.0 U与2.0 U和2.5 U之间差异显著,P值均达到0.024,其他各处理水平梯度间差异不显著。从图8可以看出,随着Taq DNA聚合酶用量的增加,结果均值呈现先增大后降低再增大的趋势。当Taq DNA聚合酶用量在1.0~1.5 U时,结果均值随着Taq DNA聚合酶用量的增加而增大;当Taq DNA聚合酶用量继续增加时,结果均值逐渐降低,在2.0 U时最小;随着Taq DNA聚合酶用量的继续增加,结果均值增大,在2.5 U时结果均值为最大。因此,在 25 μL 反应体系中选择2.5 U水平作为该研究PCR反应体系中Taq DNA聚合酶的最佳用量。
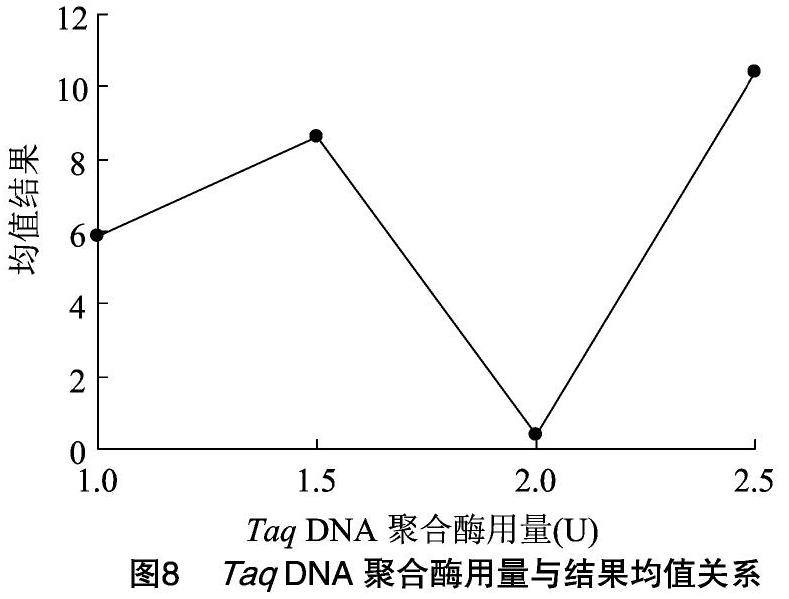
2.4.3 引物浓度对PCR扩增体系的影响 通过对引物各处理水平梯度的多重比较分析,可以看出各处理水平梯度间均差异不显著。从图9可以看出,随着引物浓度的增加,结果均值呈现先增加后降低的趋势。当引物浓度在0.3~0.7 μmol/L时,反应结果均值随着引物浓度的增加而增大,在 0.7 μmol/L 时最大;当引物浓度继续增加时,结果均值逐渐降低。因此,在25 μL反应体系中选择0.7 μmol/L水平作为该研究PCR反应体系中引物的最佳浓度。
2.4.4 Mg2+浓度对PCR扩增体系的影响 通过对因素Mg2+ 各处理水平梯度的多重比较分析,可以看出1.0、1.5、2.0 mmol/L水平间差异不显著,三者均与2.5 mmol/L水平间呈现出差异显著的关系。从图10可以看出,随着Mg2+ 浓度的增加,结果均值呈现逐渐降低的趋势。当Mg2+ 浓度在1.0 mmol/L时,反应结果均值最大。因此,在25 μL反应体系中选择最大值1.0 mmol/L水平作为该研究PCR反应体系中Mg2+ 的最佳浓度。
2.4.5 模板DNA用量对PCR扩增体系的影响 通过对模板DNA各处理水平梯度的多重比较分析,可以看出各处理水平梯度间差异均不显著。从图11可以看出,随着DNA用量的增加,结果均值呈现先降低后增加再降低的趋势,但总体呈现比较平稳的状态,这一结论与谢运海等研究结果[14]類似。因此,在25 μL反应体系中选择2.0~3.5 ng模板DNA用量均可。
2.5 引物及其退火温度的筛选
引物的退火温度是影响PCR扩增结果的一个重要因子。本研究利用已确定的最佳素馨属 ISSR-PCR 反应体系,从100条ISSR引物中筛选出8条扩增条带清晰、多态性丰富的引物。以引物的Tm值作为中间温度,使用温度梯度PCR仪自动形成的12个温度梯度来筛选不同引物的最佳退火温度,每个温度梯度设置2个重复(图12)。各引物的温度梯度、Tm值和筛选后的最适温度见表5。
2.6 优化后ISSR-PCR反应体系稳定性检测
以29份素馨属材料DNA为样本,用引物822和引物807来检测最佳PCR反应体系组合8(表3)稳定性(图13、图14)。结果表明,该扩增体系是稳定可靠的,适用于素馨属植物基因组ISSR分子标记的扩增,可为素馨属植物的进一步研究提供依据。
3 讨论与结论
ISSR分子标记技术因具有高多态性、稳定性、操作简单和重复性好等优点已被广泛应用于许多物种的遗传鉴定研究中。但由于物种或试验条件的差异,PCR扩增结果也会存在一定程度的差异。本研究利用单因素试验和正交试验设计相结合的方法,针对影响ISSR-PCR反应体系的dNTPs浓度、Taq DNA 聚合酶用量、引物浓度、模板DNA用量以及Mg2+浓度5个因素建立了适用于素馨属植物的最佳ISSR-PCR反应体系(25 μL):dNTPs浓度为0.10 mmol/L、Taq DNA 聚合酶用量为2.5 U、引物浓度为0.7 μmol/L、模板DNA含量为2.5 ng、Mg2+ 浓度为1.0 mmol/L。
通过对正交设计试验琼脂糖凝胶电泳图的直观评分,可知各因素对PCR扩增体系的影响程度从大到小依次为Mg2+ 浓度>Taq DNA 聚合酶用量>dNTPs浓度>引物浓度>模板DNA用量,并且各因素对扩增结果的影响均达到了极显著水平(P<0.01)。
研究发现,Taq DNA聚合酶的用量过多或者过少都不利于PCR扩增程序的进行。用量过少会导致PCR扩展产物不足,用量过多不仅易导致非特异性扩增产物的增加还会增加试验成本[15]。本研究中Taq DNA聚合酶最适用量与王佳等的研究结果[16-17]一致,均为2.5 U。
dNTPs浓度过低影响扩增效率,浓度过高可能导致PCR错配甚至产生非特异性扩增。本研究中确定dNTPs最适浓度为0.10 mmol/L,本研究dNTPs浓度与卢莉等的研究结果[18-19]是相近的。
引物浓度与DNA模板用量的结合紧密程度存在相关性。当模板DNA用量一定时,引物浓度过高,可能引起碱基间的错配和非特异性扩增的产生,从而导致扩增产物产量的下降,并可能出现Smear现象[20]。本研究中确定引物最适浓度为 0.7 μmol/L。本研究结果与朱顶红等物种研究中确定的最适引物浓度[21-22]相近。
DNA 模板质量是确保ISSR-PCR顺利有效扩增的重要因素之一。模板用量的最适范围取决于所研究的物种和模板的纯度。本研究确定模板用量是对PCR扩增结果影响最小的一个因素,并确定了DNA模板最适用量为2.5 ng。本结果与谢运海等的研究结果[14,23]存在一致性。
Mg2+ 浓度对PCR扩增的特异性和扩增产量有显著的影响。Mg2+浓度过高,会产生非特异性扩增,浓度过低,会降低Taq DNA聚合酶的活性,从而降低了扩增产物的产量。本研究Mg2+浓度是对扩增结果影响最大的一个因素,这与钱志瑶等的研究结果[24-25]存在一致性;并确定了Mg2+最适浓度为1.0 mmol/L,这与肖琳等的研究结果[26]一致。
从正交设计试验琼脂糖凝胶电泳图的结果中可以看出,16个正交处理水平的第8个处理组合为最佳处理组合。该组合(25 μL)各因素浓度或用量分别为dNTPs浓度0.10 mmol/L、Taq DNA聚合酶用量2.5 U、引物浓度0.7 μmol/L、模板DNA用量2.5 ng、Mg2+ 浓度1.0 mmol/L,与正交试验琼脂糖凝胶电泳结果图直观评分结果的方差分析和多重比较分析得到的各因素最佳用量一致。综上所述,不同物种ISSR-PCR反应体系的扩增结果具有不同程度的差异。本研究通过单因素试验和正交设计优化ISSR-PCR反应体系中的5个影响因子,建立了适用于素馨属植物ISSR-PCR反应的最佳体系,通过对该体系的验证,结果表明该体系具有很好的稳定性、可重复性,可为素馨属种质遗传多样性分析和亲缘关系的研究鉴定等方面提供参考依据。
参考文献:
[1]付 影. 素馨属植物资源及其在园林中的应用[J]. 现代农业科技,2013(2):195-196, 201.
[2]周锦业,宋 倩,李春牛,等. 基于广西茉莉产业的农业科普教育分析[J]. 热带农业科学,2017,37(5):121-124.
[3]韦仲新,周浙昆,白佩瑜. 素馨属植物花粉形态的研究[J]. 云南植物研究,1988(3):271-279.
[4]刘 忠,杨 波,杨玉国,等. 28份茉莉花种质基于TRAP技术的遗传多样性分析[J]. 分子植物育种,2017,15(1):364-369.
[5]邱长玉,高国庆,陈伯伦,等. 茉莉花ISSR-PCR反应体系的建立[J]. 北方园艺,2008(2):214-217.
[6]陈 笛,王鹏杰,郑玉成,等. 茉莉花磷酸甲羟戊酸激酶基因克隆及表达分析[J]. 南方农业学报,2018,49(10):1909-1916.
[7]熊 青,宋姣敏,崔 萌,等. 茉莉花JsPAL2基因的克隆与表达分析[J]. 热带作物学报,2018,39(7):1359-1366.
[8]胥愛丽,毕晓黎,刘布鸣,等. 扭肚藤UPLC指纹图谱建立及2种成分测定[J]. 中成药,2018,40(3):632-637.
[9]代培红,朱 瑜,姚正培,等. 葡萄种质资源ISSR-PCR反应体系的建立与优化[J]. 南方农业学报,2013,44(8):1258-1262.
[10]巨秀婷,阿啟兰,侯志强,等. 基于ISSR分子标记的郁金香品种遗传多样性分析[J]. 基因组学与应用生物学,2017,36(7):2934-2939.
[11]何天友,沈少炎,瞿印权,等. 基于ISSR标记的20种荷花品种资源遗传多样性分析[J]. 安徽农业科学,2017,45(6):128-132.
[12]王彦华,侯喜林,徐明宇.正交设计优化不结球白菜ISSR反应体系研究[J]. 西北植物学报,2004,24(5):899-902.
[13]何正文,刘运生,陈立华,等. 正交设计直观分析法优化PCR条件[J]. 湖南医科大学学报,1998,23(4):403-404.
[14]谢运海,夏德安,姜 静,等. 利用正交设计优化水曲柳ISSR-PCR反应体系[J]. 分子植物育种,2005,3(3):445-450.
[15]刘晓静,王文泉,郭凌飞.益智ISSR-PCR反应体系建立与优化[J]. 生物技术,2008,18(3):33-37.
[16]王 佳,胡永红,张启翔 .牡丹ISSR-PCR反应体系正交优化设计[J]. 安徽农业科学,2006,34(24):6465-6466, 6484.
[17]关 锰,白成科,王喆之. 正交设计优化山茱萸ISSR-PCR反应体系研究[J]. 陕西师范大学学报(自然科学版),2008,36(2):80-84.
[18]卢 莉. 武陵山区茶树种质资源遗传多样性和亲缘关系的ISSR分析[D]. 南京:南京农业大学,2009.
[19]刘 峰,顾志敏,陈析丰,等. 长春花ISSR-PCR 反应体系的正交优化[J]. 安徽农业科学,2010,38(5):2261-2263, 2267.
[20]Sobral B W S, Honeycutt R J. High output genetic mapping of polyploids using PCR-generated markers[J]. Theoretical and Applied Genetics, 1993, 86(1): 105-112.
[21]张 林. 基于形态性状和ISSR标记的朱顶红品种遗传多样性分析及ISSR指纹图谱构建[D]. 南京:南京农业大学,2012.
[22]赵丽华. 石榴ISSR-PCR反应体系的正交设计优化[J]. 北方园艺,2010(19):148-152.
[23]曾艳玲,谭晓风,曾晓峰. 采用正交设计方法优化梨ISSR-PCR反应体系[J]. 湖北农业科学,2008,47(11):1235-1238.
[24]钱志瑶,周道堂,黄秀平,等. 黔产宽叶缬草ISSR反应体系的建立与优化[J]. 生物技术通报,2015,31(7):69-75.
[25]卢 莉,张 强,王玉花,等. 利用正交设计优化茶树ISSR反应体系[J]. 经济林研究,2010,28(1):14-19.
[26]肖 琳,曾艳玲,刘卫东. 采用正交设计方法优化观赏桃ISSR-PCR反应体系[J]. 经济林研究,2017,35(4):136-140.朱海荣. 粮豆轮作下土壤培肥及养分管理对玉米铁研58生长生理及产量的影响[J]. 江苏农业科学,2020,48(23):79-83.
