双向伯克霍尔德氏菌(Burkholderia ambifaria)的研究进展
2020-02-22马赛箭安超薛文娇刘晨丁浩
马赛箭 安超 薛文娇 刘晨 丁浩
摘要:双向伯克霍尔德氏菌(Burkholderia ambifaria)是伯克霍尔德氏菌属(Burkholderia)的一个种,广泛存在于植物根际土壤及植物体内。现有研究表明,除了个别菌株具有致病性外,大部分双向伯克霍尔德氏菌具有许多对植物和环境有益的功能,如生物修复、固氮、促生、诱导植物抗性等。近年来,双向伯克霍尔德氏菌已经在生物防治、生物促生、疫苗研制、天然产物开发等方面被广泛研究,是一种具有重要应用价值的微生物资源。本文综述了双向伯克霍尔德氏菌的研究现状,旨在为进一步应用研究提供参考。
关键词:伯克霍尔德氏菌;生物防治;生物促生;天然产物;脂肪酶;疫苗开发
中图分类号:S182 文献标志码: A 文章编号:1002-1302(2020)23-0023-05
伯克霍尔德氏菌属(Burkholderia)是1992年根据基因分析后从假单胞菌属(Pseudomonads)中分离出来的一个仅含7个物种的独立属[1]。伯克霍尔德氏菌属最初是以植物和人类致病菌[洋葱伯克霍尔德氏菌群(Burkholderia cepacia complex,简称Bcc)和类鼻疽伯克霍尔德氏菌(Burkholderia pseudomallei)]的身份进入人类视野[2]。然而,随着研究的深入,人们逐渐认识到伯克霍尔德氏菌属广泛分布于各种生境,是一类种类繁多、功能多样的革兰氏阴性菌,正式命名已经达到100多种(http://www.bacterio.net/burkholderia.html)。它们或独立生存于水体、土壤中,或在植物、动物、真菌体内寄生或共生。现有的研究表明,除了个别伯克霍尔德氏菌属菌株具有致病性外,伯克霍尔德氏菌属的大部分物种拥有许多对植物、环境有益的功能,如生物修复、固氮、促生、诱导植物抗性等[3]。因此,伯克霍尔德氏菌属受到越来越多地关注,并成为植物根际促生菌(plant growth promoting rhizobacteria,简称PGPR)的一个热点研究菌属[4]。双向伯克霍尔德氏菌(Burkholderia ambifaria)是Coenye等于2001年在对19株来源于环境和临床的洋葱伯克霍尔德氏菌相似株进行多相分类研究时,提出的一个Bcc新成員,命名为双向伯克霍尔德氏菌,模式菌株为B. ambifaria AMMD LMG 19182[5]。近年来,国内外都进行了双向伯克霍尔德氏菌在生物防治方面的研究,在生物酶制剂、疫苗研制、天然产物开发领域双向伯克霍尔德氏菌也表现出一定的潜力。本文对双向伯克霍尔德氏菌的生物功能研究现状进行综述,并展望其发展趋势,以期为双向伯克霍尔德氏菌的研究与利用提供参考依据。
1 双向伯克霍尔德氏菌防治植物病害的有效成分
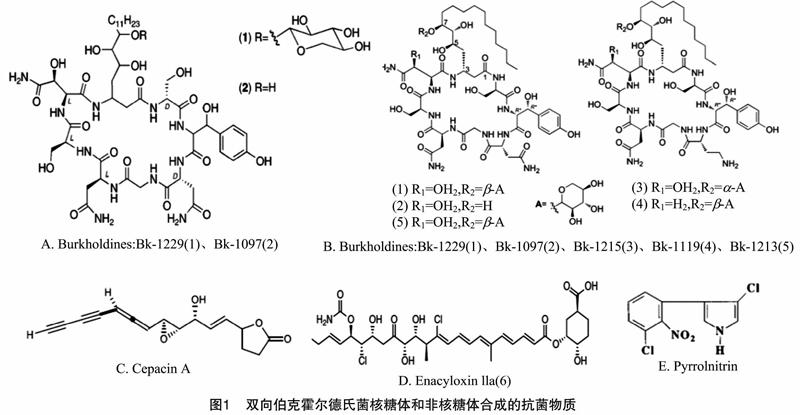
双向伯克霍尔德氏菌具有多种抑制植物病源真菌活性的功能,能有效抑制黄瓜、胡椒、大豆、草莓和番茄中的土传真菌包括尖孢镰刀菌(Fusarium oxysporum)、终极腐霉菌(Pythium ultimum)、立枯丝核菌(Rhizoctonia solani)和齐整小核菌(Sclerotium rolfsii)等[6-7]。此外,该菌也可在体外及辣椒根部有效抑制寄生的根结线虫(Meloidogyne incognita)的生长,控制其种群生物量,是一种具有广谱抑制植物病虫害的微生物[8]。经基因组分析显示,双向伯克霍尔德氏菌基因中含有多种抗生素合成基因簇,图1是双向伯克霍尔德氏菌产生的抗生素的结构。
研究者于2009年首次从B. ambifaria 2.2N的菌体喷雾干燥物中分离获得了Burkholdines(简称Bk),它是一类具有抗真菌活性的环脂肽物质,是由2个非蛋白质氨基酸组成;获得的Burkholdines是包含β-羟基色氨酸和β-羟基天冬酰胺的八肽化合物BK-1229和BK-1097(图1-A),这2个化合物对多个真菌具有抑制作用,且对供试真菌的抑菌效价是两性霉素B的2~60倍[9]。随后,该团队又从B. ambifaria 2.2N菌中分离出3个Burkholdines类化合物,分别为Bk-1119、Bk-1213 和Bk-1215(图1-B),并对这3个纯化合物的抗真菌活性和溶血活性进行了评估,结果显示它们对3个供试真菌酿酒酵母菌(Saccharomyces cerevisiae)、白色念珠菌(Candida albicans)和黑曲霉(Aspergillus niger)的抑制效价是两性霉素B的25倍[10]。因此,推断这些化合物可以为新型抗真菌药物开发提供先导结构。对64株不同来源的双向伯克霍尔德氏菌进行基因组挖掘及代谢组分析显示,双向伯克霍尔德氏菌拥有抗生素头孢菌素(Cepacin)生物合成基因簇且能够代谢产生抗生素Cepacin(图1-C);进一步测试表明,Cepacin能够有效防治由真菌引起的作物真菌病害[11]。烯酰氧基蛋白(Enacyloxins)是由聚酮合酶(polyketide synthase,简称PKS)编码的一类罕见的多烯类抗生素,Mahenthiralingam等筛选出了几株具有抗菌活性的双向伯克霍尔德氏菌菌株,它们对广泛耐药的革兰氏阴性病原菌鲍曼不动杆菌(Acinetobacter baumannii)表现出很强的抗菌活性,进一步研究发现该菌株的抗菌代谢化合物为Enacyloxins(图1-D)[12]。硝吡咯菌素(Pyrrolnitrin)(图1-E)是一种强效的抗真菌、抗细菌的次级代谢产物,可由伯克菌属、假单胞菌属、黏球菌属、沙雷菌属和肠杆菌属等产生。硝吡咯菌素在Bcc菌株对植物病源真菌如立枯丝核菌和镰刀菌的生物防治中起关键作用。除此之外,硝吡咯菌素也能抑制白色念珠菌和一些革兰氏阳性细菌的生物活性,但对革兰氏阴性菌无效。虽然,目前没有从双向伯克菌中分离获得硝吡咯菌素化合物的报道,但在B. ambifaria菌中发现了硝吡咯菌素合成基因及操纵子基因[13]。此外,笔者已经通过液质联用(LC-MS)技术在双向伯克霍尔德氏菌种中检测到了硝吡咯菌素化合物。
双向伯克霍尔德氏菌还能产生具有生防活性的挥发性物质。研究者分别收集来源于植物根、根际土和临床的3株双向伯克霍尔德氏菌在独立生长过程中的挥发性物质,并进行植物促生、病原真菌生长抑制及细菌耐药性等活性分析。结果表明,3株菌株中挥发性混合物组成相似,以含硫化合物、酮和芳香族类化合物为主要组成成分,其中,二甲基二硫醚(dimethyl disulfide)的含量最高。进一步分析显示,二甲基二硫醚、乙酰苯(acetophenone)、3-己酮(3-hexanone)能够促进植物根及地上部分生长;二甲基二硫、三硫化合物(dimethyl trisulfide)、4-辛酮(4-octanone)、甲基硫代磺酸甲酯(S-methyl methanethiosulfonate)、1-phenylpropan-1-one和2-十一酮(2-undecanone)能够有效抑制病源真菌生长;二甲基三硫化物(dimethyl trisulfide)、1-甲硫基-3-戊酮(1-methylthio-3-pentanone)、邻氨基苯乙酮(O-aminoacetophenone)等化合物具有增强大肠杆菌对氨基糖苷类抗生素的耐药性。另外,通过构建突变株的方法证明,这些活性挥发性物质的分泌是不受群体感应(quorumsensing,简称QS)机制调控的[14]。
2 双向伯克霍尔德氏菌的促生作用
双向伯克霍尔德氏菌除了能抑制植物病源真菌,也能促进植物生长、生成促生代谢物。从大麦根际细菌中筛选出1株同时具有拮抗病源真菌和促进植物生长功效的菌株T16,经过分子生物学鉴定为B. ambifaria,该菌株还能够代谢产生铁载体(siderophore)、吲哚-3-乙酸(indole-3-acetic acid,简称IAA)和1-氨基环丙烷-1-羧酸脱氨酶(ACC),该菌也具有形成生物膜(biofilm)、溶解态有机磷(dissolved organic phosphorus)等特性,并在大田试验中能够使大麦增产8%[15]。氮是植物生长不可或缺的营养元素,是合成蛋白质的主要来源。固氮菌可以把空气中植物无法吸收的氮气转化为氨,为植物提供可直接利用的氮源。固氮菌主要有根瘤菌属(Rhizobium)、弗兰克氏菌属(Frankia)和一些蓝细菌。除此之外,伯克菌属的多个种属也具有这一能力,其中也包括双向伯克霍尔德氏菌。在利用5种不同的根际细菌对籽粒苋(Amaranthus cruentus)進行促生增产研究时,发现B. ambifaria Mex-5能显著促进籽粒苋的增产,深入研究发现促生增产主要是该菌能够协助植物摄入空气中的氮元素[16]。此外,B. ambifaria MCI 7菌株能协助玉米摄入氮元素[17]。
3 双向伯克霍尔德氏菌的生防、促生机制
双向伯克霍尔德氏菌除了能够产生抗菌物质及促生物质外,还具有一些生防机制(环境定殖特性、植物互作特性、群体效应特性等),这可能与其拥有不同寻常的大基因组(3~9 Mb)有关,这些基因组中包含1~3个染色体和多达5个质粒[11]。双向伯克霍尔德氏菌可在多种植物体内定殖,它首先定殖于根表,然后通过细胞内膜间隙、次生根节点、表皮的伤口区域等渗透到细胞内[18]。伯克霍尔德氏菌可耐受植物根部的分泌物,从而有利于其在根部定殖,同时,还能生成抗细菌物质,使得它和其他的土壤细菌竞争时更具有优势。此外,伯克霍尔德氏菌的定殖也能够促进植物互作,提高植物防御体系,这些防御体系包括活性氧(ROS)、植物激素的产生,丝裂原活化蛋白激酶的激活及胼胝质沉积等[19-20]。
群体感应是一种基于微环境中信号分子释放的细菌细胞间的通信系统。当细菌数量增加时,信号分子浓度增加,达到一个阈值从而触发目标基因的调节[21]。QS系统最初是在费氏弧菌(Vibrio fischeri)中发现的[22],后来才认识到它在细菌中普遍存在,被认为是细菌感知微环境并与之相互作用的一种手段。在革兰氏阴性菌中,N-酰基高丝氨酸内脂(AHLs)是最常用的信号分子,通常由LuxI蛋白家族的自诱导合成酶产生,并被LuxR家族的转录调节因子感知,CepR则作为转录调节因子,这个CepI/R系统可调节多种胞外物质,除了生成毒力因子外,还具有生成铁载体、提高蛋白酶活性、形成生物膜等功能[23]。经液相色谱-质谱(LC-MS)分析显示,在B. ambifaria HSJ1菌株中C8-HSL是主要的信号分子,含量可达3 mg/L。利用表型研究和全基因组转座子诱变筛选的方法来识别该菌株受QS调控的基因及功能时发现,在双向伯克霍尔德氏菌B. ambifaria HSJ1中铁载体含量、蛋白酶活性、胆固醇氧化酶活性、溶血活性、病原真菌抑菌活性、毒力、菌落形态都是受CepI调节的,即这些都是受QS调控的。此外,双向伯克霍尔德氏菌的几种抗真菌化合物Burkholdines、Enacyloxins和硝吡咯菌素的产生也已经被证明均受QS控制[13]。此外,QS系统在根际定殖,与植物、多种微生物菌群落的相互作用中都起着至关重要的作用。
4 双向伯克霍尔德氏菌的其他作用
4.1 脂肪酶生产
除了生防和促生作用之外,双向伯克霍尔德氏菌也被报道能够产生脂肪酶。从1株耐有机溶剂的双向伯克霍尔德氏菌YCJ01中通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离出分子量为 34 ku 的脂肪酶,该酶在一定范围内的温度、pH值、溶剂体系下活性稳定,在有机催化及制药领域具有一定的开发价值[24]。
4.2 相关疫苗开发
双向伯克霍尔德氏菌同洋葱伯克霍尔德氏菌、类鼻疽伯克霍尔德氏菌一样,都属于条件性致病菌,可诱发易感人群(如肺部囊性纤维化患者或慢性肉芽肿病患者)产生不可控的坏死性肺炎和败血症[25]。
目前,还没有针对伯克霍尔德氏菌的有效疫苗。虽然减毒活疫苗和热灭活细菌疫苗都已被证明,作为各种细菌性病原体的候选疫苗是高度有效的,但是,这类针对伯克菌的疫苗对小鼠的疾病和死亡几乎没有任何保护作用。另一种可能见效的疫苗类型是传统的结合疫苗,原理是细菌表面多糖通过化学方法与载体蛋白结合。这类疫苗已被证明是非常有效的,如b型流感嗜血杆菌(Haemophilus influenzae)结合疫苗,它几乎消除了世界上大部分地区的感染。然而,制造这些结合疫苗需要复杂的化学合成技术将多糖附着在蛋白质载体上[26]。
细菌脂多糖由脂质、核心寡糖和O-抗原组成,是细菌和宿主细胞进行交流的重要因子,在免疫调节中发挥着重要的作用,可以作为一种理想的抗原靶标。而Bcc脂多糖上的O-抗原是抗体识别必不可少的部分,与细菌的入侵和毒力有关。它不仅可以激发细胞因子促进IL-1β的产生,还有调节巨噬细胞吞噬的作用和干扰支气管上皮细胞的细菌黏附作用[27]。Castro等成功地对B. ambifaria 19182的O-抗原进行了分离和结构鉴定,获得该菌含有O-抗原的2种结构多糖OPS-1和OPS-2,其中首次在Bcc菌属中发现OPS-2重复单元结构中含有一分子的6-脱氧阿卓糖[28]。近年来随着化学合成技术的进步,纯度更高且结构更明确的寡糖分子(包括O-抗原)被合成并用于设计、开发预防Bcc感染的糖缀合物疫苗。Wang等基于 OPS-2 抗原的二糖重复单元设计并合成得到了3个目标化合物,同时还在目标分子还原端的糖基碳元素上引入含有游离氨基的丙基链,以利于它们与具有活性的载体蛋白或者载体分子链接形成糖缀合物,用于后续B. ambifaria致病菌的临床诊断以及生物疫苗研究[29]。
5 展望
目前,芽孢杆菌(Bacillus)和假单胞菌(Pseudomonas)已经被广泛用做农用生物菌剂,在生物防治和促生方面具有顯著的效果。然而,在实际应用过程中,土壤中的农药残留以及植物致病菌产生的有害代谢物可能会抑制生防、促生菌的定殖,进而限制微生物菌剂的效果。伯克霍尔德氏菌具有一定的药物耐受性,同时具有降解多种有害物质的特性。基于一些致病性镰刀菌(fusarium)感染作物过程中会在土壤中释放出有害代谢物镰刀菌酸(fusaric acid),破坏作物根际微生态环境,而普通生防菌容易被镰刀菌酸抑制不能定殖发挥作用的问题,有学者从环境中分离获得一株同时具有降解镰刀菌酸和抑制大麦致病性镰刀菌(Fusarium)的B. ambifaria T16[15]。因此,系统调查目标作物土壤的物化特性,筛选能够适应目标作物土壤物化环境且能够改善现有作物土壤微生态及理化特性的多功能双向伯克霍尔德氏菌菌株是未来研究的发展趋势。
伯克霍尔德氏菌在20世纪曾经被开发成生物农药商品并上市,如在美国注册的有Blue Circle、Type Wisconsin、Deny、Intercepty、MBI-206 EP等。然而,在20世纪90年代,伯克霍尔德氏菌被证明与囊性纤维化(CF)患者的严重肺部感染有关,因此人们担心它们的生物安全性,最终这些微生物杀菌/虫剂撤出市场。采用类似生产活疫苗的基因工程技术,利用基因编辑技术删除双向伯克霍尔德氏菌中与致病性相关的基因簇,获得伯克霍尔德氏菌突变株,该菌株在植物盆栽试验中展示出良好的生物防治特性,而在小鼠肺部感染模型中未引起感染[11]。生防菌在植物体中的定殖与互作是直接影响生防菌生防效果的关键因素。针对一株具有促生功效的B. tropica strain MTo-293构建荧光蛋白标记菌株,通过荧光示踪试验表明,该菌株能够在番茄根部有效地定殖且能够蔓延到植物各个组织,有效地定殖使得接种该促生菌的西红柿产量显著提高[30]。因此,随着分子生物技术的快速发展,利用高通量测序、基因编辑、荧光标记示踪等技术开发安全、有效的基于双向伯克霍尔德氏菌的生防菌亦是未来的发展趋势。
伯克霍尔德氏菌基因组中聚酮合酶和非核糖体多肽基因簇数量仅次于放线菌,能够产生大量活性次级代谢产物,是一类重要的天然产物产生菌。然而,全基因组测序发现伯克霍尔德氏菌基因组中仍然含有大量的隐秘生物合成基因簇尚未开发。随着测序技术的快速发展和测序价格的降低,完整的微生物全基因组序列有助于通过基因挖掘技术发现更多有价值的信息。利用基因组挖掘技术从双向伯克霍尔德氏菌AMMD菌株中发现了抗菌物质cepaciachelin和鸟氨酸(ornibactin)合成基因簇[31];基于基因组数据挖掘,从B. ambifaria中发现了Dioxygenase合成基因簇并进行异源表达[32];对来源于B. ambifaria AMMD 中的Fe(Ⅱ)/α-酮戊二酸依赖的双加氧酶[Fe(Ⅱ)/α-ketoglutarate-dependent dioxygenase]基因进行大肠杆菌的异源表达,纯化获得的该酶能够高效催化N-取代-L-亮氨酸(N-substituted L-amino acids)转化为N-取代-L-苏式-羟基亮氨酸(N-succinyl L-threo-hydroxyleucine)[33];山东大学张友明教授团队建立了伯克氏菌中以Red/ET DNA重组工程技术为核心的基因组编辑和隐秘生物合成途径的原位激活平台,基于该技术实现了3株伯克氏菌的基因组发掘,激活和鉴定出多个隐秘基因簇,并对2类新型的脂肽类化合物glidopeptins和rhizomides的结构和生物活性进行了系统研究[34]。因此,通过生物信息学分析及基因编辑等技术,基于双向伯克霍尔德氏菌开展同源细胞工厂构建或未知基因簇异源表达体系挖掘新结构、新活性天然产物也是未来的发展方向。
参考文献:
[1]Yabuuchi E,Kosako Y,Oyaizu H,et al. Proposal of Burkholderia gen. nov. and transfer of seven species of the genus Pseudomonas homology group Ⅱ to the new genus,with the type species Burkholderia cepacia (Palleroni and Holmes 1981) comb. nov.[J]. Microbiology and Immunology,1992,36(12):1251-1275.
[2]Burkholder W H. Sour skin,a bacterial rot of onion bulbs[J]. Phytopathology,1950,64(1):468-475.
[3]Depoorter E,Bull M J,Peeters C,et al. Burkholderia:an update on taxonomy and biotechnological potential as antibiotic producers[J]. Applied Microbiology and Biotechnology,2016,100(12):5215-5229.
[4]Paungfoo-Lonhienne C,Lonhienne T G A,Yeoh Y K,et al. Crosstalk between sugarcane and a plant-growth promoting Burkholderia species[J]. Scientific Reports,2016,6:37389.
[5]Coenye T,Mahenthiralingam E,Henry D,et al. Burkholderia ambifaria sp. nov. a novel member of the Burkholderia cepacia complex including biocontrol and cystic fibrosis-related isolates[J]. International Journal of Systematic & Evolutionary Microbiology,2001,51(4):1481-1490.
[6]Li W,Roberts D P,Dery P D,et al. Broad spectrum anti-biotic activity and disease suppression by the potential biocontrol agent Burkholderia ambifaria BC-F[J]. Crop Protection,2002,21(2):129-135.
[7]高增毅,段康民. 一種双向伯克霍尔德氏菌及其复合生物制剂的制备及应用:CN106929446A[P]. 2018-07-17.
[8]Mao W,Lewis J A,Lumsden R D,et al. Biocontrol of selected soilborne diseases of tomato and pepper plants[J]. Crop Protection,1998,17(6):535-542.
[9]Tawfik K A,Jeffs P,Bray B,et al. Burkholdines 1097 and 1229,potent antifungal peptides from Burkholderia ambifaria 2.2N[J]. Organic Letters,2010,12(4):664-666.
[10]Lin Z J,Falkinham J O,Tawfik K A,et al. Burkholdines from Burkholderia ambifaria:antifungal agents and possible virulence factors[J]. Journal of Natural Products,2012,75(9):1518-1523.
[11]Mullins A J,Murray J A H,Bull M J,et al. Genome mining identifies cepacin as a plant-protective metabolite of the biopesticidal bacterium Burkholderia ambifaria[J]. Nature Microbiology,2019,4(6):996-1005.
[12]Mahenthiralingam E,Song L J,Sass A,et al. Enacyloxins are products of an unusual hybrid modular polyketide synthase encoded by a cryptic Burkholderia ambifaria genomic island[J]. Chemistry & Biology,2011,18(5):665-677.
[13]Chapalain A,Vial L,Laprade N,et al. Identification of quorum sensing-controlled genes in Burkholderia ambifaria[J]. Microbiologyopen,2013,2(2):226-242.
[14]Groenhagen U,Baumgartner R,Bailly A,et al. Production of bioactive volatiles by different Burkholderia ambifaria strains[J]. Journal of Chemical Ecology,2013,39(7):892-906.
[15]Simonetti E,Roberts I N,Montecchia M S,et al. A novel Burkholderia ambifaria strain able to degrade the mycotoxin fusaric acid and to inhibit Fusarium spp. growth[J]. Microbiological Research,2018,206:50-59.
[16]Parra-Cota F I,Pea-Cabriales J J,de los Santos-Villalobos S,et al. Burkholderia ambifaria and B. caribensis promote growth and increase yield in grain Amaranth (Amaranthus cruentus and A. hypochondriacus) by improving plant nitrogen uptake[J]. PLoS One,2014,9(2):e88094.
[17]Ciccillo F,Fiore A,Bevivino A,et al. Effects of two different application methods of Burkholderia ambifaria MCI 7 on plant growth and rhizospheric bacterial diversity[J]. Environmental Microbiology,2002,4(4):238-245.
[18]Baldani J I,Baldani V L D. History on the biological nitrogen fixation research in graminaceous plants:special emphasis on the Brazilian experience[J]. Anais Da Academia Brasileira De Ciências,2005,77(3):549-579.
[19]Bordiec S,Paquis S,Lacroix H,et al. Comparative analysis of defence responses induced by the endophytic plant growth-promoting rhizobacterium Burkholderia phytofirmans strain PsJN and the non-host bacterium Pseudomonas syringae pv. pisi in grapevine cell suspensions[J]. Journal of Experimental Botany,2011,62(2):595-603.
[20]Miotto-Vilanova L,Jacquard C,Barbara C,et al. Burkholderia phytofirmans PsJN confers grapevine resistance against Botrytis cinerea via a direct antimicrobial effect combined with a better resource mobilization[J]. Frontiers in Plant Science,2016,7:1236.
[21]Williams P. Quorum sensing,communication and cross-kingdom signalling in the bacterial world[J]. Microbiology,2007,153(12):3923-3938.
[22]Engebrecht J,Silverman M. Identification of genes and gene products necessary for bacterial bioluminescence[J]. Proceedings of the National Academy of Sciences of the United States of America,1984,81(13):4154-4158.
[23]Lutter E,Lewenza S,Dennis J J,et al. Distribution of quorum-sensing genes in the Burkholderia cepacia complex[J]. Infection & Immunity,2001,69(7):4661-4666.
[24]Yao C J,Cao Y,Wu S S,et al. An organic solvent and thermally stable lipase from Burkholderia ambifaria YCJ01:purification,characteristics and application for chiral resolution of mandelic acid[J]. Journal of Molecular Catalysis B:Enzymatic,2013,85/86(1):105-110.
[25]Mahenthiralingam E,Urban T A,Goldberg J B. The multifarious,multireplicon Burkholderia cepacia complex[J]. Nature Reviews Microbiology,2005,3(2):144-156.
[26]Garcia-Quintanilla F,Iwashkiw J A,Price N L,et al. Production of a recombinant vaccine candidate against Burkholderia pseudomallei exploiting the bacterial N-glycosylation machinery[J]. Frontiers in Microbiology,2014,5(5):381.
[27]Shimomura H,Matsuura M,Saito S,et al. Unusual interaction of a lipopolysaccharide isolated from Burkholderia cepacia with polymyxin B[J]. Infection and Immunity,2003,71(9):5225-5230.
[28]de Castro C D,Dinischiotu N,Feys B,et al. Structural identification of the O-antigen fraction from the lipopolysaccharide of the Burkholderia ambifaria strain 19182[J]. Carbohydrate Research,2013,379:95-99.
[29]Wang D Y,Zhuge W W,Guo Z W,et al. Synthesis of a disaccharide repeating unit of the O-antigen from,Burkholderia ambifaria,and its oligomers[J]. Carbohydrate Research,2017,442:41-51.
[30]Bernabeu P R,Pistorio M,Torres-Tejerizo G,et al. Colonization and plant growth-promotion of tomato by Burkholderia tropica[J]. Scientia Horticulturae,2015,191:113-120.
[31]Esmaeel Q,Pupin M,Kieu N P,et al. Burkholderia genome mining for nonribosomal peptide synthetases reveals a great potential for novel siderophores and lipopeptides synthesis[J]. Microbiology Open,2016,5(3):512-526.
[32]Chung H S,Raetz C R H. Dioxygenases in Burkholderia ambifaria and Yersinia pestis that hydroxylate the outer Kdo unit of lipopolysaccharide[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(2):510-515.
[33]Hibi M,Kawashima T,Kasahara T,et al. A novel Fe(Ⅱ)/alpha-ketoglutarate-dependent dioxygenase from Burkholderia ambifaria has beta-hydroxylating activity of N-succinyl L-leucine[J]. Letters in Applied Microbiology,2012,55(6):414-419.
[34]Wang X,Zhou H B,Chen H N,et al. Discovery of recombinases enables genome mining of cryptic biosynthetic gene clusters in Burkholderiales species[J]. Proceedings of the National Academy of Sciences,2018,115(18):4255-4263.孟春妍,刘向南. 土地承包期再延长30年政策與农户意愿问题研究综述[J]. 江苏农业科学,2020,48(23):28-35.
